典型沼气发酵生态系统微生物多样性的变化研究
2022-02-28曾维庆岳志强
曾 锦,鲁 艺,徐 锐*,孙 蓉,刘 莹,曾维庆,岳志强,周 鹰
(1.云南师范大学 能源与环境科学学院,云南 昆明 650500;2.江苏省农业科学院 农业设施与装备研究所,江苏 南京 210014;3.玉溪市农业环境保护和农村能源工作站,云南 玉溪653100;4.九溪镇规划建设和环境保护中心,云南 玉溪 652604))
随着人民生活水平提高,中国的畜禽养殖业发展迅速,畜禽粪便的处理方式也在不断完善,其中,沼气池因其诸多优势,被广泛地运用在农村地区以及畜禽养殖场,尤以户用水压式沼气池为主。沼气发酵技术属于厌氧消化技术中的一种,其主要利用厌氧微生物消化分解沼气池内的有机物质,最终产生沼气。沼气发酵是一个极其复杂的过程,依靠多种菌群协同共生代谢,其中产甲烷菌是沼气发酵微生物的核心,而沼气池稳定运行的关键是微生物生态系统能够维持高效稳定的动态平衡。云南因其独特的气候条件,是理想的发展沼气池的地区。玉溪市江川区九溪镇位于云南省中部偏东,属于亚热带半干燥高原季风气候类型,年平均温度约15.7℃,适合发展沼气池建设。田光亮采用批量发酵工艺对云南亚热带户用沼气池发酵过程进行模拟并对系统中原核生物群落进行了动态研究;李秋敏分析了云南亚热带户用沼气池原核微生物多样性并对冬季和夏季沼气池中的微生物进行了计数和形态的观察。然而目前对于云南省亚热带气候地区的水压式沼气池实际发酵过程中微生物群落的变化,缺乏系统性及长期性研究。本试验采用16S rDNA测序技术对玉溪市九溪镇某稳定运行的水压式沼气池内微生物多样性及结构组成进行了长期研究,揭示不同时间段云南亚热带典型沼气发酵生态系统微生物多样性的变化特征,同时对产甲烷过程中的主导菌群进行分析,进而反映产甲烷途径的变化情况,以期为优化水压式沼气池的发酵工艺提供科学依据。
1 材料与方法
1.1 试验材料
本研究所选用的沼气池在云南省玉溪市江川区九溪镇中营村某生猪养殖场(育肥猪存栏98头)附近,沼气池容积为100 m,以猪粪为发酵原料,属于典型的规模化养殖小区小型联户沼气池。该沼气池长期稳定运行,池内pH 6.5~7.5,甲烷含量63.62%~67.16%。
2019年2-6月,每月定期选择1天于11:30 AM 左右,从沼气池出料口底部采集10 mL发酵料液置于15 mL塑料采样瓶,每次采3~5个样品,于当天送返云师大能环学院生物质能实验室并放于-80℃冰箱冷冻保存。采样池环境参数见表1。后期统一将所有的微生物样品送至上海锐翌生物科技有限公司进行16S rDNA测序。

表1 采样当天部分环境因子参数Table 1 Some environmental factor parameters on the sampling day
1.2 试验方法
1.2.1 样品基因组DNA抽提和质检 每个样品取3 mL发酵料液,4 ℃、9401.7 g离心4 min,取底泥样品提取总DNA,利用Thermo NanoDrop 2000紫外微量分光光度计和1 %琼脂糖凝胶电泳进行检测。
1.2.2 引物设计和合成 选择V3~V4区作为16S rDNA的扩增区域,引物为通用引物341F(5'-CCTACGGGRSGCAGCAG-3')和806R(5'-GGACTACVVGGGTATCTAATC-3')。在通用引物的5'端加上合适的I11umina Hiseq PE250测序的接头序列和index序列。
1.2.3 PCR扩增和产物纯化 以稀释后的基因组DNA为模板,使用KAPA HiFi HotstartReadyMix PCR kit高保真酶,参照Sundberg C等的试验设置PCR参数进行PCR。用AxyPrep DNA凝胶回收试剂盒回收和纯化PCR产物,利用Thermo NanoDrop 2000光谱测定仪和2 %琼脂糖凝胶进行文库质检。
1.2.4 PCR产物定量化和均一化 在文库质检合格后,使用Qubit进行文库定量,同时根据每个样品的数据量要求进行相应比例的混合。
1.2.5 I11umina高通量测序 使用I11umina Hiseq PE250进行上机测序。
1.2.6 数据分析 采用Pandaseq(V2.9)软件,利用序列的重叠关系将双末端测序得到的成对Reads拼成一条序列,得到高变区的长Reads。利用Usearch(V7.0.1090)软件在0.97相似度下进行标准聚类,对聚类后的序列进行嵌合体过滤,得到OTU(Operational Taxonomic Units)的代表序列,一个OTU代表一个物种。为避免因样品数据大小不同而造成分析时的偏差,在测序深度足够的情况下,对每个样品进行随机抽平处理,使用Qiime(V1.9.1)软件做出相应的稀释曲线并进行Alpha多样性分析。从每个OTU中分别提取一条Read作为代表序列,使用RDP方法将该代表序列与已知物种的RDP数据库进行对比,对每个OTU进行物种分类。归类后,以每个OTU中序列的条数为依据,得到OTU丰度表,最后根据此丰度表进行后续分析。
2 结果与分析
2.1 沼气发酵过程中微生物群落多样性变化分析
2.1.1 基于OTU水平的分析 本研究获得177 365条有效序列,聚类共产生1 069个OTU。5组试验中所共有的物种有543个,分别占A1、A2、A3、A4和A5总物种的60.07%、60.81%、65.90%、63.96%和67.04%;A1、A2、A3、A4和A5特有的物种分别为12、8、1、3和8个。
由图1可知,A2与A3距离较近,A4与A5距离较近,说明沼气池池内微生物群落组成在3月份和4月份、5月份和6月份变化不大;A1与其他试验组距离较远,说明2月份与其它月份相比沼气池内微生物群落组成差异较大;各试验组均呈现不同月份的微生物沿着横坐标有规律的波动,随着时间的延长,微生物之间的距离越远,说明沼气池池内微生物随着季节的变化存在波动性变化。
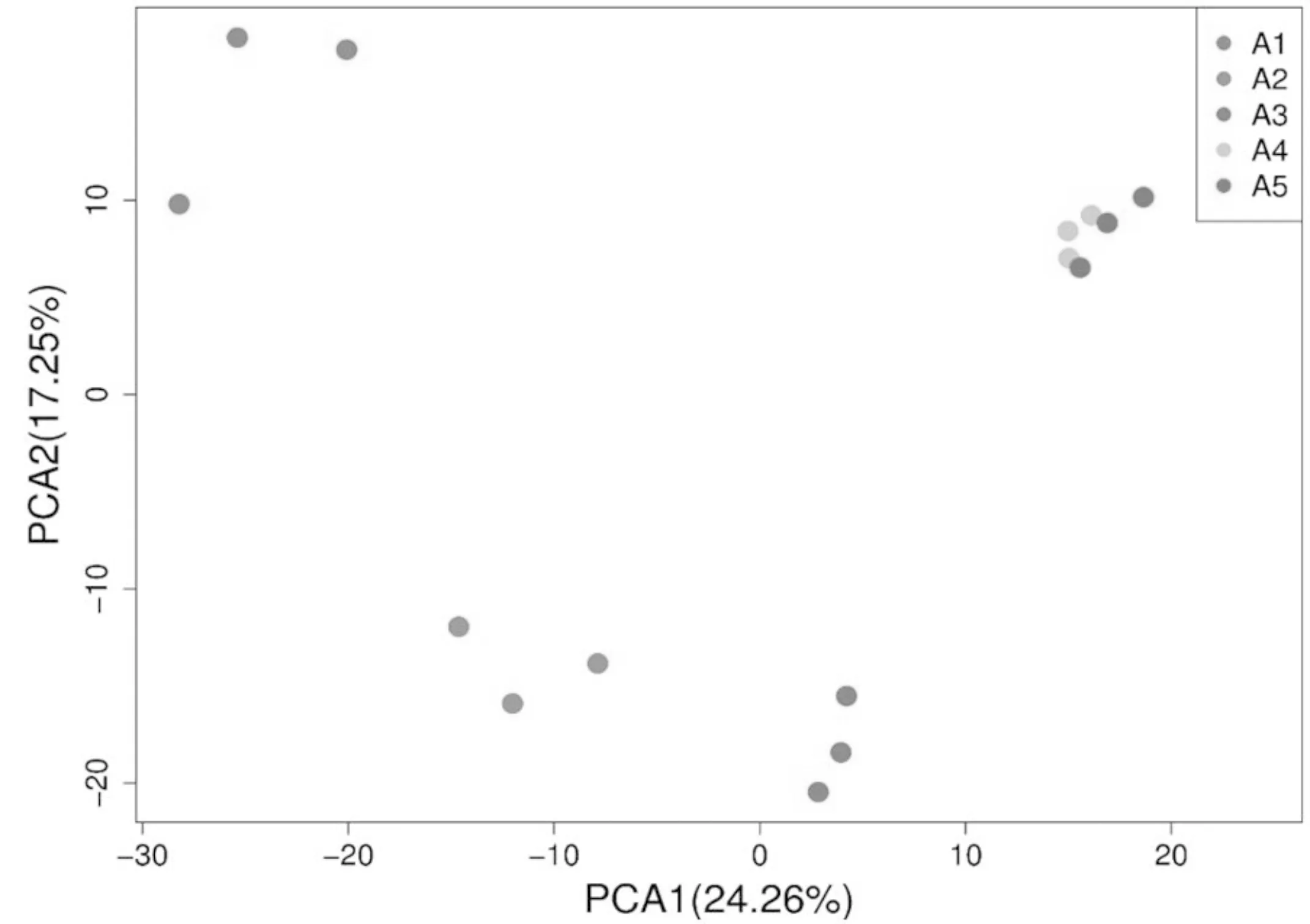
图1 基于OTU丰度的PCA分析Fig.1 Principal component analysis based on OTU abundance
2.1.2 基于Alpha多样性分析 由表2可知,A1组Chao 1指数和Observed species指数均最大,说明沼气池池内微生物群落在2月份丰度最大;A5组Chao 1指数和Observed species指数均最小,说明沼气池池内微生物群落在6月份丰度最小。由5组试验样品的Shannon指数可以看出,Shannon指数呈逐渐下降趋于稳定的趋势,中间略有波动但波动性不大,A1组Shannon指数最大,反映出其均一性最好,微生物群落多样性最大;Simpson指数均在0.9以上,说明各组样品中均含有十分丰富的微生物种类;样品覆盖度Goods-Coverage指数均为0.99,说明样品的采样和测序均有较高的覆盖度;5组样品的PD-whole Tree指数差异性较小,说明其物种丰富度相差不大,其中A1组物种最丰富。

表2 不同样品中Alpha多样性分析Table 2 Alpha diversity analysis in different samples
2.1.3 基于Beta多样性分析 由图2可以看出,所有的试验样品主要分为3大聚类,其中 A2和A3组成第一大类,A1组成第二大类,A4和A5组成第二大类,这与之前的PCA分析结果相一致。从整体上看,所有样品的UniFrac距离介于0.15~0.35之间,说明所有样品物种组成的相似度较高,这与之前的Alpha多样性分析结果相一致。以A1为对照样,可以看出随着月份的推移,样品之间的UniFrac距离逐渐增大,微生物的多样性也在缓慢演替,其中A4和A5的距离相对较近,说明该地区5月份和6月份沼气池池内微生物多样性变化较小,微生物中的物种组成逐渐趋于稳定,这与月平均气温的变化相一致,进一步反映了发酵温度对沼气池池内微生物的影响。

图2 样品Beta多样性分析的heatmap图Fig.2 Heatmap of Beta diversity analysis of samples
2.2 沼气发酵过程中微生物群落结构组成的变化研究
2.2.1 沼气发酵过程中的优势菌群 本研究检测到的古菌群落占整个微生物群落的3%,细菌群落占整个微生物群落的97%,表明沼气发酵微生物中古菌群落所占比重远小于细菌群落,这与Sundberg等和代媛的研究结果相一致。本研究将相对丰度大于5%的菌群定义为优势菌群,将相对丰度大于1%但小于5%的菌群定义为亚优势菌群。
由图3可知,在目水平上,梭菌目(Clostridiales)、甲烷八叠球菌目(Methanosarcinales)、拟杆菌目(Bacteroidales)、厌氧绳菌目(Anaerolineales)是在沼气发酵稳定运行过程中占主导地位的4种优势菌群,其平均相对丰度分别是33.80%、27.70%、18.60%和5.38%。亚优势菌群有Synergistales、乳杆菌目(Lactobacillales)、甲烷微菌目(Methanomicrobiales)和Selenomonadales。

图3 沼气发酵微生物菌群在目水平上的相对丰度Fig.3 The relative abundance of microbial flora from biogas fermentation at the order level
由图4可知,在属水平上,甲烷丝菌属()、、梭菌属()为沼气发酵稳定运行过程中占主导地位的3种优势菌群,其中的相对丰度在A2试验组最小为26.54%、在A5试验组最大为53.83%,的相对丰度在A3试验组最小为6.85%、在A1试验组最大为14.53%,的相对丰度在A5试验组最小为6.36%、在A2试验组最大为10.24%。亚优势菌群有、、乳杆菌属()、、、、、、甲烷螺菌属()、。
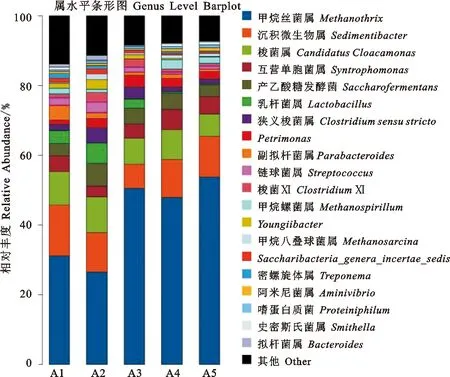
图4 沼气发酵微生物菌群在属水平上的相对丰度Fig.4 The relative abundance of microbial flora from biogas fermentation at the genus level
2.2.2 产甲烷过程中的主导菌群分析 广古菌门(Euryarchaeota)的菌群属于沼气发酵微生物中的优势菌群,其相对丰度从2月份到6月份始终大于15%。检测到Euryarchaeota门里包含3类产甲烷菌,分别是优势菌群甲烷八叠球菌目(Methanosarcinales)、亚优势菌群甲烷微菌目(Methanomicrobiales),同时还检测到甲烷杆菌目(Methanobacteriales)。Methanosarcinales属于产甲烷菌中的乙酸型产甲烷菌,Methanomicrobiales和Methanobacteriales属于产甲烷菌中的氢营养型产甲烷菌。由图4可知,Methanosarcinales在各试验组中始终处于主导地位,Methanosarcinales的相对丰度在3月份最小为17.79%、在6月份最大为34.06%。
在属水平上的产甲烷菌主要有甲烷丝菌属()、甲烷螺菌属()和甲烷八叠球菌属(),它们的平均相对丰度分别为42.00%、1.38%和0.88%,同时在属水平上还检测到了甲烷球形菌属()、甲烷短杆菌属()、甲烷杆菌属()、属、甲烷囊菌属()、产甲烷菌属()、甲烷粒菌属()、甲烷叶菌属()、甲烷盘菌属()、甲烷食甲基菌属(),详见表3。其中,和均属于乙酸型产甲烷菌,且是专性乙酸型产甲烷菌。
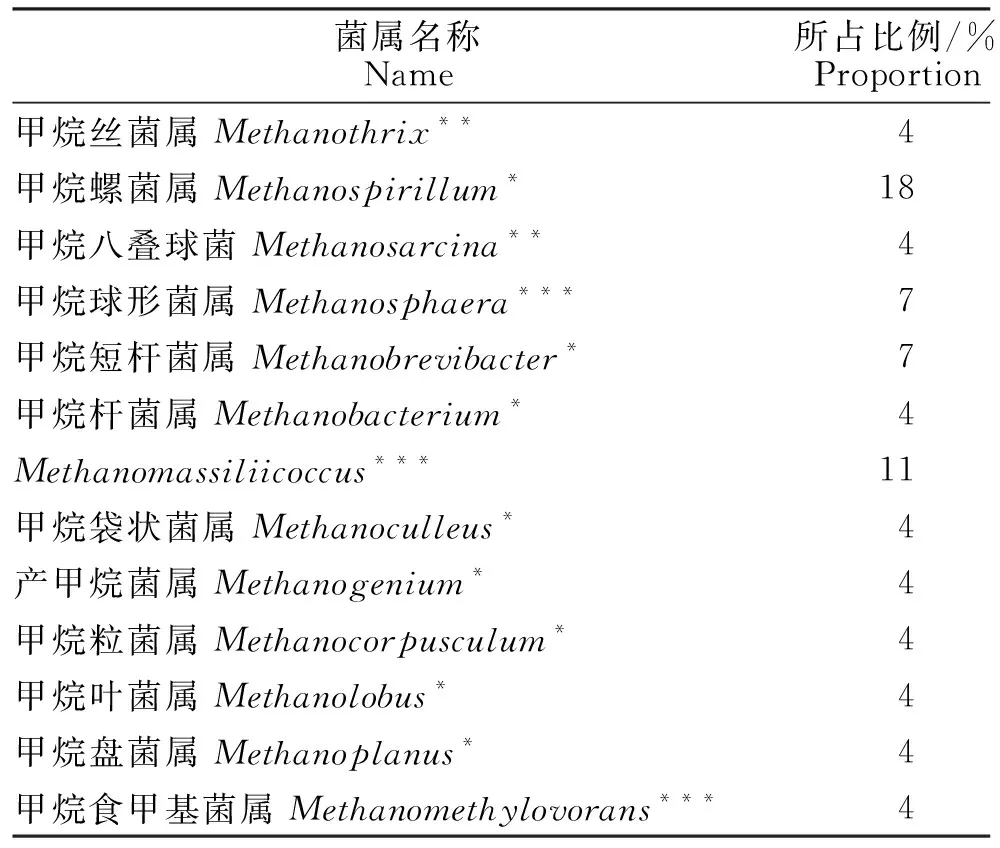
表3 属水平上检测到的各类产甲烷菌占所在古菌的比例Table 3 Proportion of various methanogenic bacteria detected to the archaea at the genus level
图5为沼气池中Top20菌属与池内温度、进料量、日产甲烷量、气压之间的相关性。由图5可以看出,池内温度、进料量、日产甲烷量与甲烷丝菌属()呈极显著正相关关系,说明温度的升高、进料量的增加能够促进的生长繁殖,池内的数目随之增加,进而乙酸等物质被利用生成甲烷;甲烷螺菌属()与池内温度、进料量、日产甲烷量呈正相关关系,与气压呈负相关关系;甲烷八叠球菌属()与池内温度、进料量、日产甲烷量呈负相关关系。
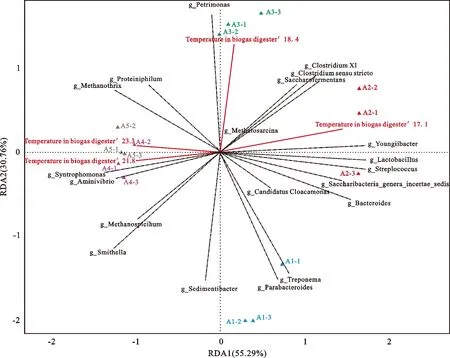
图5 部分环境因子与Top20菌群的RDA分析Fig. 5 Redundancy analysis of some environmental factors and Top20 Flora
3 讨 论
新检测出来的物种可能在之前的生长环境中因不适合生存而被抑制生长,随着气候变化导致沼气发酵温度的变化,出现一些新检测的物种,而未检测到的物种也有可能不适应当前新的生长环境;在沼气池稳定运行过程中,池内发酵微生物群落物种组成可能随着该地区的气候变化而发生变化,但总体变化不大。温度的改变对微生物群落的组成影响较大,这与王腾旭研究结果一致,A2和A3、A4和A5两者发酵温度差异均较小,因此沼气池内发酵微生物的群落组成变化差异也分别较小;微生物群落组成的变化可能进一步影响沼气池的日产气量、甲烷含量。
结合表1采样当天沼气池部分环境因子参数,A1采样当天沼气池发酵温度最低且产气量最少,而A5采样当天沼气池发酵温度最高且产气量最多,因此可能是2月份沼气池池内厌氧微生物受到低温的影响,从而抑制了产甲烷菌的生长代谢,致使池内有机酸产量增加,进而增加了沼气池池内微生物多样性的变化,也影响了沼气池的日产气量。根据评价样品Alpha多样性的各指标参数的平均值及标准差,可以看出各试验样品所含物种的丰富度和均匀度有差异,但差异性较小,这可能是因为在试验期间沼气池每天的进料量相对一致,同时该地区的温度变化相对较小,致使沼气池池内微生物的多样性变化较小,始终维持在一个较稳定的状态。
Clostridiales、Methanosarcinales、Bacteroidales的相对丰度随着月份的变化始终大于10 %,为绝对的优势菌群。这3种菌群均为严格的厌氧菌群,其中Clostridiales是纤维素分解菌,也是主要的厌氧消化产氢微生物;Bacteroidales是水解发酵细菌,能将蛋氨酸、亮氨酸和色氨酸等氨基酸大分子有机物降解为小分子脂肪酸;Methanosarcinales是主要的产甲烷菌群,能够将简单的底物如甲酸、乙酸、甲醇、H、CO等代谢生成甲烷。而本研究在属水平上所测优势菌群种类与李秋敏的研究结果存在一定的差异,可能是因为沼气池池容、运行状态的不同所造成的。
Methanosarcinales的相对丰度从2月份到3月份变化不大、从3月份到4月份逐渐变大然后趋于稳定,这和当地的气温变化具有一致性,可能是沼气池池内温度的变化加快了Methanosarcinales的生长代谢。Methanosarcinales细胞形态多样,有八叠状、球状、丝状、杆状和鞘状,同时它的底物利用类型也比较多样,既可以用H、CO作为底物产甲烷,也可以裂解乙酸盐产甲烷,同时还能分解甲基化合物产甲烷。试验结果表明在沼气发酵稳定运行的过程中,乙酸型产甲烷菌占据沼气发酵微生物菌群的一定比重,也进一步说明乙酸裂解途径产甲烷量对产甲烷总量的贡献较大,这与瞿贤等的研究结果相一致。由图4可知,每月的相对丰度远远高于其他两种产甲烷菌,属于绝对的优势菌群,表明试验期内主要以乙酸裂解途径为主导产甲烷,也从侧面反映出池内微生物群落结构的变化并没有引起甲烷转化途径发生显著性的变化,这与田光亮的研究结果相一致:15~25 ℃的温度变化对云南亚热带户用沼气池原核生物群落结构影响很小,期间微生物类群和代谢路径相似。同时该沼气发酵生态系统采用半连续发酵,长期处于一个稳定产气阶段,致使池内微生物群落结构发即使生了较小的变化,但始终处于一个动态的稳定平衡,因此试验期内主要以乙酸裂解途径为主导产甲烷。
4 小 结
(1)在典型沼气发酵生态系统稳定运行的过程中,系统内沼气发酵微生物群落结构的物种组成可能随着该地区的气候变化而发生变化,但总体变化不大。试验结果表明,气候的变化导致系统内发酵温度发生改变,而发酵温度的改变影响着系统内沼气发酵微生物群落的组成,发酵温度变化越小,系统内微生物多样性变化越小。
(2)在目水平上,梭菌目(Clostridiales)、甲烷八叠球菌目(Methanosarcinales)、拟杆菌目(Bacteroidales)、厌氧绳菌目(Anaerolineales)是在沼气发酵稳定运行过程中占主导地位的4种优势菌群;在属水平上,甲烷丝菌属()、、梭菌属()是在沼气发酵稳定运行过程中占主导地位的3种优势菌群。
(3)在产甲烷过程中,产甲烷菌主要由甲烷丝菌属()、甲烷螺菌属()和甲烷八叠球菌属()占主导,其平均相对丰度分别为42.00%、1.38%和0.88%,表明在沼气发酵稳定运行的过程中主要以乙酸型产甲烷菌为主导,甲烷转换途径随着时间的变化并未发生显著性变化。
(4)RDA分析表明池内温度、进料量均会影响产甲烷菌的生长繁殖,最终影响日产甲烷量。
