表没食子儿茶素没食子酸酯对猪精液常温保存效果的影响
2022-02-28张凌蛟吕东良刘伟东任毅杰赵梦洁陈美杰胡建宏
张凌蛟,张 眉,吕东良,刘伟东,任毅杰,赵梦洁,陈美杰,胡建宏*
(1. 西北农林科技大学,陕西 杨凌 712100;2.陕西省汉中市镇巴县渔渡镇人民政府农业综合服务站,陕西 镇巴 723600;3.陕西省畜牧技术推广总站,陕西 西安 710016)
为了提高种公猪的生产性能,人工授精技术成为生猪养殖必不可少的关键技术,而精液保存是人工授精技术的核心环节。精液保存依据保存温度的不同又可分为常温保存、低温保存和冷冻保存,其中常温保存是生产实践中应用最为广泛的保存方式。在低温环境下,精子的代谢水平降到最低,但仍会产生ROS,而过量ROS能够引起脂质过氧化,进而破坏对维持精子功能至关重要的膜的完整性,并导致精子活率下降。目前的研究表明,稀释液中添加外源性的抗氧化剂可以有效降低ROS对精子膜的氧化损伤,从而提高精液品质。Li等研究报道,低聚青花素能够有效清除自由基和ROS,显著提高猪精液总抗氧化能力。侯震坤研究表明,淫羊藿苷能够有效防止猪精液在常温保存时受到氧化损伤。任发的研究指出,鞣花酸对猪精液常温保存效果起到了积极的作用。另外,Zhu等研究报道,白藜芦醇能够显著提高精子抗氧化的防御系统功能;Tian等研究发现,丹参酸A能够增强猪精液总抗氧化能力。
儿茶素作为一种天然酚类物质,具有抗氧化的作用,而儿茶素中的EGCG更具有抗菌、抗炎及抗癌作用,并且具有较强的清除活性氧能力及金属螯合特性。谢东淇研究指出,在猪精液稀释液中加入茶多酚作为外源抗氧化剂,可以有效提高常温保存精子活率、质膜完整率和顶体完整率,有效抵御过量ROS对精子的伤害。赵琦研究认为,将没食子酸加入猪精液稀释液中可以起到较好的抗氧化效果。另外,Bucci等研究显示,EGCG与白藜芦醇配伍,可提高冷冻-解冻后猪精子活率和顶体完整率,明显提高猪精子的抗冻效果;Tvrda等指出,牛冷冻精液稀释液中添加表儿茶素可以显著减少脂质过氧化及DNA氧化损伤,提高冷冻-解冻后精子活力;Bucci等认为,犬冷冻精液稀释液中添加EGCG能够有效改善犬精子的运动性能,提高冷冻-解冻后精子活率和顶体完整性。因此,EGCG能够有效地减缓精液保存时精子所遭受的氧化损伤,并保护其膜完整性,从而提高精液品质。但是,目前关于EGCG对动物冷冻精液保存的相关研究较多,而在猪精液常温保存的方面研究较少,所以本试验旨在研究不同浓度EGCG对常温保存猪精液的影响,为猪精液常温保存提供应用依据。
1 材料与方法
1.1 试验材料
1.1.1 精液 本试验采用的精液均来自于陕西杨凌秦亥旺养殖场,用手握法采集3头14月龄的健康长白公猪精液。精液采集时间固定于早上8:00-9:00,仅收集射精中段精子富集部分,30 min内于垫有3层滤纸的保温杯中送回实验室检测原精品质,只有气味及颜色正常、镜检后活率大于80%、密度为2×10~4×10mL为合格原精,检测合格后方可用于后续试验。
1.1.2 药品和试剂 表没食子儿茶素没食子酸酯,分析标准品,纯度≥98%,上海源叶生物有限公司生产;葡萄糖(分析纯)、柠檬酸(分析纯)等为国产分析纯试剂;三羟甲基氨基甲烷(Tris)(北京索莱宝科技有限公司)、FITC-PNA(1 MG,Sigma)、DAPI(10 mL,Solarbio)。
1.1.3 主要仪器设备 猪精液检测系统CASA(HVIEW-SSA V8.0),倒置荧光显微镜,立式压力蒸汽灭菌器,17 ℃恒温箱,离心机等。
1.2 试验方法
1.2.1 试验设计 将不同浓度EGCG添加到猪精液常温保存基础稀释液中,其中,添加0 μmol/L(即不添加)EGCG组作为对照组;添加EGCG的处理组作为试验组,其添加浓度分别为5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L和50 μmol/L,每组有6个重复。
1.2.2 溶液配制 基础稀释液:按照配方准确称取氯化钾、Tris、D-葡萄糖等试剂于灭菌烧杯中,随后向烧杯中添加1 L双蒸水。
EGCG溶液的配制:称取20 mg EGCG,充分溶解于10 mL双蒸水,配制成2 mg/mL的溶液,分装于1.5 mL灭菌离心管中,用封口膜密封,锡箔纸包裹后-20 ℃冰箱保存备用。
原精检验合格后,预热稀释液并根据精子密度确定稀释比例。先将稀释液缓缓加入原精中按照1:1的比例进行稀释;平衡30 s后继续加入稀释液以达到所需浓度;混合均匀后进行分装,并置于17 ℃恒温箱中避光保存,每12 h缓慢翻动一次。
1.3 精液质量检测
1.3.1 精子活率 精子活率采用猪精液检测系统CASA(HVIEW-SSA V8.0)对常温保存第1、3、5天的精子活率进行检测。用移液枪吸取100 μL保存于17 ℃恒温箱中的精液,移入到灭菌的1.5 mL离心管中,于37 ℃水浴5 min;将载玻片与盖玻片37 ℃预热。将载玻片放置于恒温载物台,取10 μL精液滴加于载玻片上,盖上盖玻片,调节显微镜以获得清晰图像,并用CASA系统进行检测计算。
1.3.2 质膜完整率 本试验采用SYBR-14/PI荧光染色法对猪精液常温保存第1、3、5天的精子质膜完整率进行检测。
1.3.3 顶体完整率 花生凝集素-异硫氰酸荧光素法染色检测猪精液常温保存第1、3、5天的精子顶体完整率。
1.3.4 CAT活性 钼酸铵比色法原理检测猪精液常温保存第1、3和5天的CAT活性,比色波长为405 nm,相关操作均严格按照试剂盒说明书要求进行。
1.3.5 ROS水平 DHE-ROS活性氧检测检测猪精液常温保存第1、3和5天的CAT活性,相关操作均严格按照试剂盒说明书要求进行。
1.3.5 SOD活性 氮蓝四唑(NBT)光化还原法检测猪精液常温保存第1、3和5天的SOD活性,相关操作均严格按照试剂盒说明书要求进行。
1.4 数据统计分析
2 结果与分析
2.1 EGCG对常温保存猪精子活率的影响
猪常温保存精液稀释液中添加不同浓度EGCG对精子活率的影响见表1所示。由表1可知,在保存1~5 d时,对照组与稀释液中添加50 μmol/L EGCG组相比,精子活率无显著差异(>0.05)。但是,20、30 μmol/L EGCG组精子活率在保存1~5 d时均显著高于其他处理组和对照组(<0.05),且保存到第5天时20、30 μmol/L EGCG组精子活率分别达到78.36%、76.97%。因此,稀释液中添加EGCG对常温保存的猪精子活率具有积极作用,且其最适添加量为20 μmol/L。

表1 猪精液常温保存添加EGCG后的精子活率Table 1 The sperm motility of boar after adding EGCG in normal temperature
2.2 EGCG对猪精液常温保存精子质膜完整率的影响
猪精子质膜完整性检测结果见表2和图1。由表2可知,在保存2~4 d,添加 EGCG的处理组精子质膜完整率显著高于对照组(<0.05)。保存1~5 d,添加20、30 μmol/L EGCG组的精子质膜完整率显著高于其它组(<0.05),且保存到第5天时质膜完整率分别达到74.17%、73.99%。因此,稀释液中添加一定浓度的EGCG对精子质膜具有保护作用,且其最适添加量为20 μmol/L。
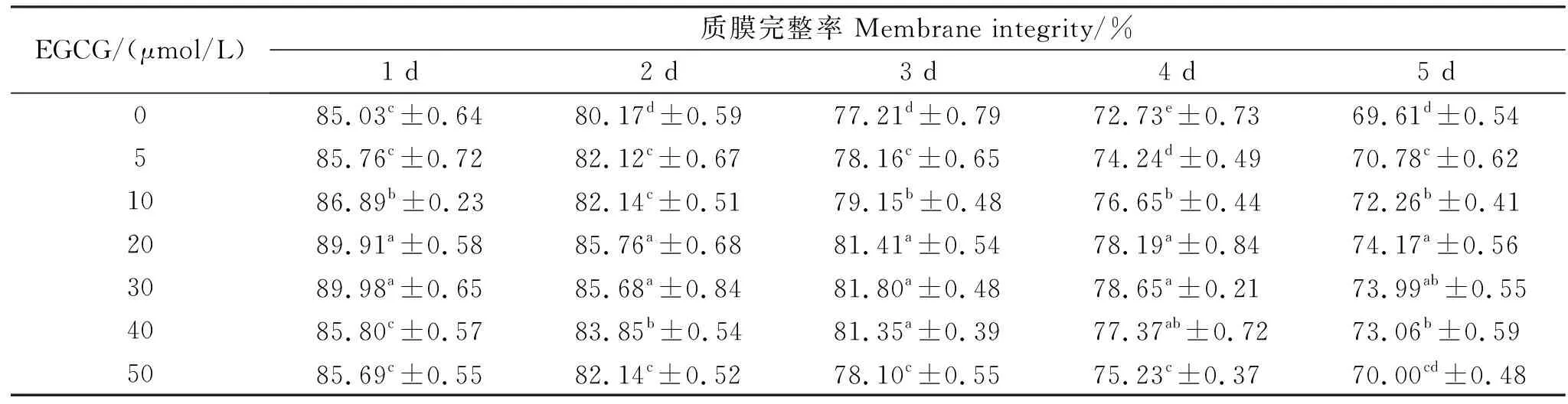
表2 猪精液常温保存添加EGCG后的精子质膜完整率Table 2 The plasma membrane integrity of boar sperm after adding EGCG in normal temperature
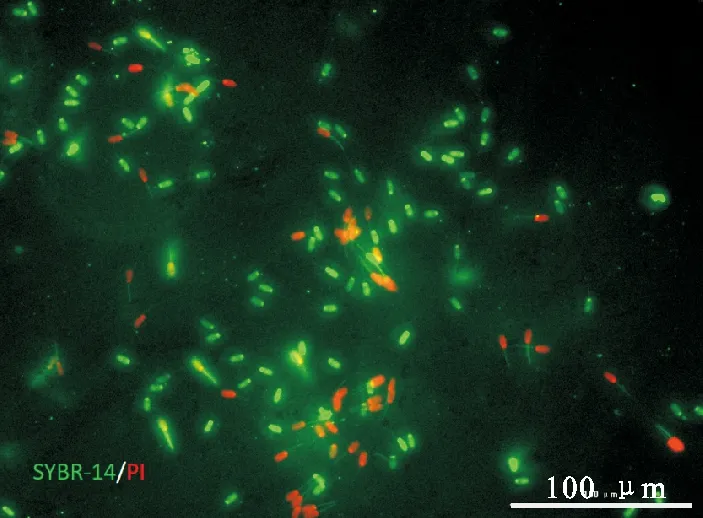
图1 猪精子质膜完整性检测SYBR-14染色呈绿色荧光代表质膜完整的精子,PI染色呈红色荧光代表质膜破损的精子。Scale bars=100 μmFig.1 Detection of boar sperm plasma membrane integrity The green fluorescence stained by SYBR-14 represents sperm with intact plasma membrane, and red fluorescence stained by PI represents sperm with damaged plasma membrane.Scale bars=100 μm
2.3 EGCG对常温保存猪精子顶体完整率的影响
猪精子顶体完整性检测结果见表3和图2。由表3可知,在保存第1、2、5天时,添加EGCG的处理组,精子顶体完整率均显著高于对照组(<0.05)。添加20、30 μmol/L EGCG后,保存第1~5天的顶体完整率均显著高于其它组(<0.05),第5天时顶体完整率分别为63.09%和62.25%。因此,稀释液中添加一定浓度的EGCG对精子顶体具有保护作用,且其最适添加量为20 μmol/L。
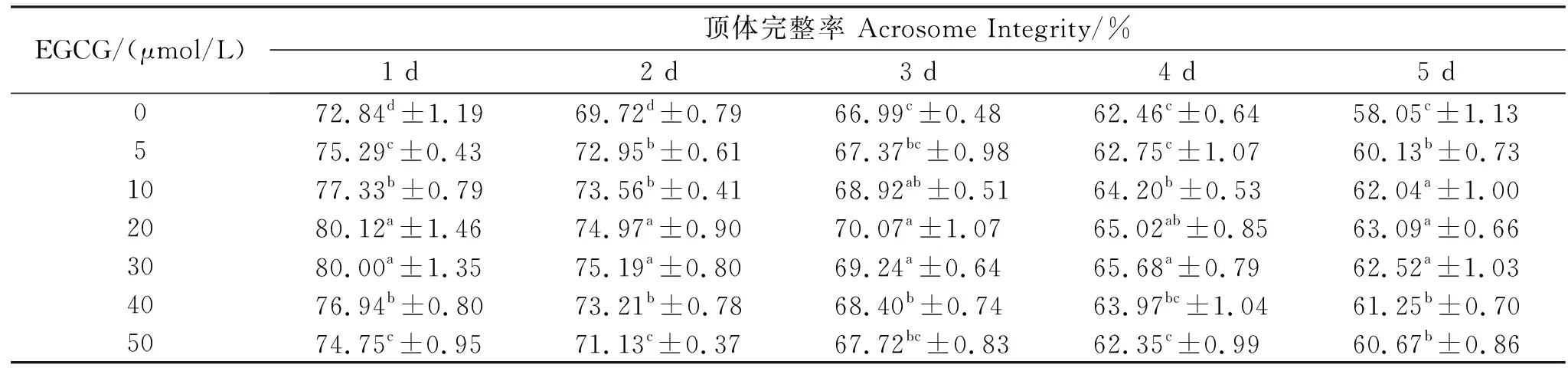
表3 猪精液常温保存添加EGCG后的精子顶体完整率Table 3 The acrosome integrity of boar sperm after adding EGCG in normal temperature
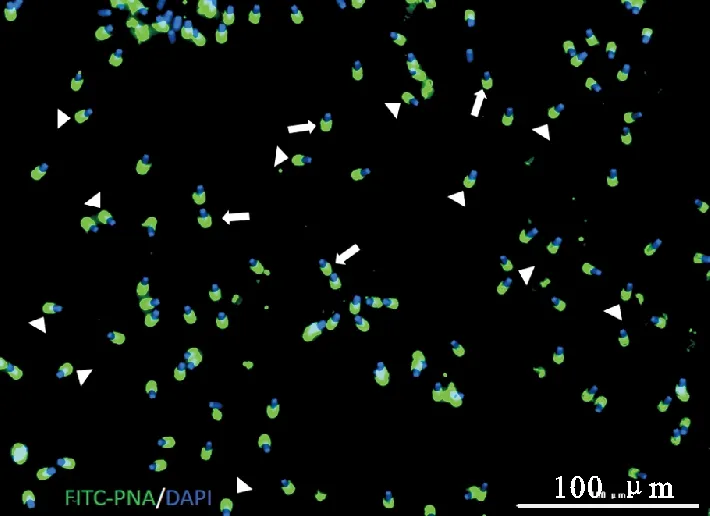
图2 猪精子顶体完整性检测猪精子细胞核经DAPI染色呈蓝色荧光,猪精子顶体经FITC-PNA染色呈绿色荧光,箭头标记代表顶体破损的精子,三角标记代表顶体完整的精子。Scale bars=100 μmFig. 2 Detection of boar sperm acrosome integritySperm nucleus is stained by DAPI (blue). Sperm acrosome is stained by FITC-PNA (green). Arrow represents damaged acrosome sperm. Triangle represents intact acrosome sperm.Scale bars=100 μm
2.4 EGCG对常温保存猪精液中CAT活性的影响
猪精液CAT活性检测结果见图3。由图3可以看出,稀释液中添加不同浓度EGCG保存的第1、3、5天对CAT活性影响趋势基本相同,所有添加EGCG的处理组CAT活性均高于对照组,其中20 μmol/L EGCG组CAT活性最强,并显著高于其他组(<0.05);稀释液中添加10、30 μmol/L处理组CAT活性仅次于20 μmol/L处理组,并显著高于其他组(<0.05)。5 μmol/L EGCG组CAT活性显著高于对照组(<0.05),但显著低于10、40 μmol/L组(<0.05)。另外,稀释液中添加EGCG的第1天猪精液中CAT活性显著高于第3和第5天(<0.05),且第3与第5天精液中CAT活性无显著差异(>0.05)。
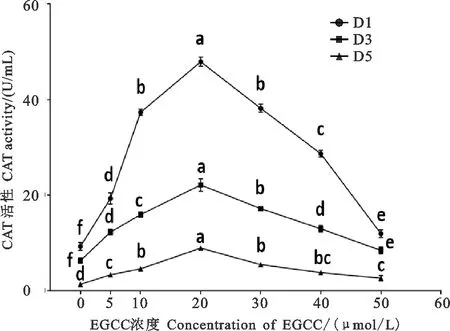
图3 不同浓度EGCG对常温保存猪精液中CAT活性的影响同一天数据间标不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)。图5同Fig. 3 Effects of different concentrations of EGCG on CAT activities in boar semen at room temperature The data with different lowercase letters for the same day demonstrate significant difference (P<0.05), while the same lowercase letters indicate insignificant difference(P>0.05). The same for fig. 5
2.5 EGCG对常温保存猪精液中ROS水平的影响
猪精液常温保存第3天ROS水平见图4。由图4可知,稀释液中添加20 μmol/L EGCG保存3 d后,精液中ROS显著低于其他组(<0.05);5、10、30、40 μmol/L的EGCG处理后均使精液中ROS水平降低,且与对照组相比差异显著(<0.05)。另外,在稀释液中添加5、10、20 μmol/L EGCG时ROS水平逐渐降低,但在添加30、40、50μmol/L EGCG后ROS水平呈现上升趋势,且50 μmol/L处理组与对照组相比无显著差异(>0.05)。
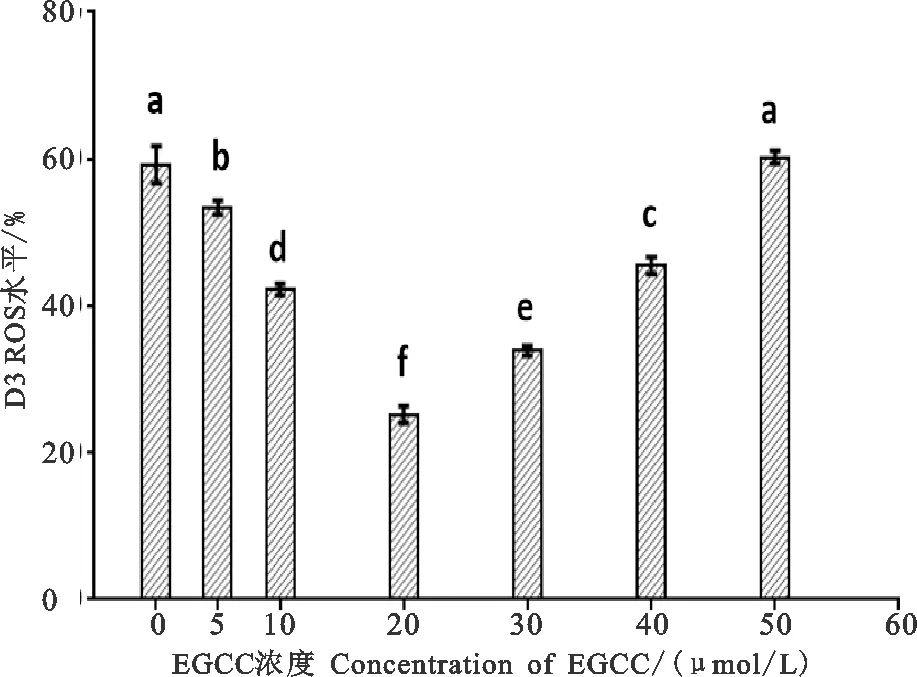
图4 不同浓度EGCG对常温保存猪精液中ROS水平的影响柱上标相同字母或无字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) Fig. 4 Effects of different concentrations of EGCG on ROS level in boar semen at room temperature The same or the absence of letters above the columns indicate insignificant difference (P>0.05), different lowercase letters indicate significant difference (P<0.05)
2.6 EGCG对猪精液常温保存SOD活性的影响
常温保存猪精液SOD活性检测结果见图5。由图5可知,稀释液中添加不同浓度EGCG保存的第1、3和5天对SOD活性的影响趋势基本相同,所有添加EGCG的处理组其SOD活性均高于对照组。其中20 μmol/L EGCG组SOD活性最强,且显著高于其他组(<0.05); 30 μmol/L处理组SOD活性仅次于20 μmol/L组,并显著高于其他组(<0.05)。另外,10、40 μmol/L EGCG处理组SOD活性显著高于对照组(<0.05),5、50 μmol/L EGCG处理组也显著高于对照组(<0.05),但显著低于10和40 μmol/L组(<0.05)。稀释液中添加EGCG常温保存第1天猪精液中SOD活性显著高于第3天和第5天(<0.05),但第3天与第5天之间精液中SOD活性无显著差异(>0.05)。
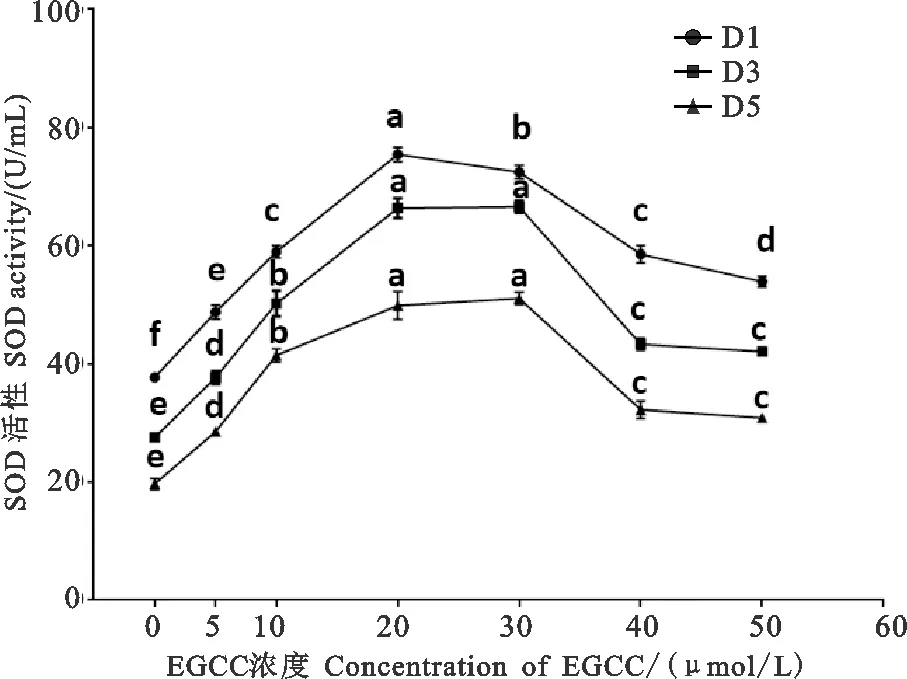
图5 猪精液常温保存稀释液中添加EGCG后猪精液SOD活性Fig. 5 SOD activities of boar semen after adding EGCG to the storage diluent of boar
3 讨 论
在本试验中,添加EGCG可以提高常温保存猪精液的精子活力、顶体完整率和质膜完整率,且添加20 μmol/L EGCG对精液保存效果最好,这与Plaza的研究结果一致。Plaza报道,在公马精液常温保存稀释液中加入20 μmol/L EGCG保存5 d后的精子活率为65.20%、精子质膜完整率为59.88%、顶体完整率为60.30%,显著高于对照组与其他处理组;Vallorani等研究发现,猪精液稀释液中添加40 μmol/L EGCG在15 ℃孵育24 h后精子活率达到74.30%,质膜及顶体完整率分别达到93.60%和95.80%;张文宇研究指出,将120 μmol/L羟基酪醇加入猪精液稀释液中有利于精液的常温保存,常温保存第5天时精子活率为50.00%,质膜和顶体完整率分别达到50.00%以上和75.00%以上。EGCG与羟基酪醇均是天然的多酚类化合物,对于生物膜的机械性能及生物活性具有保护作用,当EGCG在生物膜中释放时稳定了生物膜中氢键的交联作用,从而保护了精子质膜和顶体的完整性,提高了精子活率。另外,Kaedei等研究发现,猪冷冻精液稀释液中添加50 μmol/L EGCG冷冻-解冻后精子活率为50.36%。这可能是由于稀释液中EGCG的添加改善了细胞膜的流动性,能够抵御细胞膜的脂质过氧化,保护蛋白质硫醇基,从而在冷冻过程中保护精子。
本研究结果表明,稀释液中添加20 μmol/L EGCG可以有效提高精子的抗氧化能力,常温保存5 d后的精子活率、质膜完整率和顶体完整率分别达到78.36%、74.17%和63.09%。Tian等研究表明,在猪精液稀释液中添加30 μmol/L的丹参素可以有效提高精子保存效果,常温保存5 d后精子活率为72.21%、质膜完整率和顶体完整率分别达到60.00%和62.00%以上。本试验结果优于Tian等的试验结果,这可能是因为EGCG作为一种天然抗氧化剂,在精液保存时能够更好地清除超氧化物阴离子,同时维持细胞表面双分子层的稳定性,从而降低了精子保存所遭受的氧化损伤,提高精子质膜的完整性,进而改善并提高了精液品质。
另外,本试验发现,随着稀释液中EGCG添加量的增加精液品质反而下降,40 μmol/L和50 μmol/L EGCG组精子活率、质膜完整率和顶体完整率明显低于20 μmol/L和30μmol/L EGCG组,表明高浓度EGCG并不能对精子起到理想的保护效果,这与De Amicis等研究结果相似,其在人精液中加入20 μmol/L的EGCG 37 ℃孵育30 min精子活率达到85%以上,而60 μmol/L EGCG时精子活率不足60%。原因可能是稀释液中较高浓度的EGCG影响了精子所处稀释液中微环境的渗透压,不仅降低了Bcl2、Akt和Src等调控蛋白的活性,而且调控细胞代谢的蛋白磷酸化也受到影响,破坏了精子膜结构的稳定性,从而导致精子活率降低。关于EGCG在细胞水平和分子水平保护精子的具体机理有待进一步深入研究。
在精液的常温保存过程中,因精子代谢累积产生的过量ROS会对精子造成氧化损伤,而猪精子中大量的不饱和脂肪酸导致精子对ROS十分敏感,致使精子的质膜和顶体更易被ROS所破坏,导致精子活率降低,因而研究人员通过在稀释液中添加抗氧化剂来维持精液保存过程中精子的正常功能。裴玲等证实了没食子酸(GA)转移电子的能力,确定了没食子酸可以清除自由基,具有较强的抗氧化能力;赵琦将GA作为外源性抗氧化物加入猪精液常温保存稀释液中,发现添加后抗氧化指标均显著提高,ROS显著减少,精液保存质量有所改善。本试验中选用的EGCG 是没食子儿茶酚与没食子酸形成的酯,该物质表现出良好的抗氧化性,进而保护精子降低氧化损伤,提高精液品质。
本研究中发现,稀释液中添加20 μmol/L的EGCG能够显著提高CAT和SOD的活性。在精液常温保存中,CAT与SOD是清除自由基的重要抗氧化酶,二者对于细胞的氧化损伤有明显的逆转效果。Lin等发现EGCG可以阻止细胞内过量ROS的产生,保护线粒体免受损伤,这与本研究结果相似。本研究结果表明,向稀释液中添加EGCG可以降低猪精液保存过程中的ROS含量,抵抗外界环境对精子造成的氧化应激,从而有效防止或者降低氧化应激对精液品质造成的不良影响。
4 结 论
在猪精液常温保存稀释液中添加EGCG可以有效提高保存效果,稀释液中添加20 μmol/L EGCG时效果最好,常温保存第5天时精子活率可达78.36%,质膜完整率和顶体完整率分别达到74.17%和63.09%。
