把握变化 突破金属与硝酸反应的计算
2022-02-25张新中
张新中
(江苏省邗江中学 225009)
金属与硝酸的计算是高考的一个重要考点,也是学生学习的一个难点,其中铜、铁与硝酸的计算更是变化多端.
题目将13.44 g铜粉投入过量浓硝酸中,充分反应后产生气体的体积(标准状况)为( ).
A.3.136 L B.4.704 L C.5.376 L D.9.408 L
分析Cu与过量浓硝酸反应的化学方程式为:

则n(NO2)=2n(Cu)=2×0.21 mol=0.42 mol
故V(NO2)=0.42 mol×22.4 L·mol-1
=9.408 L
答案为D.
点评浓硝酸与金属反应时,硝酸被还原为NO2.
变式1 将13.44 g铜粉投入过量稀硝酸中,充分反应后产生气体的体积(标准状况)为( ).
A.3.136 L B.4.704 L C.5.376 L D.9.408 L
分析Cu与过量稀硝酸反应的化学方程式为:

3Cu(NO3)2+2NO↑+4H2O
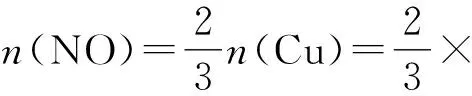
故V(NO)=0.14 mol×22.4 L·mol-1=3.136 L
答案为A.
点评稀硝酸与金属反应时,硝酸被还原为NO.
变式2 将13.44 g铜粉投入一定量的浓硝酸中反应,当铜粉完全作用时收集到气体4.480 L(标准状况),则所消耗硝酸的物质的量为( ).
A.0.42 mol B.0.56 mol
C.0.62 mol D.0.84 mol


Cu与浓硝酸反应:

Cu(NO3)2+2NO2↑+2H2O
由化学方程式可知,0.21 mol Cu完全反应理论上应生成0.42 mol NO2,但实际上只生成0.20 mol,说明还有NO生成.
解法一根据化学方程式进行计算.设Cu与浓硝酸、稀硝酸反应的物质的量分别为x、y,则

1 4 2
x4x2x

3 8 2

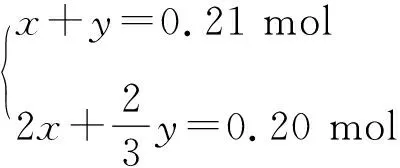
解得:x=0.045 mol,y=0.165 mol
故消耗硝酸的物质的量为:
=0.62 mol
解法二根据氮原子守恒计算.硝酸反应后,氮元素在Cu(NO3)2和NO2、NO气体中,故消耗HNO3的物质的量等于这几种物质中氮原子的物质的量之和,则
n(HNO3)耗=2n[Cu(NO3)2]+n(NO2)+n(NO)
=2n(Cu)+n(气)=2×0.21 mol+0.20 mol
=0.62 mol
答案为C.

变式3 将13.44 g铜粉投入一定量的浓HNO3中,当铜粉完全作用时收集到气体4.480 L(标准状况),将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( ).
A.5.040 L B.3.360 L C.2.352 L D.1.120 L
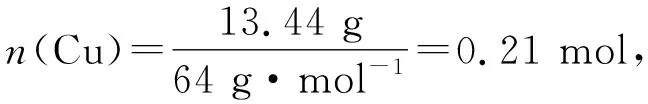
V(O2)=0.105 mol×22.4 L·mol-1=2.352 L
答案为C.
点评硝酸与金属的反应属于氧化还原反应,氮原子得到的电子数等于金属原子失去的电子数,而NO2和NO与O2一起通入水中又生成硝酸,故金属原子失去的电子数也等于O2得到的电子数.
变式4 将13.44 g铜粉投入100 mL 1 mol·L-1硫酸和2 mol·L-1硝酸的混合溶液中,充分反应后最多可收集到标准状况下的气体的体积为( ).
A.2.240 L B.3.136 L
C.4.704 L D.9.408 L
分析混合溶液中
n(H2SO4)=1 mol·L-1×0.1 L=0.1 mol
n(HNO3)=2 mol·L-1×0.1 L=0.2 mol
所以n(H+)=0.1 mol×2+0.2 mol=0.4 mol

3 2 8
0.21 mol 0.2 mol 0.4 mol
很明显,H+不足量,因此用H+的物质的量进行计算.
8H+~ 2NO↑
8 mol 2×22.4L
0.4 molV(NO)

答案为A.
点评对于金属与硫酸和硝酸的混合溶液反应,硫酸在反应中提供H+,故应采用离子方程式进行计算,首先写出离子方程式,再确定参加反应的离子哪一个不足,最后应用不足量的离子来进行计算.
变式5 将13.44 g铜粉与过量硝酸充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含有amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( ).
A.(0.21+a) mol B.(0.42+a) mol
C.(0.105+a) mol D.amol
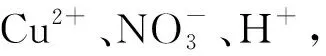
答案为B.
点评溶液呈电中性,故溶液中阴离子所带负电荷的总量等于阳离子所带正电荷的总量.
变式6 将13.44 g铁粉投入过量的稀硝酸中,充分反应后产生气体的体积(标准状况)为( ).
A.3.136 L B.4.704 L
C.5.376 L D.9.408 L
分析Fe与过量稀硝酸反应的化学方程式为:

则n(NO)=n(Fe)=0.24 mol
故V(NO)=0.24 mol×22.4 L·mol-1=5.376 L
答案为C.
点评铁与硝酸反应时,硝酸过量生成Fe3+,硝酸不足生成Fe2+,两者都完全反应还可能生成Fe2+和Fe3+的混合物.
变式7 将13.44 g铜、铁的混合物投入一定量的稀硝酸中充分反应,金属全部溶解,产生的气体通入水中,再通入标准状况下2.464 L O2,气体全部被水吸收,则混合物中铜的物质的量为( ).
A.0.070 mol B.0.080 mol
C.0.140 mol D.0.196 mol
分析铜、铁的混合物溶于稀硝酸中,Fe先与硝酸反应生成Fe3+,然后Cu再与硝酸反应生成Cu2+,若硝酸过量,则反应停止;若硝酸不足,则Cu与Fe3+反应生成Fe2+和Cu2+,故反应后的溶液中可能有Fe2+、Fe3+.
设Cu、Fe的物质的量分别为x、y,则有:
64 g·mol-1·x+56 g·mol-1·y=13.44 g
混合物与硝酸反应生成的气体通入水中,再通入O2,全部被水吸收,则气体全部转化为硝酸,从整个过程来看,氮元素的化合价没有变化,故混合物失去的电子转移到O2中.
第一种情况:若Fe只转化为Fe3+,则根据电子得失守恒可得:
解得:x=0.196 mol,y=0.016 mol
第二种情况:若Fe只转化为Fe2+,则根据电子得失守恒可得:
解得:x=0.140 mol,y=0.080 mol
第三种情况:若Fe转化为Fe2+、Fe3+,则可知混合物中铜的物质的量应在0.140 mol和0.196 mol之间.
答案为C、D.
点评对于混合物的计算,可以列方程组进行求解.若有多种情况,则应分别进行讨论.