血清25-羟维生素D水平与慢性HBV感染的相关性研究
2022-02-25李波朱庆峰耿若琳左维泽
李波 朱庆峰 耿若琳 左维泽
25-羟维生素D3[25-hydroxyvitamin D3,25(OH)D3]与脂肪性肝炎、自身免疫性肝炎、病毒性肝炎(乙肝、丙肝)等肝病存在一定的相关性[1~4],并与相关疾病导致的肝纤维化、肝硬化、肝癌及不良临床结局相关[1]。乙型肝炎病毒(Hepatitis B virus,HBV)感染是世界性公共卫生问题,全球目前约有2.57 亿慢性乙型肝炎感染者,其中非洲地区和西太平洋地区占68%[5]。全世界每年约有88.7 万人死于HBV 感染相关的肝衰竭、肝硬化和原发性肝癌[6]。根据2014年我国CDC 对1~29 岁人群乙型肝炎血清流行病学调查结果估计,目前我国乙肝表面抗原(HBsAg)阳性率为5%~6%,慢性HBV 感染者约7 000 万例,虽然较前降低,但仍属于中高流行地区[7]。但维生素D与HBV 感染不同阶段的相关性还需进一步研究。HBV 感染的机制至今尚未完全阐明,其中免疫应答在HBV 感染过程中起重要作用[8]。本研究通过检测慢性 HBV 感染患者血清25(OH)D3 水平,探讨其与肝脏功能、纤维化程度、不同疾病阶段的相关性,为慢性HBV 感染患者的疾病严重程度的评估提供新思路。
1 材料与方法
1.1 一般资料为降低自然环境因素(纬度、季节、日照时间)、遗传因素(种族、肤色)、社会因素(饮食、生活习惯)的干扰,本研究纳入2020年12月~2021年3月于石河子大学医学院第一附属医院就诊的石河子地区(北纬44.26 度,东经86.09 度)汉族慢性HBV感染者,合计纳入292 例,其中无症状HBV 携带者81 例,慢性乙型肝炎患者125 例,乙肝肝硬化代偿期患者57 例,乙肝肝硬化失代偿期患者29 例,其中男175 例,女117 例,年龄24~80 岁,中位年龄50 岁,作为观察组;并选择同期于我院体检的健康体检者按照年龄、性别进行1∶1 配对,作为对照组。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准纳入标准:观察组研究对象诊断参考2019年版慢性乙型肝炎防治指南[2]。排除标准:①临床资料不完整者;②合并其他嗜肝病毒感染所致的肝脏疾病者;③合并酒精性肝炎、自身免疫性肝炎、药物性肝炎、代谢性肝病、肝细胞癌等肝脏疾病者;④伴有严重心、脑、肺、肾等疾病或严重糖尿病者;⑤入院前补钙或维生素D 者;⑥恶性肿瘤及血液病者;⑦合并结缔组织疾病或免疫系统功能障碍者;⑧伴代谢性疾病者,如甲状旁腺功能亢进症、甲状旁腺功能减退症。本研究得到医院伦理委员会批准,参加者均知情同意。
1.3 检测方法采集晨起空腹肘静脉血,由医院检验科专职技师完善血清25(OH)D3、肝功能、甲乙丙肝、HBsAg 定量、HBV DNA 等指标检测,血清25(OH)D3检测使用罗氏COBAS800 型电化学免疫分析仪及配套试剂,检测范围为7.50~175nmol/L;肝功能检测使用美国贝克库曼尔特AU5800 生化分析仪及配套试剂,丙氨酸转移酶(ALT)、门冬氨酸转移酶(AST)的正常值上限为40U/L,总胆红素(TBIL)的正常值上限为17.1μmol/L,甲乙丙肝检测使用苏州新波检测试剂盒,HBsAg 定量使用罗氏试剂(检测范围为0~52 000IU/mL)、HBV DNA 检测使用湖南圣湘HBV 定量检测试剂盒(检测下限为100copies/ml),由影像科完成腹部彩超或肝脏CT 或肝脏MRI 等相关检查,具体工作由专职检验技师、影像诊断医师完成。对肝硬化患者进行 Child-Pugh 评分并分级,计算肝脏纤维化Fib-4 评分、ARPI 指数、S 指数等。将血清25(OH)D3 水平分为四级:≥75nmol/L为正常、50~75nmol/L 为不足、25~50nmol/L 为缺乏、≤25nmol/L 为严重缺乏[9,10]。
1.4 统计学方法采用SPSS 26.0 软件进行统计学处理,符合正态分布的计量资料以均数±标准差(±s)表示;组间两两比较采用两独立样本t检验,非正态分布计量资料采用中位数(P25,P75)表示,组间比较采用秩和检验(Z 检验);多组间比较采用方差分析;计数资料以率表示,组间比较采用χ2检验;采用Pearson 进行相关性分析,P<0.05 认为差异具有统计学意义。
2 结果
2.1 慢性HBV 感染患者与健康体检者相关指标比较
病例组ALT、AST、TBIL、凝血酶原时间(PT)高于对照组,差异有统计学意义(P<0.05);白细胞计数(WBC)、血小板计数(PLT)、血红蛋白(Hb)、白蛋白(ALB)、前白蛋白(PA)、碱性磷酸酶(ALP)、谷氨酸转肽酶(GGT)、凝血酶原活动度(PTA)、25(OH)D3 低于对照组,差异有统计学意义(P<0.05)。见表1。
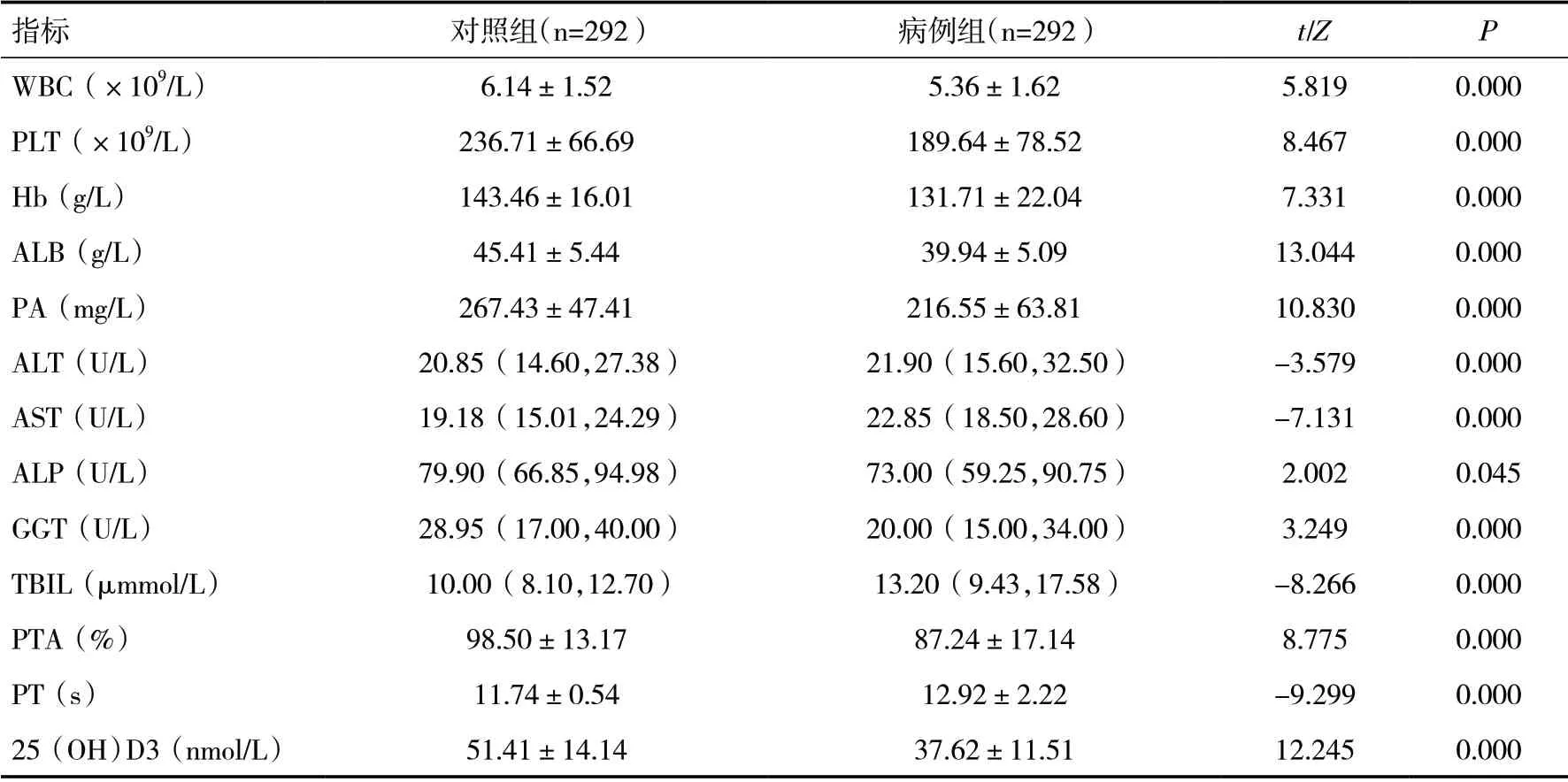
表1 两组相关指标比较
2.2 不同疾病阶段患者的血清25(OH)D3 水平比较对照组中血清25(OH)D3 缺乏者占55.82%(163/292),病例组中缺乏者占87.67%(256/292)。无症状HBV 携带组血清25(OH)D3 水平(38.85±12.08)nmol/L低于对照组(51.41±14.14)nmol/L,P<0.05);乙肝肝硬化组(31.83±10.02)nmol/L 低于无症状HBV 携带组(38.85±12.08)nmol/L 和慢性乙型肝炎组(40.81±10.66)nmol/L,差异有统计学意义(P<0.05)。在乙肝肝硬化组中,肝硬化失代偿期组25(OH)D3 水平(26.44±11.23)nmol/L 低于肝硬化代偿期组(34.57±8.15)nmol/L,差异有统计学意义(P<0.05)。无症状HBV 携带组低于慢性乙型肝炎组,但两组差异无统计学意义(P>0.05)。
2.3 血清25(OH)D3 水平与血清学、病毒学指标、纤维化指标相关性分析血清25(OH)D3 水平与ALB、PA、PTA、PLT、WBC、Lym 均呈正相关(P<0.05),与PT、INR、Fib-4、S 指数均呈负相关(P<0.05)。血清25(OH)D3 水平与HBV DNA 水平、HBsAg 定量、APRI 无相关性(P>0.05)。见表2。
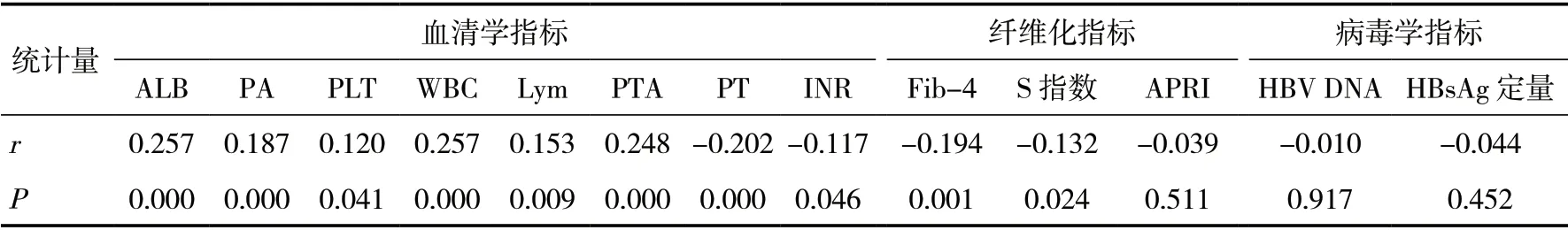
表2 血清25(OH)D3 水平与血清学、病毒学纤维化指标相关性分析
2.4 血清25(OH)D3 水平与Child-Pugh 评分的相关性乙肝肝硬化患者血清25(OH)D3 水平与Child-Pugh 评分呈负相关(r=-0.394,P<0.05)。见图1。在乙肝肝硬化Child-Pugh A 级患者中血清25(OH)D3 严重缺乏者占12.73%(7/55),Child-Pugh B 级患者中血清25(OH)D3 严重缺乏者占31.58%(6/19),Child-Pugh C 级患者中血清25(OH)D3 严重缺乏者占58.33%(7/12)。
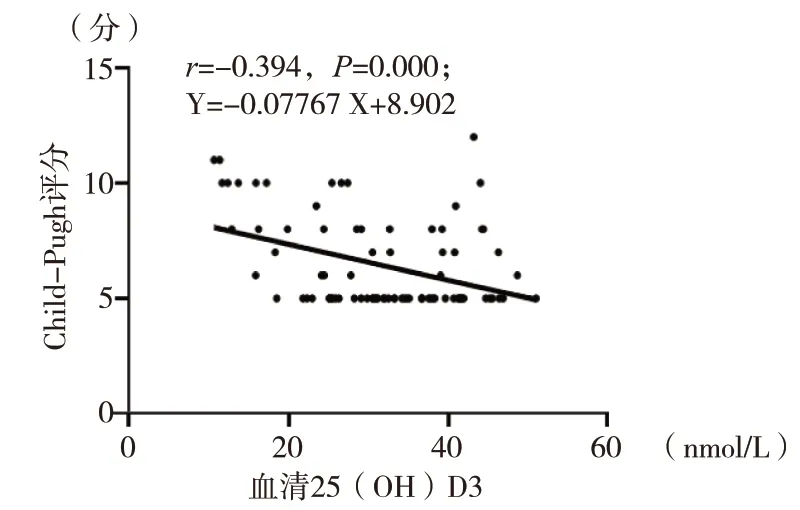
图1 血清25(OH)D3 水平与Child-Pugh 评分的相关性
3 讨论
近年,随着抗病毒药物的使用以及乙肝疫苗的普及,人群HBsAg 流行率明显降低,但因我国人口基数大,目前仍有约7 000 万慢性HBV 感染患者。慢性HBV 感染易从慢性乙型肝炎发展到乙型肝炎肝硬化,甚至乙型肝炎相关原发性肝癌(HBVPLC)。HBV-PLC 是我国常见的恶性肿瘤之一,2020年我国新发原发性肝癌410 038 例(占全球45.3%)、病死391 152 例(占全球47.1%),其预后差,复发率及病死率高[11]。因此监测慢性HBV 感染患者的疾病进展,成为此类人群预防肝癌发生的关键。
慢性HBV 感染的发病机制尚未完全明确,目前认为病毒引起的免疫应答是导致肝细胞损伤及炎症坏死的主要机制;持续或反复出现炎症坏死是慢性HBV 感染导致肝硬化、乙型肝炎相关原发性肝癌的重要因素[2]。维生素D 不仅具有维持体内钙和磷平衡的作用,还参与细胞的增殖、分化及凋亡,具有免疫调节、抗炎、抗氧化、抗肿瘤等多种生物学功能[12]。本研究主要分析了慢性HBV 感染患者不同疾病阶段血清25(OH)D3 水平与肝脏功能、肝纤维化程度及病毒学指标的相关性。结果表明,维生素D 缺乏在慢性HBV 感染患者中普遍存在,特别是在肝硬化失代偿期患者中更为显著,血清25(OH)D3 水平与慢性HBV 患者肝脏损害程度呈负相关。本研究发现病例组患者25(OH)D3 缺乏者占87.67%,血清25(OH)D3 水平与ALB、PA、PLT、WBC、Lym、PTA 呈正相关(P<0.05)。与Ko 等[3]研究结果类似,其纳入的60 例肝病患者中,发现有88.3%的患者存在25(OH)D3 缺乏,可能是因为维生素D3 对处于免疫耐受期的慢性乙型肝炎患者有免疫调节和炎症调节作用;在HBeAg 阴性的免疫耐受期患者中,维生素D3 水平与淋巴细胞亚群CD8、CD19 水平相关,可通过淋巴细胞亚群CD8、CD19和白细胞调节免疫功能,CD19 再通过调节B 细胞受体信号影响B 淋巴细胞的活化和分化,从而影响慢性HBV 感染的治疗效果。一项动物实验发现[13],维生素D3 联合干扰素治疗小鼠乙肝与单用干扰素治疗相比,CD4+细胞百分率和CD4+/CD8+明显升高,CD8+细胞百分率下降,脾淋巴细胞增殖率较高,对乙肝小鼠疗效较好,可能是维生素D3 提高了小鼠的免疫水平。天然维生素D 无生物活性,需要通过肝脏代谢后才能成为具有生物活性的维生素D。肝脏是25(OH)D3 的主要合成器官,维生素D 可能与慢性HBV 感染患者的免疫功能相关。在慢性HBV 感染患者中,肝脏功能减退导致活性维生素D生成减少,引起免疫水平降低,导致肝功能受损,可能使活性维生素D 的合成进一步减少,进而加重病情。Jamil 等[14]发现,维生素D 缺乏与终末期肝病评分模型、肝硬化Child-Pugh 分级显著相关,其认为对于晚期肝硬化患者(Child-Pugh B 级和C 级)应定期监测血清维生素D 水平,必要时可予以补充维生素D 及其相关类似物,以改善肝硬化患者的总体健康状况。Child-Pugh 评分是临床上用以评估肝脏储备功能的标准之一,ALB、PA 是反映肝脏合成功能的临床指标。本研究发现,血清25(OH)D3水平与Child-Pugh 评分呈负相关,与ALB、PA 呈正相关,提示血清25(OH)D3 水平与肝脏的功能相关,血清25(OH)D3 水平越低,提示肝脏功能越差。
Reiter 等[5]通过动物及细胞试验发现维生素D及其类似物在体外和体内均具有抗纤维化作用。Zhu 等[15]发现维生素D 缺乏可以通过增加Fas 和FasL,降低Bcl2 和Bclx,从而引发肝实质细胞凋亡,并激活肝星状细胞(Hepatic stellate cell,HSC)诱导肝纤维化。维生素D 可通过抑制肝星状细胞活化及TGF-β/Smad 信号通路,负调控组氨酸富集钙蛋白(Histidine enriched calcium protein,HRC),延缓肝纤维化[16]。血清25(OH)D3 水平与肝纤维化相关,其水平降低可加快肝纤维化进展。本研究发现血清25(OH)D3 水平与肝纤维化指数Fib-4、S 指数呈负相关,与ARPI 无明显相关性,考虑可能与使用降酶药物有关,且是基于评估慢性HCV 感染者相关肝纤维化程度的指标,用于评估HBV 相关肝纤维化程度的准确性较低有关[17]。本研究通过检测慢性HBV 感染患者血清25(OH)D3 水平,发现随着疾病严重程度的增加,血清25(OH)D3 水平逐渐降低。其中慢性HBV 感染患者各组血清25(OH)D3 水平均低于对照组,乙肝肝硬化患者血清25(OH)D3 水平低于无症状HBV 携带组和慢性乙型肝炎组,且肝硬化失代偿期组低于代偿期组,提示其可能与疾病进展相关。无症状HBV 携带组低于慢性乙型肝炎组,但两组之间差异无统计学意义,血清25(OH)D3 水平与乙肝病毒学相关指标(HBV DNA 水平、HBsAg 定量)均无相关性,与既往Yu 等[18]报道一致,但与Ko 等[3]报道不一致。因此,血清25(OH)D3 水平与慢性HBV 感染患者病毒学指标的相关性还需更详细和更大规模的研究来验证。
综上,慢性HBV 感染患者血清25(OH)D3 水平与肝脏功能、纤维化程度、不同疾病阶段有一定的相关性;慢性HBV 感染患者血清25(OH)D3 缺乏广泛存在,在肝硬化失代偿期患者中尤为显著;HBV感染患者肝脏损害越重,血清25(OH)D3 水平越低。建议临床应密切监测慢性HBV 感染患者的血清25(OH)D3 水平。
