新型磷酸二酯酶4抑制剂ZL-n-91对骨肉瘤U2OS细胞增殖的抑制作用
2022-02-24许丽君王学鹏林伟杰梁龙铭赫玉杰赵正刚李芳红周素瑾赵子建
许丽君,王学鹏,林伟杰,梁龙铭,赫玉杰,赵正刚,李芳红,周素瑾,赵子建
(广东工业大学生物医药学院,广东 广州 510006)
骨肉瘤(osteosarcoma,OS)是儿童和青少年最常见的原发性恶性骨肿瘤,目前转移性骨肉瘤患者5年生存率仅为20%[1-2]。骨肉瘤的治疗模式是术前新辅助化疗+手术切除+术后辅助化疗,化疗药物包括顺铂、阿霉素、甲氨蝶呤、异环磷酰胺等,但这些化疗药物副作用明显,且易产生耐药性。因此,开发新的药物治疗骨肉瘤迫在眉睫。
磷酸二酯酶4(phosphodiesterase 4,PDE4)能够特异性水解环磷酸腺苷(cyclic adenosine monophosphate,cAMP)[3]。研究发现骨肉瘤细胞MG-63含有较高的PDE4活性[4],并且用PDE4抑制剂咯利普兰处理可导致骨肉瘤细胞Saos-2内cAMP积累[5]。全基因组关联研究(Genome-Wide Association Studies,GWAS)研究提示cAMP水平降低与骨肉瘤的发生发展密切相关[6]。因此,PDE4有可能成为治疗骨肉瘤的一个潜在靶点。多年来的研究证实PDE4抑制剂具有很好的抗肿瘤作用[7],但其剂量依赖性的胃肠道不良反应如恶心、呕吐等严重阻碍了此类药物的开发应用,这也成为当前开发新型PDE4抑制剂的难点。ZL-n-91,又称罗氟普兰,作为一种新型的高选择性PDE4抑制剂,其抑制PDE4D4和PDE4D5的IC50分别是11.8 nmol·L-1和19.2 nmol·L-1,相对于其他PDE家族有至少5 000倍的选择性,并且通过比格犬灌胃给药的方式验证了ZL-n-91相对于咯利普兰具有极低甚至可能不具有致呕吐的潜能[8],因此,ZL-n-91可能成为具有临床应用价值的新一代PDE4抑制剂。本课题前期研究发现,ZL-n-91能够抑制前列腺癌细胞PC-3的增殖[9],但ZL-n-91对于骨肉瘤的疗效尚鲜见报道。本研究旨在研究ZL-n-91对骨肉瘤细胞增殖、凋亡及细胞周期的影响,以期为骨肉瘤的靶向治疗找到新的突破口。
1 材料与方法
1.1 材料
1.1.1细胞株 人骨肉瘤细胞系U2OS,购自中国科学院典型培养物保藏委员会细胞库。
1.1.2药物与试剂 ZL-n-91由药明康德公司合成,以无水乙醇(EtOH)溶解至相应浓度;胰蛋白酶和胎牛血清(FBS)购自美国Gibco公司;McCOY′s 5A培养基购自美国Sigma公司;CCK-8试剂盒(Cell Counting Kit-8,批号:G909FA003)购自上海生工生物工程公司;碘化丙啶(PI,批号:90395858)和PE Annexin V/7AAD试剂盒(批号:9074586)购自美国BD Bioscience公司。BCA蛋白定量试剂盒、ECL发光液购自Thermo Fisher公司;Bcl-2抗体购自英国Abcam公司;CDK2、CDK4、CyclinD1、CyclinE1抗体购自美国CST公司,β-actin、GADPH购自美国Sigma公司;辣根过氧化物酶标记山羊抗兔IgG、HPR标记的山羊抗兔二抗购自上海碧云天生物公司。
1.2 仪器AC2-4S1型二级生物安全柜(ESCO,新加坡);CLM-170B-8-NF型二氧化碳培养箱(ESCO,新加坡);TDZ5-WS型多管架自动平衡离心机(上海卢湘仪离心机仪器有限公司);流式细胞仪(DXP AthenaTM,美国);ChemiDoc+XRS化学发光凝胶成像系统(Bio-Rad,美国);Leica倒置显微镜(Leic,德国);CMAXPLUS+酶标仪(美国)。
1.3 方法
1.3.1细胞培养 人骨肉瘤细胞系U2OS细胞采用含10%胎牛血清的McCOY′s 5A培养基,均置于37 ℃、5% CO2细胞培养箱中常规培养,每隔2~3 d传代1次。所有实验均采用处于对数生长期的细胞进行。
1.3.2CCK8法检测细胞增殖抑制 将U2OS细胞以2×103个/孔接种于96孔板,待细胞贴壁后加入不同浓度(0、20、40、80、160、240、320、400、480 μmol·L-1)的ZL-n-91分别处理并培养48 h。每孔加入CCK-8 溶液10 μL,孵育1~2 h,酶标仪检测450 nm处的吸光度(OD)值。计算ZL-n-91在U2OS细胞中的半数抑制浓度和细胞增殖抑制率/%=(对照孔OD值-实验孔OD值)/(对照孔OD值-空白孔OD值)×100%。之后细胞设空白对照组(Control组)、溶剂对照组(EtOH组)和ZL-n-91处理组(200 μmol·L-1),每组均设3个复孔。梯度培养0、24、48、72、96 h后检测各组细胞450 nm处OD值。
1.3.3平板克隆形成实验检测U2OS细胞生长情况 取对数生长期细胞以每孔1 000个接种于6孔板中,待细胞贴壁后加入药物处理。实验共设计3组(EtOH组、50、100 μmol·L-1ZL-n-91处理组)。12 d后出现肉眼可见的细胞克隆即终止培养,以多聚甲醛溶液固定细胞,进行结晶紫染色,经PBS洗涤后,将≥50个细胞克隆团记为1个细胞克隆,观察计数各组细胞克隆形成数目,结果以细胞克隆形成数目表示。
1.3.4流式细胞术检测细胞凋亡 取对数生长期细胞以1.5×105个/孔接种于6孔板,饥饿处理24 h后加入药物处理。实验共设计4组(EtOH组,100、200、300 μmol·L-1ZL-n-91处理组)。药物处理48 h后,收集细胞,PBS洗涤2次后用0.25%胰蛋白酶消化,离心收集细胞。按照凋亡检测试剂盒说明书进行Annexin V-PE、7AAD染色,随后上机检测细胞凋亡情况。
1.3.5流式细胞术检测细胞周期 取对数生长期U2OS细胞以1.5×105个/孔接种于6孔板,饥饿处理24 h后加入药物处理。实验共设计2组(EtOH组、200 μmol·L-1ZL-n-91处理组)。药物处理48 h后,PBS洗涤2次后用0.25%胰蛋白酶消化,离心收集细胞,PBS洗涤离心后,加入1 mL 70%的预冷乙醇,置于-20 ℃固定24 h以上。按照试剂盒说明书进行PI染色,随后上机检测细胞周期分布。
1.3.6蛋白免疫印迹实验检测凋亡及周期蛋白表达 实验共设计4组(EtOH组,100、200、300 μmol·L-1ZL-n-91处理组),药物处理48 h后,胰酶消化收集细胞,RIPA裂解细胞,超声破碎后12 000 r·min-1离心20 min。取上清,采用BCA法进行测定蛋白浓度。定量后用12%SDS-PAGE凝胶对蛋白进行电泳分离,湿法转印至PVDF膜,5%牛奶封闭1 h,加入稀释后的一抗于4 ℃孵育过夜,次日TBST洗膜3次,加入辣根过氧化物酶标记的二抗(1 ∶5 000),摇床室温孵育1 h,TBST洗膜3次后ECL化学发光显色,并应用ImageJ软件分析目标蛋白和内参蛋白灰度值,相对表达量=目的蛋白灰度值/内参灰度值。

2 结果
2.1 ZL-n-91抑制U2OS细胞增殖如Fig 1所示,CCK-8结果显示ZL-n-91显著抑制U2OS细胞的增殖,且随着浓度增高,ZL-n-91抑制能力增强,其IC50为174.1 μmol·L-1(Fig 1A)。与Control组和EtOH组相比,ZL-n-91(200 μmol·L-1)处理24 h开始,细胞增殖受到明显抑制(P<0.05)(Fig 1B)。与对照组相比,ZL-n-91对U2OS细胞增殖具有明显的抑制作用,且呈现剂量和时间依赖性。
2.2 ZL-n-91对U2OS细胞克隆形成能力的影响如Fig 2所示,当不同浓度ZL-n-91分别作用于U2OS细胞后,与EtOH组相比,50、100 μmol·L-1ZL-n-91处理组的细胞克隆形成数目明显降低(P<0.01)。结果表明ZL-n-91可抑制U2OS细胞的克隆形成能力。
2.3 ZL-n-91处理后U2OS细胞周期变化如Fig 3所示,流式细胞术结果表明,与EtOH组相比,ZL-n-91(200 μmol·L-1)处理48 h后,U2OS细胞的细胞周期G2/M期比例降低(P<0.01),G0/G1期细胞比例明显升高(P<0.01)。结果表明ZL-n-91可将U2OS细胞阻滞在G0/G1期。

Fig 1 Effect of ZL-n-91 on proliferation of U2OS cells n=3)*P<0.05 vs Control,#P<0.05 vs EtOH

Fig 2 Effect of ZL-n-91 on colony formation of U2OS cells n=3)**P<0.01 vs EtOH
2.4 ZL-n-91处理后U2OS细胞凋亡变化如Fig 4所示,流式细胞术结果表明,随着ZL-n-91浓度的增加,其诱导细胞凋亡的作用呈剂量依赖性增高。其中,经300 μmol·L-1ZL-n-91处理后,细胞凋亡比例明显增加(P<0.01)。结果表明ZL-n-91可促使U2OS细胞发生凋亡。
2.5 Western blot 检测ZL-n-91对U2OS细胞周期蛋白CDK2、CDK4、CyclinD1、CyclinE1表达的影响如Fig 5所示,不同浓度的ZL-n-91处理U2OS细胞48 h后,与EtOH组相比,CDK2、CDK4、CyclinD1、CyclinE1的表达水平逐渐降低(P<0.05)。结果进一步证明ZL-n-91导致U2OS细胞阻滞在G0/G1期。
2.6 Western blot 检测ZL-n-91对U2OS细胞抗凋亡蛋白Bcl-2表达的影响如Fig 6所示,不同浓度的ZL-n-91处理U2OS细胞48 h后,与EtOH组相比,300 μmol·L-1处理可明显降低Bcl-2的蛋白表达(P<0.01)。结果进一步证明ZL-n-91可诱导U2OS细胞凋亡。
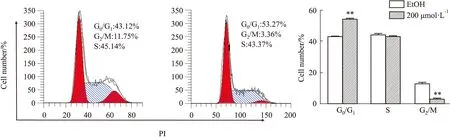
Fig 3 Effect of ZL-n-91 on cell cycle distribution of U2OS cells n=3)

Fig 4 Effect of ZL-n-91 on apoptosis of U2OS cells n=3)**P<0.01 vs EtOH
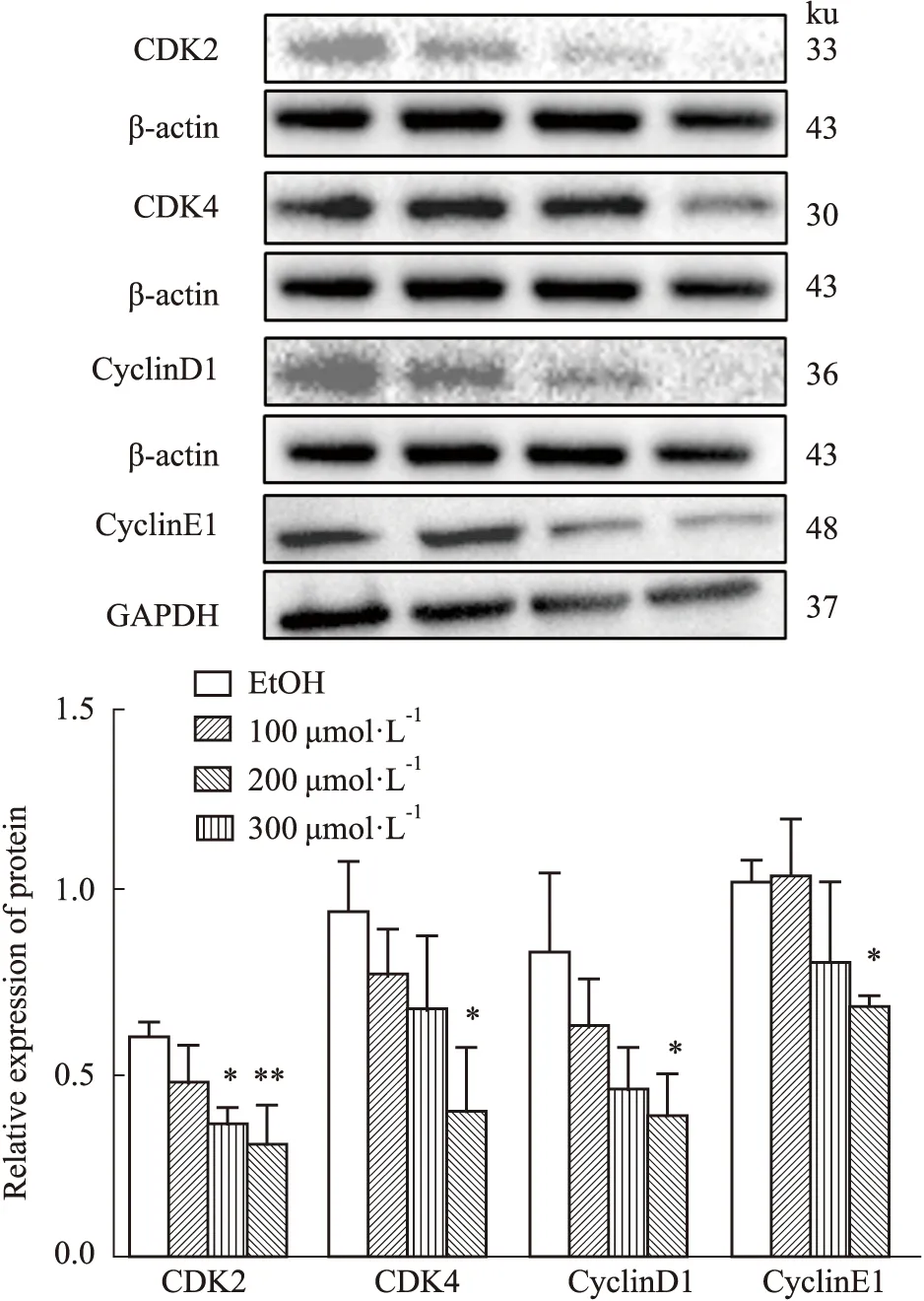
Fig 5 Effect of ZL-n-91 on expression of CDK2,CDK4,CyclinD1,CyclinE1 protein in U2OS n=3)*P<0.05 vs EtOH ,**P<0.01 vs EtOH
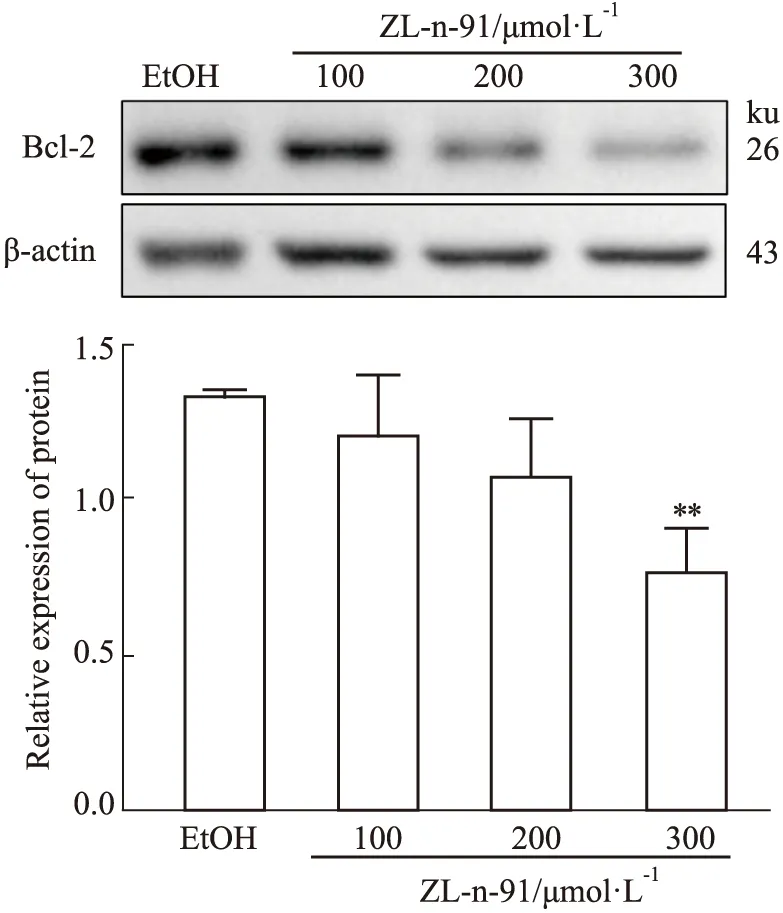
Fig 6 Effect of ZL-n-91 on expression of Bcl-2 protein in U2OS cells n=3)**P<0.01 vs EtOH
3 讨论
骨肉瘤恶性程度高,预后差,早期即能发生局部及远处转移,严重影响青少年的健康。尽管当前外科截肢手术及化疗药物不断发展,骨肉瘤患者的5年生存率得以明显提高,但高剂量的化疗药物不良反应严重[10],因此寻找新型高选择性的靶向治疗药物极为重要。本研究通过体外实验证实新型PDE4抑制剂ZL-n-91可导致骨肉瘤U2OS细胞周期阻滞并促进细胞凋亡,显著抑制细胞增殖,为临床治疗骨肉瘤提供新的思路。
ZL-n-91作为新型PDE4抑制剂,选择性高,副作用低,其在急性肺损伤[11]、帕金森疾病[12]、慢性阻塞性肺疾病[13]、前列腺癌[9]等疾病的治疗中都取得了很好的疗效。基于前期研究表明骨肉瘤细胞中高表达PDE4,提示PDE4有可能成为治疗骨肉瘤的一个潜在靶点,通过PDE4抑制剂有望治疗骨肉瘤。本研究选用新型的PDE4抑制剂ZL-n-91,观察其对骨肉瘤细胞的抑制作用。结果发现ZL-n-91可以以剂量依赖性抑制骨肉瘤细胞U2OS的增殖,显著抑制U2OS细胞的克隆形成能力。
癌症的发生发展与不受控制的细胞增殖有关,大多数化疗药物主要是通过调控肿瘤细胞的周期进程来抑制细胞的快速增殖而达到抗肿瘤的效果。本研究发现ZL-n-91可使U2OS细胞阻滞在G0/G1期,这与PDE4抑制剂罗氟司特诱导卵巢癌OVCAR3细胞和SKOV3细胞G0/G1期周期阻滞[14]的研究结果相一致。CDK2-cyclinE1和CDK4/6-cyclinD1两种细胞周期激酶复合体是启动细胞周期从G1期到S期顺利转换的关键调节因子[15]。本研究发现ZL-n-91显著下调骨肉瘤U2OS细胞中周期相关蛋白CDK2、CDK4、CyclinD1、CyclinE1的表达,表明ZL-n-91可以通过调节细胞周期相关蛋白的表达,诱导骨肉瘤U2OS细胞阻滞在G0/G1期。
细胞周期阻滞能够使细胞进行自我介导的DNA修复或者细胞凋亡[16]。本研究发现ZL-n-91显著诱导骨肉瘤U2OS细胞发生凋亡。Bcl-2是一种抗凋亡蛋白,通过控制线粒体膜通透性来调节细胞凋亡[17]。本研究观察到ZL-n-91处理后,U2OS细胞中Bcl-2的表达显著下调。因此ZL-n-91可通过下调抗凋亡蛋白Bcl-2触发线粒体途径介导的细胞凋亡。
综上所述,新型的PDE4抑制剂ZL-n-91可抑制骨肉瘤U2OS细胞的增殖,诱导细胞凋亡和细胞周期阻滞,为研发抗骨肉瘤新药提供了一定的理论基础。
