重建线粒体动态平衡对NK细胞NK2型活化影响
2022-02-24陈旭青周龙云吴继勇于希忠严芮雯严道南马华安
陈旭青,周龙云,史 军,吴继勇,于希忠,严芮雯,严道南,马华安
(1.南京中医药大学附属医院耳鼻喉科,2.南京医科大学第一附属医院康复医学中心,江苏 南京 210029;3.南京中医药大学第一临床医学院,江苏 南京 210046)
自然杀伤(natural killer,NK)细胞为机体固有免疫系统的重要组成,其于不同微环境刺激下,呈现出的分化倾向不一[1]。IL-12可诱导其分化为NK1型细胞,其以CD45RO等表型特征,分泌INF-γ等细胞因子,以协调免疫应答。NK细胞NK2型分化,则可分泌大量IL-4、IL-5等Th2型细胞因子,介导变应性炎症反应[2-3]。多项研究显示,变应性疾病状态下,NK细胞可向病变部位募集,并发生NK2主导型活化,促进局部Th2型细胞因子的表达[4-5],即NK细胞NK2型活化与变应性疾病发展密切关联。故探讨NK细胞异常活化机制,调控其功能紊乱,对变应性疾病的治疗具有重要价值。
线粒体为调控细胞各项生命活动的动力元件,其通过频繁融合、分裂动态变化维持内部功能稳态[6-7]。这一动态平衡机制涉及多种蛋白,其中Drp1为调控线粒体分裂的关键分子。细胞内Drp1过度活化,可于线粒体外膜大量募集,通过压缩外膜加速线粒体分裂,并触发活性氧(reactive oxygen species,ROS)大量内生,以此调控Ca2+稳态、吞噬、炎症反应、凋亡等细胞诸多生命活动[6]。近年研究显示,NK细胞NK2型活化伴随着线粒体动态变化的失衡,存在线粒体过度分裂现象[8],但两者内在关联尚不明确。基于此,本研究拟以线粒体分裂抑制剂Mdivi-1,探讨重建NK细胞线粒体动态平衡对NK细胞异常活化的影响,并揭示NK细胞异常活化的内在机制。
1 材料
1.1 主要仪器Herocell 180型CO2培养箱(美国Thermo公司)、ELX800型酶标仪(美国BioTek)、ChemiDoc XRS型化学发光凝胶成像仪、Accuri C6 型细胞仪(美国BD)、Lecia DMI 3000B型倒置荧光显微镜(德国Leica公司)、Lecia SP8型激光共聚焦显微镜(德国Leica公司)。
1.2 主要药品与试剂线粒体分裂抑制剂1(mitochondrial division inhibitor,Mdivi-1,M0199)购自美国Sigma-Aldrich公司,重组人胸腺基质淋巴细胞生成素(thymus stromal lymphopoietin,TSLP,300-62)购自美国PeproTech公司,α-MEM培养基(11900024)、马血清(16050122)、胎牛血清(10100147)、巯基乙醇(614272)购自美国Gibco公司,肌醇(A600536)、叶酸(A610466)、磷酸盐(phosphate buffer saline,PBS)缓冲液粉末(B040100)购自生工生物工程股份有限公司,ROS检测荧光探针-二氢乙啶(dihydroethidium,DHE)试剂盒(KGAF019)购自南京凯基生物科技发展有限公司,MitoTracker Green(40742ES50)购自上海翊圣生物科技有限公司、牛血清白蛋白(bovine serum albumin,BSA,ST025)、BCA蛋白定量试剂盒(P0012)购自上海碧云天生物技术有限公司,PVDF膜(IPVH00010)购自美国Millipore公司,IL-4(70-EK104-96)、IL-5(70-EK105-96)、IFN-γ(70-EK180-48)酶联免疫吸附测定(ELISA)试剂盒均购自杭州联科生物技术股份有限公司,MnSOD兔多克隆抗体(ab13534)、Drp1兔单克隆抗体(ab184247)、β-actin兔多克隆抗体(ab8227)均购自英国Abcam公司,p-Drp1兔多克隆抗体(3455S)购自美国CST公司,HRP标记山羊抗兔IgG(A0208)购自上海碧云天生物技术有限公司。
1.3 实验细胞人恶性非霍奇金淋巴瘤患者的自然杀伤细胞(NK-92MI,GOY-ATCC-0016)购自上海谷研实业有限公司。以含12.5%胎牛血清、12.5%马血清、0.2 mmol·L-1肌醇、0.1 mmol·L-1巯基乙醇、0.02 mmol·L-1叶酸的α-MEM培养基,于37 ℃ CO2培养箱中培养。
2 方法
2.1 实验分组NK-92MI细胞分为空白组、TSLP组、1 μmol·L-1Mdivi-1组、5 μmol·L-1Mdivi-1组、10 μmol·L-1Mdivi-1组。TLPS组细胞以20 μg·L-1TSLP刺激24 h,诱导NK细胞NK2分化。Mdivi-1组以20 μg·L-1TSLP联合相应浓度Mdivi-1孵育24 h。
2.2 上清细胞因子分析回收各组细胞上清,于500×g,4 ℃条件下离心10 min,获取上清。据ELISA试剂盒说明书,经标准样、待测样加样,震荡、洗涤,检测抗体、HRP标记的链霉亲和素、底物孵育后,以酶标仪进行双波长扫描,测定各组上清IL-4、IL-5、IFN-γ水平。
2.3 蛋白印迹分析回收细胞样本,经裂解、匀浆、静置、离心后,获取蛋白上清。BCA法测定蛋白浓度,调整终浓度,高温变性后-80 ℃冻存备用。取蛋白样品经SDS-聚丙烯酰胺凝胶电泳并转移至PVDF膜上,5% BSA的TBST室温封闭后,分别加入以1% BSA稀释的IL-4、IFN-γ、p-JAK2、JAK2、p-STAT6、STAT6、β-actin抗体,4 ℃孵育过夜。次日孵育HRP标记山羊抗兔IgG。滴加ECL曝光液,以Bio-rad化学发光检测仪显影,拍照保存。图像以ImageJ软件分析。
2.4 细胞ROS检测离心收集处理后细胞,以含25 μmol·L-1DHE的α-MEM培养基重悬,CO2培养箱中孵育1 h。离心,PBS洗涤,弃上清。500 μL PBS重悬,Accuri C6流式细胞仪检测荧光强度。
2.5 线粒体形态观察离心收集处理后细胞,以含37 ℃预热的100 nmol·L-1MitoTracker Green α-MEM培养基,于CO2培养箱中孵育30 min。离心,PBS洗涤,弃上清。α-MEM培养基重悬,接种于激光共聚焦皿,激光共聚焦显微镜下拍照。

3 结果
3.1 Mdivi-1对NK-92MI细胞上清IL-4、IL-5、IFN-γ 水平的影响NK细胞NK2型活化以表达、分泌IL-4、IL-5因子为特征,而IFN-γ则为NK细胞NK1活化标志性因子。如Fig 1所示,与对照组比较,TSLP组NK-92MI细胞上清中IL-4、IL-5水平明显升高,IFN-γ水平下调,差异具有统计学意义(P<0.05)。与TSLP组比较,5、10 μmol·L-1Mdivi-1组细胞上清IL-4、IL-5水平降低,10 μmol·L-1Mdivi-1组IFN-γ浓度则有所回升,差异具有统计学意义(P<0.05)。
3.2 Mdivi-1对NK-92MI细胞内生ROS的影响ROS为诸多变应性疾病的重要病理信号,调控着NK细胞功能状态[9-10]。如Fig 2、3所示,与对照组比较,TSLP组NK-92MI细胞ROS水平明显升高,差异具有统计学意义(P<0.05)。与TSLP组对比,5、10 μmol·L-1Mdivi-1组ROS水平降低,差异具有统计学意义(P<0.05)。
3.3 Mdivi-1对NK-92MI细胞线粒体形态的影响线粒体过度分裂可触发ROS大量生成,为变应性炎症、免疫细胞功能紊乱的重要因素[6,11]。如Fig 4所示,对照组NK-92MI细胞内线粒体主要呈长管状,散布于胞质。TSLP刺激后,NK-92MI细胞内大量圆球状线粒体生成。而Mdivi-1干预后,有效减少了TSLP刺激下球状线粒体的生成。
3.4 Mdivi-1对NK-92MI细胞Drp活化、MnSOD表达的影响Drp1为调控线粒体分裂的关键因子,线粒体功能的紊乱伴随着氧化应激防御因子MnSOD表达的下调[7,12]。如Fig 5所示,与对照组比较,TSLP组NK-92MI细胞p-Drp1水平明显上调,而MnSOD表达下降,差异具有统计学意义(P<0.05)。而Mdivi-1干预后,有效逆转了上述分子表达变化,且该效应随着药物剂量上调呈增强趋势。
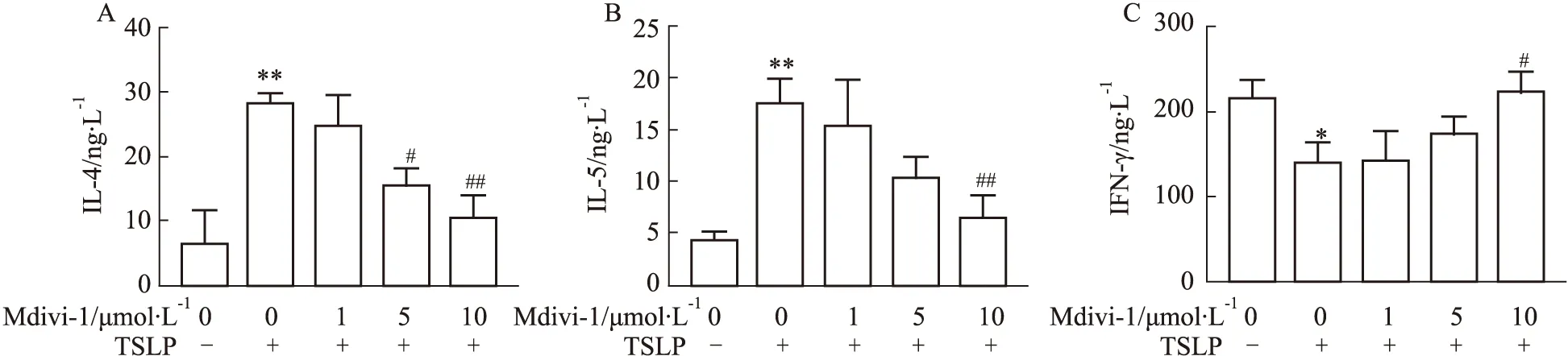
Fig 1 Levels of IL-4,IL-5 and IFN-γ in supernatant of each group n=3 )*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs TSLP group.

Fig 2 DHE staining of NK-92MI cells in each group n=3 )A:Control;B:TSLP;C:1 μmol·L-1 Mdivi-1;D:5 μmol·L-1 Mdivi-1;E:10 μmol·L-1 Mdivi-1;Scale bar=100 μm

Fig 3 Flow cytometric quantitative analysis of DHE staining of NK-92MI cells in each group n=4 )**P<0.01 vs control group;##P<0.01 vs TSLP group.

Fig 4 Mitochondrial morphology of each group by confocal fluorescence microscopy n=5 )**P<0.01 vs control group;##P<0.01 vs TSLP group.Scale bar=10 μm.

Fig 5 Expression of p-Drp1 and MnSOD A:Electrophoretogram of p-Drp1 and MnSOD in each group.B:Quantitative analysis of p-Drp1 and MnSOD expression.**P<0.01 vs control group;#P<0.05,##P<0.01 vs TSLP group.
4 讨论
线粒体为高度动态的网管状细胞器,其动态平衡机制调节着细胞系列生命活动,而与多种生理病理变化密切关联[6-7]。NK细胞是参与机体肿瘤免疫、变态反应等活动的重要细胞[5]。近年研究示,NK细胞功能紊乱,常伴随着线粒体功能的失常,以及线粒体过度分裂现象[8,13]。然而粒体功能与NK细胞状态间是否存在关联尚不明确。本研究则立于“线粒体功能紊乱-细胞异常活化”这一视角,探讨NK细胞NK2 活化的内部机理,为NK细胞异常活化机制及潜在干预靶点这一研究盲区提供参考。
NK细胞NK2型活化,释放IL-4、IL-5、IL-10等细胞因子,介导变应性炎症反应,参与变应性鼻炎、特应性皮炎、哮喘等疾病的发生发展[2,14]。TSLP可有效诱导T细胞Th2型分化、NK细胞NK2活化,为加剧体内外变应性炎症反应的重要分子[15]。研究显示,TSLP刺激后,NK-92MI细胞上清中IL-4、IL-5水平显著升高,IFN-γ水平下调,符合NK细胞NK2型活化表征。而5、10 μmol·L-1Mdivi-1干预后,细胞上清IL-4、IL-5水平下调,IFN-γ 浓度亦有所回升,提示Mdivi-1能有效抑制TSLP刺激所诱导的NK细胞Th2反应相关因子的分泌。
Mdivi-1为调节Drp1活性以特异性逆转线粒体分裂事件的化学分子[16]。近年来,Mdivi-1已广泛运用于线粒体动态变化与肿瘤、神经退行性、心血管疾病等关联的探索之中[16-17]。线粒体荧光探针MitoTracker染色示,TSLP刺激后,大量球状线粒体分布于NK细胞胞质内,提示线粒体分裂亢进,这一现象与其他其他文献报道相符[6,8]。而Mdivi-1干预后,TSLP诱导下NK细胞线粒体过度分裂现象得到显著改善,其线粒体长度亦有所回归。蛋白印迹分析示,Mdivi-1干预可有效抑制NK细胞异常活化状态下线粒体分裂调控因子Drp1的活化。提示Mdivi-1抗NK细胞NK2型活化作用可能与其抑制线粒体过度分裂,重建线粒体动态平衡相关。
线粒体过度分裂可触发大量内生ROS的生成[6],而后者与T、B、NK细胞等异常活化密切关联[9,18]。DHE染色及流式分析显示,TSLP刺激下NK细胞内生ROS水平明显升高。而Mdivi-1干预则能有效下调TSLP刺激下NK细胞ROS内生,且该效应与Mdivi-1浓度呈正相关态势。同时,蛋白印迹分析亦显示,TSLP刺激下NK细胞MnSOD这一氧化应激防御因子表达的下调,亦于Mdivi-1干预后得到一定程度逆转。综上,Mdivi-1调节NK细胞ROS水平,可能是其抑制线粒体分裂以改善NK细胞NK2型活化的效应环节之一。
本次试验存在一些问题:(1)鉴于原代NK细胞培养难度较大,本研究以NK92MI细胞株作为实验对象,研究结果可能存在一定偏倚;(2)本研究未能选择Drp1基因沉默技术调节线粒体分裂,从抑制剂及基因敲降两个层面同步验证实验结果;(3)Mdivi-1抑制线粒体分裂后,具体通过哪些分子机制链影响NK细胞分化未进一步深入探索,这是我们下一步研究的重要方向。
综上,通过Mdivi-1抑制线粒体过度分裂,重建线粒体动态变化,可有效抑制TSLP刺激下NK细胞NK2型活化。线粒体动态失衡是NK细胞异常活化的内在机制之一,其可能为改善NK细胞NK2型活化介导的变应性炎症反应的重要靶点。
