去甲泽拉木醛通过调控细胞周期和自噬诱导的细胞凋亡抑制K562细胞生长的机制
2022-02-24张亚军黄玖红何刘军胡春生杨东林陈中祝唐典勇
张亚军,黄玖红,2,何刘军,胡春生,杨东林,2,陈中祝,唐典勇
(1.重庆文理学院药学院、创新靶向药物国家地方联合工程研究中心、激酶类创新药物重庆市重点实验室,重庆 永川 402160;2.西南大学药学院中医药学院,重庆 北碚 400715)
慢性髓系白血病(chronic myeloid leukemia,CML)是一种克隆性骨髓增生的恶性血液系统疾病,其发病率较高,以患者体内9号和22号染色体发生易位形成BCR-ABL融合基因为特征,该基因表达的蛋白是组成型酪氨酸激酶[1]。随着酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)在临床上的广泛应用,病人生存时间和生存质量都得到了明显改善。但是TKI存在病人不耐受、耐药以及无法根治CML等诸多问题,尤其对于急变期患者缓解率仅为20%~40%,中位生存期仅有6~9个月[2]。因此,寻找和研究更有效的靶向CML药物对治疗CML患者具有重要的临床意义。
细胞周期和细胞凋亡是肿瘤细胞生长的两大主要调控机制,越来越多研究表明化疗药物通过细胞周期阻滞和细胞凋亡发挥抗癌作用。在慢性髓系白血病治疗研究中发现,分离自豨莶草中的奇壬醇能够将慢性髓系白血病细胞K562细胞周期阻滞于S期,并诱导细胞凋亡而发挥抗癌作用[3];Martnez-Castillo等[4]研究发现,姜黄素能够将K562细胞周期阻滞于G2/M期,诱导caspase-9和caspase-3介导的细胞凋亡;Hassanzadeh等[5]发现槲皮苷通过与热激蛋白70和90结合,诱导细胞周期阻滞和细胞凋亡,抑制K562细胞增殖。
有研究报道,中药材卫矛科雷公藤中的主要活性成分雷公藤甲素和南蛇藤醇具有抗肿瘤作用,能够诱导多种肿瘤细胞发生自噬性细胞死亡和细胞周期阻滞[6-7]。与雷公藤甲素和南蛇藤醇相比,分离自雷公藤的三萜系化合物单体—去甲泽拉木醛(demethylzeylasteral,ZST93)对正常细胞的毒性较小,并且能够更好地抑制黑色素瘤、恶性胶质瘤和乳腺癌细胞增殖、转移和血管形成等[8-11]。此外,ZST93能够通过诱导自噬性死亡抑制胰腺癌细胞增殖,并且增加胰腺癌细胞对吉西他滨的敏感性[12]。然而,ZST93是否可以作为一个广谱性抑制剂在CML中发挥抗癌作用,至今还未见报道。
基于此,本研究以人CML细胞K562为研究模型,检测了ZST93对K562细胞的生长抑制作用,并进一步分析ZST93对K562细胞周期、细胞凋亡和自噬的影响,旨在探究ZST93在CML细胞中的活性及可能的抑癌机制。
1 材料与方法
1.1 细胞系人慢性髓系白血病细胞K562购自南京科佰生物科技有限公司(中国)。
1.2 药物与试剂Demethylzeylasteral (ZST93)、Z-VAD-FMK (上海陶素生化科技有限公司);RPMI 1640培养基、胰酶和青链霉素(美国Gibco公司);胎牛血清(fetal bovine serum,南美Natocor公司);细胞增殖与毒性检测试剂盒(cell counting kit-8,CCK-8)、细胞凋亡试剂盒(Annexin V-fluorescein isothiocyanate isomer/propidiumiodide,AnnexinV-FITC/PI)和结晶紫(上海碧云天生物技术有限公司);碘化丙啶(propidium iodide,美国Sigma-Aldrich公司)。抗体β-Actin (CST-3700S)、CDK4 (CST-12790S)、CDK6 (CST-13331S)、Cyclin D (CST-55506S)、LC3B (CST-43566S)、p62 (CST-88588S)、PARP (poly ADP-ribose polymerase,CST-9532T)、cleaved PARP (CST-5625T)、caspase-8 (cysteinyl aspartate specific proteinase-8,CST-9746S)、cleaved caspase-8 (CST-8592S)、caspase-9 (cysteinyl aspartate specific proteinase-9,CST-9508T)、cleaved caspase-9 (CST-7237T)、caspase-3 (CST-9668T)和cleaved caspase-3 (CST-9661S)(美国Cell Signaling Technology 公司);荧光二抗(美国LI-COR Biosciences 公司)。
1.3 主要仪器CO2细胞培养箱和台式低速离心机(美国Thermo Scientific公司);酶标仪(美国BioTek公司);倒置荧光显微镜(日本Olympus 公司);BD AccuriTMC6流式细胞仪(美国BD Biosciences公司);SDS-PAGE电泳仪和转模仪(美国BIO-RAD公司);奥德赛双色红外荧光成像系统(美国Li-cor公司);高内涵分析系统 (美国PerkinElmer公司)。
细胞培养与试剂配制 人慢性髓系白血病细胞K562培养于含有10%胎牛血清、1%青霉素-链霉素的RPMI 1640培养基中,置于37 ℃、含5% CO2恒温培养箱中常规培养。DMSO溶解ZST93和Z-VAD-FMK配制母液,给药时用RPMI 1640稀释成不同的浓度。
1.4 CCK-8法检测细胞存活率取处于对数期的K562 细胞(5×103个/孔)接种于96孔板中,置于细胞培养箱中培养过夜,待细胞密度达到40%时加入不同浓度的ZST93,分别培养24、48和72 h。每孔中加入10 μL CCK-8 溶液,于细胞培养箱孵育2 h,酶标仪测试各孔450 nm处的吸光度(A),计算细胞存活率;细胞存活率/%=(A用药组-A空白组)/(A对照组-A空白组)×100%。
1.5 流式细胞术检测细胞周期分布待K562细胞经过相应浓度的ZST93处理后,通过胰酶消化、离心后收集细胞,PBS缓冲液重悬洗涤后加入预冷的70%乙醇固定24 h。次日取出,离心(1 000 r·min-1,5 min,4 ℃ ),弃上清后用PBS缓冲液再次洗涤2次,然后加入已配制好的细胞周期检测试剂200 μL(PBS缓冲液 194 μL,10 mg·L-1RNase 5 μL,5 g·L-1PI 1 μL),37 ℃避光染色30 min后,使用流式细胞仪分析细胞周期。
1.6 流式细胞仪检测细胞凋亡待K562细胞经过相应浓度的小分子化合物(ZST93、Z-VAD-FMK)处理后,通过胰酶消化,室温下800 r·min-1离心5 min,弃上清,PBS缓冲液重悬洗涤,加入205 μL 细胞凋亡检测试剂(Annexin V-FITC结合液 195 μL,AnnexinV-FITC 5 μL,PI 10 μL),避光孵育20 min,使用流式细胞仪分析细胞凋亡。
1.7 Western blot检测相关蛋白表达待K562细胞经过相应浓度的小分子化合物(ZST93、Z-VAD-FMK)处理后,收集细胞,采用预加PMSF和RIPA裂解液于冰上裂解0.5 h提取细胞总蛋白。选择BCA蛋白定量试剂盒进行蛋白定量。调整对照组和实验组上样量为25 μg电泳、转膜,5% BSA-TBST封闭2 h,最后进行相对应一抗于4 ℃孵育过夜。待TBST洗涤5 min,共3次后,蛋白膜加入IRDye 800CW goat anti-mouse IgG (H+L)或者 IRDye 680LT donkey anti-rabbit IgG (H+L)荧光二抗进行室温孵育1 h,再次进行TBST洗涤5 min共3次后,蛋白膜放入双色红外荧光成像系统后进行曝光,得到蛋白免疫印迹条带。同时,β-tubulin蛋白条带作为参照。

2 结果
2.1 ZST93对K562细胞增殖的影响ZST93是一种分离自雷公藤的三萜系化合物单体(Fig 1A),具有抗多种肿瘤细胞活性。为了研究ZST93在人慢性髓系白血病细胞中的作用,本研究首先对其在抑制K562细胞中的活性进行了分析,Fig 1B结果显示,ZST93处理24 h后的细胞半数抑制浓度(IC50)为2.59 μmol·L-1。随后,利用0.5、1、2、4和8 μmol·L-1ZST93分别处理K562细胞24、48和72 h,结果显示,随着药物浓度的增加和处理时间的延长,其相应的增殖抑制率明显增强,呈浓度和时间梯度依赖性(Fig 1C)。进一步在显微镜下对不同浓度ZST93处理后的K562细胞进行观察发现,随着ZST93浓度升高,显微镜视野中的细胞数量明显减少(Fig 1D),表明ZST93能够抑制人慢性髓系白血病细胞K562的增殖。
2.2 ZST93阻滞K562细胞周期于G1期Fig 2A流式结果显示,与对照组相比,不同浓度的ZST93(1、2和4 μmol·L-1)处理K562 细胞48 h后,细胞周期S期细胞比例减少,G1期细胞比例明显增加。通过Western blot进一步分析G1期相关蛋白表达情况,Fig 2B结果发现,致癌蛋白c-MYC、细胞周期蛋白Cyclin D、细胞周期蛋白依赖性激酶CDK4和CDK6随ZST93浓度的增加而被显著下调,表明ZST93能够将K562细胞周期阻滞于G1期,进而抑制细胞增殖。
2.3 ZST93能够激活K562细胞自噬人类多种肿瘤中存在自噬异常,自噬在肿瘤发生发展的各个阶段均扮演着重要角色。为了研究ZST93对K562细胞中自噬的调控作用,本研究通过荧光显微镜下观察GFP-LC3融合蛋白分布和LC3-Ⅰ转化为LC3-Ⅱ的比例来示踪自噬形成。如Fig 3A所示,与对照相比,ZST93处理后多个明亮的融合蛋白GFP-LC3绿色荧光斑点分布在K562细胞质中。同样,Western blot结果发现随着ZST93药物浓度增加,LC3-Ⅰ转化为LC3-Ⅱ的比例升高,说明ZST93导致自噬体在K562细胞中大量积累。此外,自噬流标志蛋白p62随ZST93药物浓度增加而减少,标志着ZST93促进自噬流(Fig 3B)。已有研究表明MAPK/ERK信号通路在自噬激活中发挥着重要作用[13]。Fig 3B结果显示,随着ZST93药物处理浓度升高,p-ERK的水平增加,表明ZST93可能通过激活ERK而调控细胞自噬。
2.4 ZST93诱发K562细胞外部凋亡信号通路近来研究报道发现ZST93能够通过诱导自噬而促进胰腺癌细胞死亡[12]。为了研究ZST93激活自噬后在K562细胞凋亡中的作用,本研究通过Annexin V-FITC/PI染色和流式细胞术检测细胞凋亡率。流式细胞结果显示(Fig 4A),与对照组相比,不同浓度的ZST93(1、2和4 μmol·L-1)处理K562细胞48 h后,可明显诱导细胞凋亡,且其总凋亡率(早期凋亡和晚期凋亡)呈剂量依赖性增加,随着给药浓度增加,细胞凋亡率从6.15%增加到了44.63%(P<0.001),说明ZST93能够诱导K562细胞凋亡(Fig 4B)。为了进一步分析ZST93诱导K562发生细胞凋亡的方式,利用Western blot检测外部凋亡信号通路相关蛋白,Fig 4C结果发现,ZST93诱发caspase-8、caspase-3、caspase-9和PARP发生剪切,并具有浓度依赖性,表明ZST93激活外部凋亡信号通路。

Fig 1 The anti-proliferative effect of ZST93 on K562 cell n=3)A:The chemical structure of ZST93;B:IC50 value of ZST93 in K562 cells was calculated;C:The inhibitory rate of ZST93 on K562 cells.K562 cells were exposed to indicated concentrations of ZST93 for 24,48 and 72 h.CCK8 was performed to measure cell viability and growth;D:Cell morphology of K562 cells was captured with microscope after treatment with vehicle (0.05% DMSO)or the indicated concentrations of ZST93 for 48 h.magnification:×100.The histogram showed the quantification of cell proliferation rate.**P<0.01 vs vehicle.

Fig 2 ZST93 induced cell cycle at G1-phase to exhibit anticancer effectA:The cell cycle of K562 cells was measured by flow cytometry in the presence of vehicle or ZST93;B:Percentages of cell in different periods;C:Effect of ZST93 on the expression levels of G1 related proteins in K562 cells.

Fig 3 ZST93 initiated autophagy in human K562 cells n=3)A:The punctate staining pattern of LC3 was detected using high content analysis system-operetta CLSTM in K562 cells after treatment with increasing concentrations of ZST93 for 48 h.Scale bar:10 μm;B:The protein expression levels involved in autophagy were detected Western blot.**P<0.01 vs vehicle.

Fig 4 ZST93 induced caspase-8-dependent extrinsic apoptotic cell death in human K562 n=3)A:Apoptotic cell death in K562 cells was measured by flow cytometry after treatment with or without ZST93 for 48 h;B:The histogram showed the corresponding quantification of early and late apoptosis rate;C:The expression of caspase pathway related proteins in K562 cells was examined by Western blot after exposure to ZST93 for 48 h.β-actin was loaded as a control.**P<0.01 vs vehicle.
2.5 caspase-3抑制剂Z-DEVD-FMK降低ZST93诱导的K562细胞凋亡Z-DEVD-FMK是一个选择性的caspase-3抑制剂,能够有效抑制caspase-3的活性。为了明确Z-DEVD-FMK是否能够减弱ZST93诱导的K562细胞凋亡,本研究利用Z-DEVD-FMK和ZST93同时处理K562后,通过流式细胞术检测K562细胞凋亡情况,如Fig 5A,B所示,与4 μmol·L-1ZST93单独处理K562细胞相比,50 μmol·L-1Z-DEVD-FMK和 4 μmol·L-1ZST93同时处理能够明显降低K562细胞凋亡率。Western blot进一步分析细胞凋亡相关蛋白发现(Fig 5C),Z-DEVD-FMK能够明显减弱ZST93诱导的caspase-9、caspase-3和PARP剪切,表明ZST93诱导的细胞凋亡依赖于caspase-3。
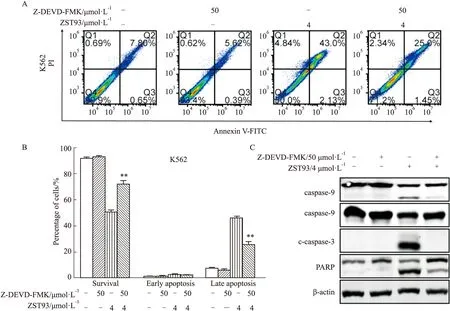
Fig 5 Z-DEVD-FMK,the inhibitor of caspase-3,decreased apoptosis in K562 induced by n=3)A:Apoptotic cell death in K562 cells was measured by flow cytometry after treatment with or without ZST93,Z-VAD-FMK (50 μmol·L-1),ZST93 and Z-VAD-FMK (50 μmol·L-1)for 48 h;B:The histogram indicated the corresponding quantification of early and late apoptotic rate;C:The expression of caspase pathway related proteins in K562 cells was evaluated by Western blot after exposure to ZST93,Z-VAD-FMK (50 μmol·L-1),ZST93 and Z-VAD-FMK (50 μmol·L-1)for 48 h.**P<0.01 vs vehicle.
3 讨论
慢性髓系白血病患者主要经历3个不同阶段,即慢性期、加速期和急变期,其中急变期患者症状恶化迅速,对健康造成严重威胁。目前,临床上常用的酪氨酸激酶抑制剂,如伊马替尼,大大提高了CML患者的生存时间和生存质量。但是由于耐药、病人不耐受以及对部分患者欠佳等问题,寻找和研究能够抑制CML细胞生长、增殖、耐药和复发的治疗药物迫在眉睫[14]。已有研究报道,ZST93对包括黑色素瘤[9]、恶性胶质瘤[10]、乳腺癌[11]和胰腺癌[12]在内的多种肿瘤细胞具有抑癌活性。然而,ZST93抑制CML的活性还有待进一步分析。本研究显示ZST93能够抑制慢性髓系白血病细胞K562生长和增殖,并且呈浓度和时间依赖性。
自噬是一个进化上保守的动态过程,该过程中一些折叠错误的蛋白或受损的细胞器被双层膜结构的自噬小泡包裹后,与溶酶体融合形成自噬-溶酶体,最终使包裹物质被降解。自噬能够增加或降低肿瘤细胞的生长,在肿瘤的发生发展中具有“双刃剑”的角色[15]。MAPK/ERK信号通路的激活调控了诸如细胞增殖、迁移和分化等重要过程,研究发现MAPK/ERK在多种肿瘤细胞被激活,MAPK/ERK激活不仅与细胞生存有关,而且与细胞自噬、细胞凋亡和细胞衰老有关[16]。本研究中ZST93处理K562细胞后,使得GFP-LC3积累在细胞质中、LC3-Ⅰ转化为LC3-Ⅱ的比例明显升高以及自噬流标志蛋白P62随ZST93药物浓度增加而减少,表明ZST93能够激活细胞自噬。有研究发现,癌细胞中MAPK/ERK激活后通过促进自噬流稳定蛋白FOXO1 (Fork head Box O1)的降解,从而抑制自噬过程[17]。但是,ZST93激活MPAK/ERK后,促进自噬发生是否通过降解FOXO1 来实现还需要今后深入探索。
在CML的发病机制中,细胞凋亡起着重要作用,细胞凋亡和增殖之间的失衡会导致肿瘤的发生和发展。肿瘤细胞凋亡包括依赖凋亡受体的外部凋亡和线粒体途径的信号通路,caspase家族蛋白在这两条凋亡途径中都扮演着重要角色。外部凋亡信号通路中激活的caspase-8和内部凋亡信号通路中激活的caspase-9都激活细胞凋亡最终执行者—caspase-3,激活的caspase-3进而剪切下游底物PARP,最后导致凋亡发生[18]。本研究中,ZST93激活K562细胞自噬,进一步诱导K562细胞发生早期和晚期细胞凋亡,并促使caspase家族中caspase-3、caspase-8、caspase-9以及PARP呈浓度依赖性发生剪切,这提示ZST93可能通过调控自噬诱导外部凋亡信号通路,激活凋亡相关因子的表达,促使K562细胞凋亡。此外,近来研究表明,细胞周期分布异常是诱发肿瘤发生发展的另一个特征,药物诱导细胞凋亡的同时,通常与细胞周期阻滞共同发生。本研究结果显示,ZST93可诱导K562细胞周期阻滞于G1期,阻止了其细胞周期进入S期。
本研究结果表明,ZST93能够抑制K562细胞生长和增殖,是K562细胞抑制剂,能诱导细胞周期阻滞和外部凋亡信号通路,并探讨了其可能的作用机制:ZST93激活了MPAK/ERK以及自噬性死亡通路,并最终激活了caspase-8、caspase-9、caspase-3和PARP凋亡信号通路。综上所述,本研究为ZST93药物用于抗CML肿瘤药物研发提供了研究基础,但其体内活性还需进一步开展动物研究,将为CML临床应用提供实验依据。
