高效回收镍盐化工污泥制取硫酸镍技术工艺分析
2022-02-23张志君
张志君
(格尔木市质量技术检验检测中心,青海 格尔木 816099)
金属冶炼,化工生产,皮革处理和电沉积表面处理等行业生产过程中会产生大量的含镍污泥[1],并且往往都伴随着其他如Cu、Ni、Cr等重金属元素污泥[2],这些重金属污泥属于我国《国家危险废物名录》规定的47类危险废物,对土壤和地下水有很大的危害,并且不易消除,易造成植物的萎靡坏死,同时也会危害人体健康[3],据文献,镍金属中毒会造成罹患肺癌的概率增大。因此,对含镍污泥进行回收处理是很有必要的,这不仅是对环境方面的友善保护,同时也具有很大的经济效益[4]。现有的研究中,化工污泥提取金属盐有很多方法,比如萃取法[5]、氨浸-加压氢还原法[6]、酸浸电解法[7]、离子交换法[8]等等。本文主要使用化学沉淀法[9,10]回收NiSO4。化学沉淀法的具体操作简单易学,成本低廉,适合批量化处理同种类的大量化工污泥。
1 试验材料及仪器
本实验的实验材料为某硫酸镍化工厂生产废物,黄绿色块状,经测定,该材料的含水率为76.2%,对化工污泥进行烘干处理后,将其磨成粉末状,以加速实验过程中溶解的效率,并要求可通过400目筛,以得到相似的状态。
Sartorius BS22S型电子天平;禾创KH-250DB型超声仪;贝蒂SHB-3型真空泵;热电M-6型火焰原子分光光度计。
2 浸出试验
浸出实验是为了确定出能够完全浸出污泥中镍元素的H2SO4用量,为了节省原料的损耗,设计了两个步骤来确定最佳的参数。
2.1 不同H2SO4浓度下的浸出实验
采用电子天平称量2g制备完全的粉末,加入少量水溶液,搅拌溶解后移至100mL的容量瓶中,洗涤2~3次后往容量瓶中加入20mL浓度分别为0.5,1,2,3和4mol·L-1的H2SO4溶液,充分混合摇匀后定容,静置后将溶液稀释1×104倍,使用火焰原子分光光度计对溶液中镍的含量进行测定。测定结果见图1。

图1 不同H2SO4浓度下的镍的浸出率Fig.1 Leaching rate of nickel at different concentrations of sulfuric acid
由图1可知,当H2SO4的浓度达到2mol·L-1时,污泥材料中镍的浸出率已经接近100%,且当H2SO4的浓度再高时,镍的浸出率维持在一个相似的值。由此可见,该化工污泥H2SO4浓度为2mol·L-1时,镍的浸出率最佳。
2.2 不同含量H2SO4的浸出试验
在确定最佳的H2SO4浸出浓度后,采用电子天平称量2g粉末,同样移至100mL的容量瓶中,往容量瓶中分别加入10,12,14,16和18mL浓度为2mol·L-1的H2SO4溶液,充分混合摇匀后定容,静置等待后将溶液稀释1×104倍,使用火焰原子分光光度计对溶液中镍的含量进行测定。
图2为浓度2mol·L-1H2SO4不同的用量下镍的浸出率。

图2 不同H2SO4用量下镍的浸出率Fig.2 Leaching rate of nickel at different amounts of sulfuric acid
由图2可知,当H2SO4的用量达到16mL时,污泥材料中镍的浸出率已经接近100%,且随着H2SO4用量的再增加,镍的浸出率并没有明显变化。由此可见,此种污泥在H2SO4浓度为2mol·L-1用量为16mL时,镍的浸出率最佳。
3 分离提纯试验
3.1 沉铁试验
选择4组100mL的浸出液,充分搅拌后将浸出液的pH值分别调节至3、4、5、6。待调节pH值后静置30min,等待温度平衡后进行抽滤处理,在250mL容量瓶中定容,将过滤得到的滤渣烘干。定容得到的滤液将其稀释2×104倍,浸出液稀释5×104倍后,对两种液体中含有的Ni2+和Fe3+的浓度进行测定,并且分析滤渣固体的成分含量。在得到结果后,对溶液中的Ni2+和Fe3+的沉淀率进行计算。沉淀率的统计见图3。
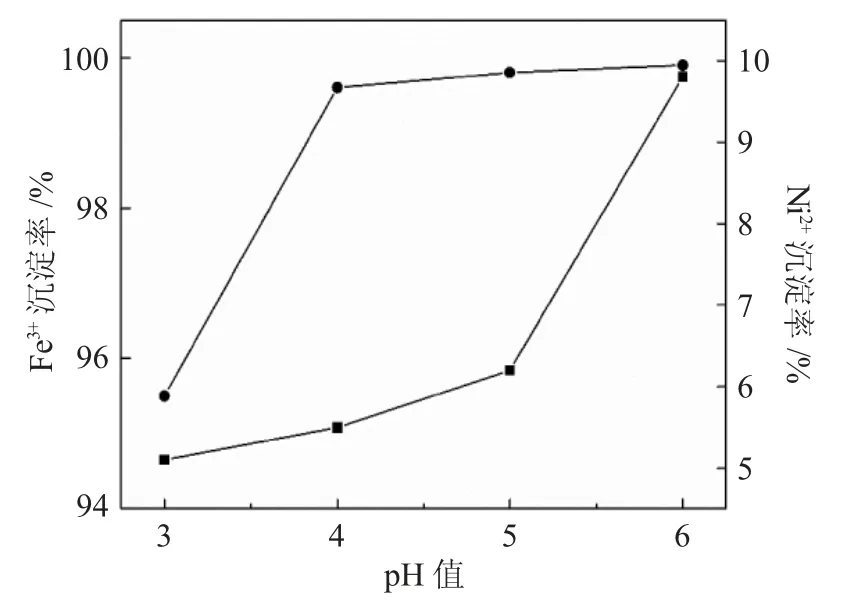
图3 不同pH值下的Fe3+和Ni2+的沉淀率Fig.3 Precipitation rates of Fe3+and Ni2+at different pH value
由图3可知,随着pH值的增大,铁和镍的沉淀率都在上升,不同的是,Fe3+的沉淀率在pH值为3时就达到了95%以上,在pH值达到4时达到了98%,pH值为5时Fe3+的沉淀率已经接近100%,且pH值继续增大时仅有微小的增长。然而,Ni2+的沉淀率虽然也随着pH值的增加而增加,但pH值达到5时,Ni2+的沉淀率仅有6%,随着pH值的再升高,沉淀率有了较快的增长。综合这两方面因素考虑,选择pH值为5时对Fe3+的沉淀率较好,并且Ni2+损失量较小。
3.2 沉镍试验
由沉铁实验的结果可知,当pH值为5时浸出液中Fe3+比较好的沉淀下去。按照3号浸出液的配比配出4组调好pH值的浸出液100mL,将pH值分别再次调节为7、8、9、10。静置30min等待温度平衡后,进行抽滤处理,在250mL容量瓶中定容后,将过滤得到的滤渣烘干。定容得到的滤液将其稀释2×104倍,浸出液稀释5×104倍后,对两种液体中含有的Ni2+和Fe3+的浓度进行测定,对Ca2+、Mg2+和Ni2+的浓度进行测定。最后计算溶液中Ni2+、Mg2+、Ca2+的沉淀率。Ni2+的沉淀率见图4。
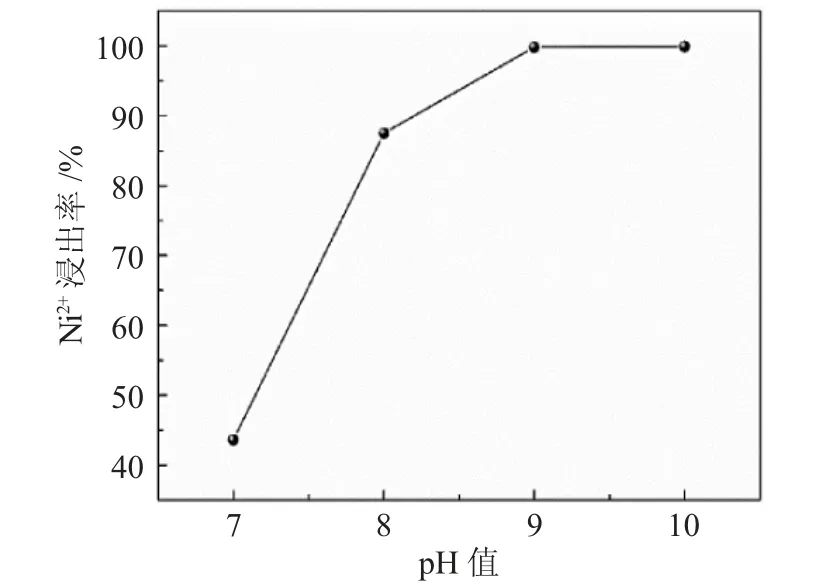
图4 不同pH值下的Ni2+的沉淀率Fig.4 Precipitation rate of Ni2+at different pH value
由图4可知,Ni2+的沉淀率依然随着pH值的增大而增大,并且在pH值达到9时,沉淀率就已然接近100%,因此,沉镍的最佳pH值为9。
4 NiSO4的制备
4.1 水洗工艺
用电子天平称取沉镍实验后得到的Ni(OH)2沉淀10g,加入200mL水溶液充分搅拌使其尽可能溶解,搅拌过滤后,将过滤留下的固体再次加入200mL水溶液充分搅拌,重复此操作4次,并将这些溶液按顺序摆放,将这5组溶液分别进行离子浓度测试,并且统计溶液中Mg2+、Ca2+、Na+、Ni2+等的离子浓度,为了得到水洗前后的Ni(OH)2沉淀的具体成分和含量,使用XRF分析测试技术对水洗前后的沉淀测定分析。测定出的结果见表1。

表1 水洗前后Ni(OH)2XRF元素分析Tab.1 Elemental analysis of nickel hydroxide XRF before and after water washing
由表1可以看出,经过水洗后,Na+,Mg2+和Mn2+的含量有很大的降低,但同时,Fe3+,,Ca2+等杂质含量也有所上升,这说明水洗工艺并不能很好地提纯镍元素,且值得注意的是的含量虽然在下降,但只从原始的17.65%下降到10.15%,去除比例并不大,水洗工艺对的去除效果也不甚理想。
4.2 溶解实验
根据水洗工艺和XRF实验得到的水洗前后的各部分元素含量,利用各氧化物和H2SO4的反应方程式计算,得到理论上完全反应1g水洗后的Ni(OH)2沉淀块所需要的H2SO4含量是7mL·mol-1。即7mL的1mol·L-1H2SO4溶液。取5组1g经过水洗后的Ni(OH)2块置于试管,分别加入7.7,8.4,9.1,9.8,10.5mL的1mol·L-1的H2SO4,超声震荡30min后,查看沉淀物的溶解情况。
结果发现,当加入9.8mL和10.5mL H2SO4时,沉淀物完全溶解,换而言之,加入1.4倍量的理论H2SO4量就可以完全溶解Ni(OH)2沉淀。
4.3 蒸发结晶处理
使用电子天平称量20g水洗工艺得到的Ni(OH)2放入烧杯中,根据溶解步骤得到的结论,加入1.4倍理论添加量的H2SO4,即19.6mL浓度为1mol·L-1的H2SO4溶液,搅拌溶解后超声震荡30min后加热到90℃,当加热到烧杯中液体只剩余很少部分时停止加热,并冷却2h,将得到的晶体取出并用少量水冲洗烘干,采用XRF方法对晶体成分进行测定。测定结果见表2。

表2 结晶体成分测定结果Tab.2 Determination results of crystalline composition
由表2可以看出,Ni2+和是主要成分,其他元素的含量占比不超过0.3%。通过计算可知,结晶的主要成分是NiSO4,且纯度较高,镍的含量达到20.3%,达到了国家工业硫酸镍Ⅰ类合格品的标准。
5 结论
本文从化工生产过程中产生的镍基化工污泥中回收再利用提纯镍盐为目的,前后采用浸出、水洗、溶解、蒸发再结晶工艺对污泥进行处理,得到含量较高且纯度合格的NiSO4产品,结论如下:
(1)在2mol·L-1H2SO4的用量为16mL时,污泥材料中镍的浸出率已经接近100%,即浸出实验的最佳参数为2mol·L-1H2SO4用量为16mL。
(2)沉铁实验中,调节pH值为5时即可将绝大部分Fe3+从溶液里去除,同时不消耗太多的Ni2+。沉铁过程后进行的沉镍实验中,将pH值维持在9左右即可保证镍元素有较高沉淀率和纯度。
(4)经过水洗、酸洗、蒸发结晶后得到晶体主要成分为NiSO4,且纯度较高。
(5)化工污泥经本文的回收工艺,其回收率可达到92%以上,得到的NiSO4产品达到了国家工业硫酸镍Ⅰ类合格品的标准。
