胰腺癌术后发生肝转移的影响因素分析
2022-02-23常玉霞党元娜
敬 蕾 常玉霞 党元娜
胰腺癌属于消化道恶性肿瘤,截止至2015年,在我国全部恶性肿瘤中,胰腺癌发病率位居第9,癌症相关死亡率位居第6,恶性程度高,5年自然存活率未达5%[1-2]。对于符合手术指征患者,手术为主要治疗方式,但术后复发、肝转移风险较高,单独应用胰腺癌根治术,术后患者5年生存率仍低于20%[3]。明确胰腺癌术后肝转移影响因素,利于指导临床从多方面进行综合干预,降低肝转移风险,提高患者生存率。基于此,本研究选取我院41例胰腺癌术后肝转移患者和41例同期胰腺癌术后无肝转移患者作为研究对象,分析术后肝转移影响因素。具体分析如下。
1 资料与方法
1.1 一般资料
本研究选取2017年2月至2020年4月我院胰腺癌术后肝转移患者41例作为肝转移组,以1∶1配比选取同期我院胰腺癌术后无肝转移患者41例作为无肝转移组。均采用经内镜逆行性胰胆管造影、肿瘤标志物检测等方法确诊为胰腺癌;排除术前存在肝转移者和并发其他恶性肿瘤者。肝转移组:男性27例,女性14例;年龄<60岁21例,≥60岁20例。无肝转移组:男性25例,女性16例;年龄<60岁23例,≥60岁18例。2组一般资料对比差异无统计学意义(P>0.05)。
1.2 方法
采用我院自制《胰腺癌术后肝转移的影响因素》调查问卷收集患者性别、年龄、体质量指数(BMI)、术前肝功能分级、癌组织分化程度、有无脉管癌栓、是否合并脂肪肝、有无术后化疗信息,并进行统计分析。共发放82份调查问卷,全部有效收回。
1.3 统计学方法
采用SPSS22.0分析,计数资料n(%)表示,χ2检验,多因素采用logistic回归分析,检验水准α=0.05。
2 结果
2.1 胰腺癌术后肝转移的影响因素分析
性别、年龄与胰腺癌术后肝转移无明显相关性(P>0.05);BMI、术前肝功能分级、癌组织分化程度、有无脉管癌栓、是否合并脂肪肝、有无术后化疗是胰腺癌术后发生肝转移的影响因素(P<0.05)。见表1。
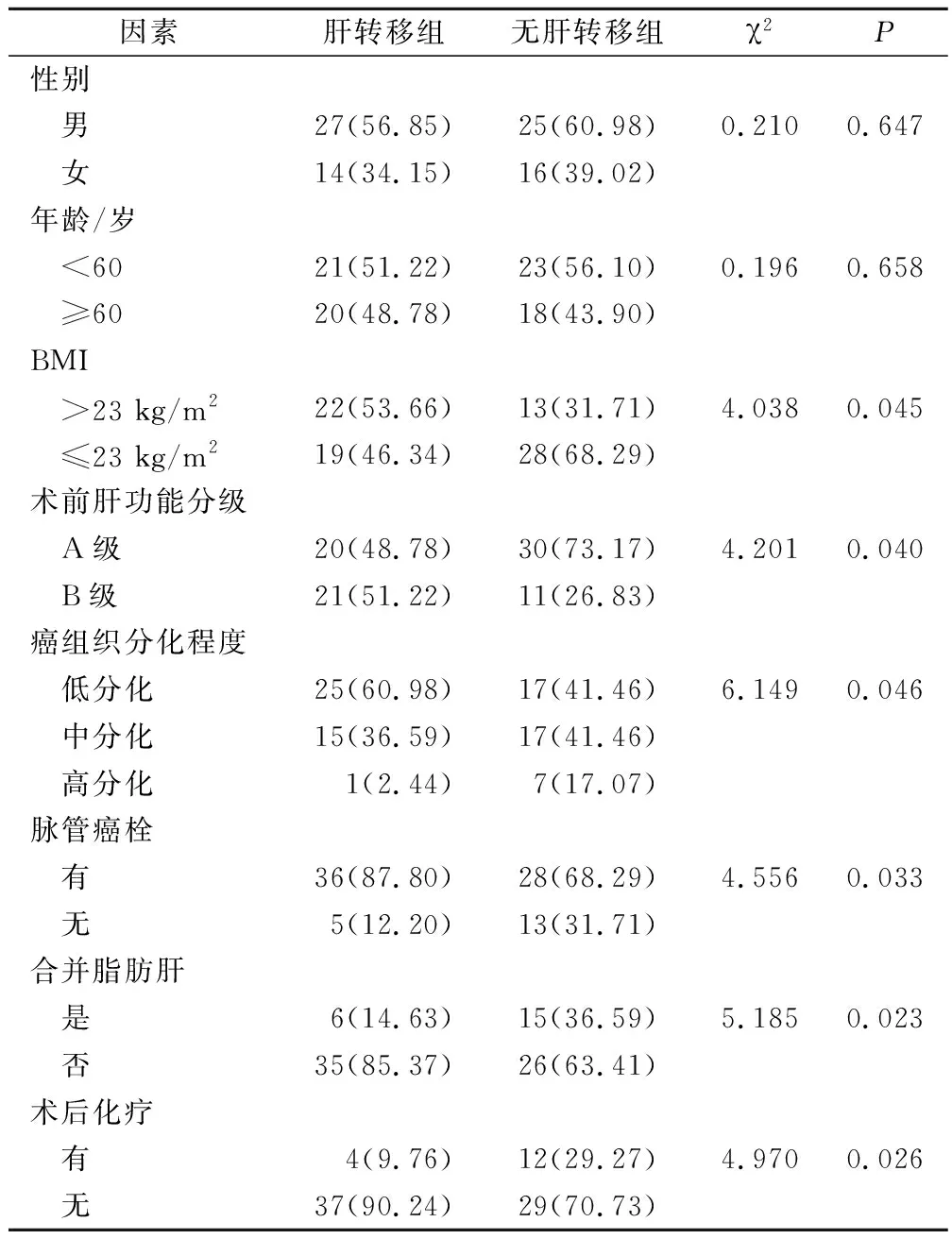
表1 胰腺癌术后肝转移的影响因素分析(例,%)
2.2 多因素回归分析
Logistic回归分析显示,BMI>23 kg/m2、术前肝功能分级B级、癌组织低分化、脉管癌栓是胰腺癌术后肝转移的危险因素,合并脂肪肝、术后化疗是胰腺癌术后肝转移的保护因素(P<0.05)。见表2。
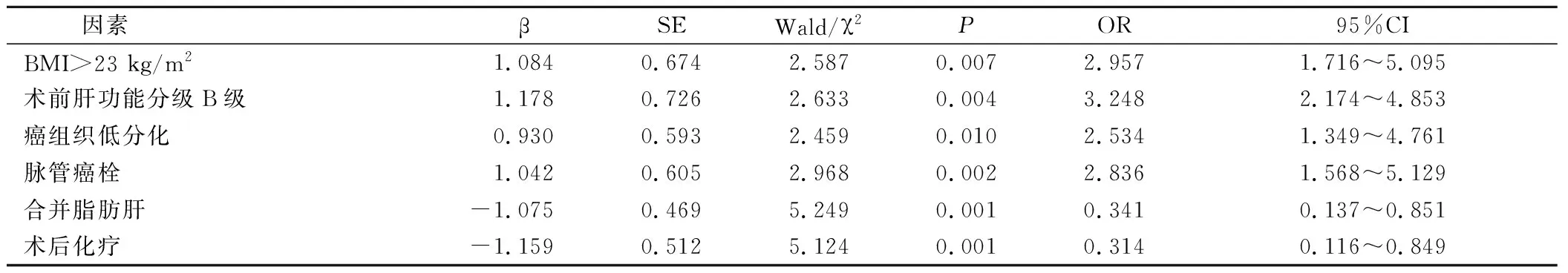
表2 多因素回归分析
3 讨论
肝转移为胰腺癌术后常见转移部位,也是导致胰腺癌患者术后死亡的重要原因之一。据相关数据统计,胰腺癌肝转移发生率为32%~46%,中位生存期为5~10个月[4-6]。积极探讨胰腺癌术后肝转移的危险因素,明确其相关预测指标,利于临床及时实施科学合理的干预,降低术后肝转移风险。
本研究将41例胰腺癌术后肝转移患者和41例同期胰腺癌术后无肝转移患者作为研究对象,分析结果显示,BMI、术前肝功能分级、癌组织分化程度、有无脉管癌栓、是否合并脂肪肝、有无术后化疗是胰腺癌术后发生肝转移的影响因素(P<0.05),可见上述因素与胰腺癌患者术后肝转移具有关联性。肥胖、术前肝功能分级B级患者个体免疫功能较差,在抵抗癌细胞侵袭中能力较低,易增加术后转移风险;低分化肿瘤细胞运动能力、浸润能力较强,易侵袭血管、淋巴管,随机体血流循环进入肝脏,导致肝转移;脉管癌栓易脱落,且多为团块状态,不易被机体免疫系统识别,无法有效杀灭,易存活在肝窦内,成为肝转移诱发因素[7-9]。同时,合并脂肪肝患者肝组织内沉积脂肪酸量较大,可抑制肿瘤生长,且脂肪肝可抑制血管形成和肿瘤病灶形成,避免癌细胞肝转移;术后化疗可清除微小癌细胞,提高疾病控制率,降低复发和胰腺癌肝转移风险,延长生存期。Logistic回归分析显示,BMI>23 kg/m2、术前肝功能分级B级、癌组织低分化、脉管癌栓是胰腺癌术后肝转移的危险因素,合并脂肪肝、术后化疗是胰腺癌术后肝转移的保护因素(P<0.05),进一步证实上述因素和胰腺癌术后肝转移具有相关性。此外,临床应从以下几个方面实施干预:①针对肥胖、肝功能分级较差患者,术前应积极纠正体重和肝功能至最佳状态,减轻原始诱发因素对肝转移的不良影响;②对于低分化和有脉管癌栓患者术后积极联合化疗干预,保障癌细胞清除效果,避免复发和术后转移;③一旦发现患者存在术后肝转移,应及时结合个体实际情况,实施介入治疗、免疫药物治疗、综合治疗等个体化治疗,及早控制疾病进展,延长生存期,促使患者临床获益。
综上所述,BMI>23 kg/m2、术前肝功能分级B级、癌组织低分化、脉管癌栓是胰腺癌术后肝转移的危险因素,合并脂肪肝、术后化疗是胰腺癌术后肝转移的保护因素,临床可据此制定防控方案,降低胰腺癌患者术后肝转移风险,提高远期效果。
