雌激素对香烟烟雾诱导肺上皮间质转化的影响
2022-02-22杨晓蕾李娜范敏娟张金桃刘向
杨晓蕾 李娜 范敏娟 张金桃 刘向
昆明医科大学第二附属医院全科医学科(昆明650101)
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD)是一种常见的肺部疾病,会对肺部造成不可逆的损伤[1-3]。香烟烟雾(CSE)是导致COPD 的主要病因,可诱导气道上皮细胞发生上皮间质转化(epithelial mesenchymal transition,EMT)而导致气道重塑,进而出现COPD[4-5]。已有研究证实类固醇激素与肺部发育、肺部炎症和肺癌有关。无论男女,雌激素都可在肺的局部产生,参与包括COPD 在内的肺部疾病的发生发展[6],且雌激素已被证实可作为临床治疗哮喘和COPD 的新靶点,其能够影响参与哮喘和COPD 发病机制的蛋白质的表达[7]。雌激素还被发现在多种癌症中促进EMT 的发展[8]。也有研究表明,低表达的miR⁃21 可以缓解COPD 严重程度[9],miR⁃21 还可通过调控SMAD 信号通路影响COPD 发展过程[10]。而在COPD 患者肺组织中SMAD 通路中分子会异常表达已被证实[10]。SMAD 信号通路的激活也会促进EMT 从而诱导COPD[11],损伤肺血管上皮导致肺动脉高压[12]。且有文献证实,调控SMAD 信号通路有助于治疗CSE 诱导的EMT[13]。综上所述,本研究旨在探讨雌激素通过调控miR⁃21/SMAD 信号通路对香烟烟雾诱导的EMT 的影响。
1 材料与方法
1.1 材料与试剂人肺支气管上皮细胞(HBE)从ATCC 获得。RPMI 1640 培养基、雌二醇及雌激素受体拮抗剂ICI182780(Sigma⁃Aldrich 公司);Lipo⁃fectamine STAT3®3000 试剂盒(Thermo Fisher Sci⁃entific 公司);Trizol 试剂盒(Invitrogen 公司);Prime⁃ScriptTM RT 试剂盒(TaKaRa 公司);MTT 试剂盒及所有抗体(Abcom公司)。所有引物及miR⁃21 mimic、miR⁃21 inhibitor(上海生物工程有限公司)。
1.2 试验方法
1.2.1 香烟烟雾提取物(CSE)的制备将未过滤的香烟燃烧后产生的香烟烟雾抽进10 mL RPMI 1640 培养基,调节培养基的pH 值至7.4,并通过0.22 μm 过滤器去除细菌和大颗粒,溶液的吸光度控制在320 nm(A320)和540 nm(A540),ΔOD(A320~ A540)0.9~ 1.2 为CSE 合格。将CSE 溶液(100%CSE)用培养基稀释成所需的浓度,1 h 内使用。
1.2.2 HBE 细胞培养及处理按照HBE 细胞说明书进行培养。取对数生长期的细胞,将细胞用10%CSE、10%CSE 和10 nmol/L 雌二醇、10%CSE和1 μmol/L 雌激素受体拮抗剂ICI182780 同时处理细胞48 h。
1.2.3 细胞转染严格按照Lipofectamine STAT3®3000 转染试剂说明书进行实验。
1.2.4 RT⁃qPCR 检测miR⁃21 及E⁃cadherin、α⁃SMA、Vimentin mRNA 水平使用PrimeScriptTMRT 试剂盒按照说明书逆转录RNA。采用2 μL cDNA,正向引物0.5 μL,反向引物0.5 μL,SYBR Green PCR Master Mix 10 μL,H2O 7 μL,总体系共20 μL,进行PCR 反应。U6 作为miR⁃21 及mRNA的内源性对照,结果采用2⁃ΔΔCq方法进行定量。引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.5 Western blot 检测SMAD 通路相关蛋白表达提取细胞总蛋白,BCA 试剂盒检测蛋白浓度。蛋白样品在8%~10%电泳90 min,然后采用湿转移法在250 mA电流下转移到PVDF膜上1 h。一抗在4 ℃下孵育过夜。用PBS 洗涤3 次后,使用HRP标记的二抗(均1∶5 000)在37 ℃下孵育45 min,并通过ECL 显色,凝胶成像系统成像分析,Image J 分析条带灰度值。
1.2.6 MTT 检测HBE 增殖活力将细胞以每孔约2 × 105个细胞的密度接种于96 孔板,分别用10%CSE、10%CSE 和50 ng/mL 雌二醇、10%CSE和1 μmol/L ICI182780 处理细胞48 h,加入20 μL MTT 溶液,于37 ℃下继续孵育4 h,加入150 μL DMSO 溶液,酶标仪检测490 nm 下的光密度(OD)值,计算细胞活力。
1.3 统计学方法本文所有数据均重复3次,使用SPSS 22.6 统计软件进行统计学分析,两组数据的比较采用t检验分析,多组间比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 雌激素促进CSE 诱导的EMTRT⁃qPCR 结果显示,CSE 显著促进HBE 细胞中α⁃SMA(2.968± 0.32)、Vimentin mRNA(2.095 ± 0.34)表达,降低E⁃cadherin mRNA(0.602 ± 0.13)表达;雌二醇处理后,与CSE 组相比,α⁃SMA(3.956 ± 0.58)、Vimentin mRNA(3.672 ± 0.78)表达进一步增加,E⁃cadherin mRNA(0.360±0.08)表达进一步降低;雌激素受体拮抗剂ICI182780 处理后,与CSE 组相比,α⁃SMA(1.712 ± 0.20)、Vimentin mRNA(1.423 ± 0.24)表达降低,E⁃cadherin mRNA(0.960±0.13)表达增加,见图1A。Western blot 结果显示,CSE 显著促进HBE细胞α⁃SMA(0.851 ± 0.07)、Vimentin 蛋白(0.883 ±0.06)表达,降低E⁃cadherin 蛋白(0.822 ± 0.12)表达;雌二醇处理后,与CSE 组相比,α⁃SMA(1.278 ±0.17)、Vimentin 蛋白(1.16 ± 0.03)表达进一步增加,E⁃cadherin 表达(0.423 ± 0.16)进一步降低;雌激素受体拮抗剂ICI182780 处理后,与CSE 组相比,α⁃SMA(0.476 ± 0.12)、Vimentin 蛋白(0.442 ±0.06)表达降低,E⁃cadherin 蛋白(1.378±0.09)表达增加,见图1B。MTT 检测显示CSE 显著降低HBE细胞活力(63.95%);雌二醇处理后,与CSE组相比,HBE 细胞活力进一步下降(45.58%);ICI182780 处理后,与CSE组相比,HBE细胞活力增加(81.63%),见图1C,说明雌激素促进CSE 诱导的EMT 和细胞活力下降。
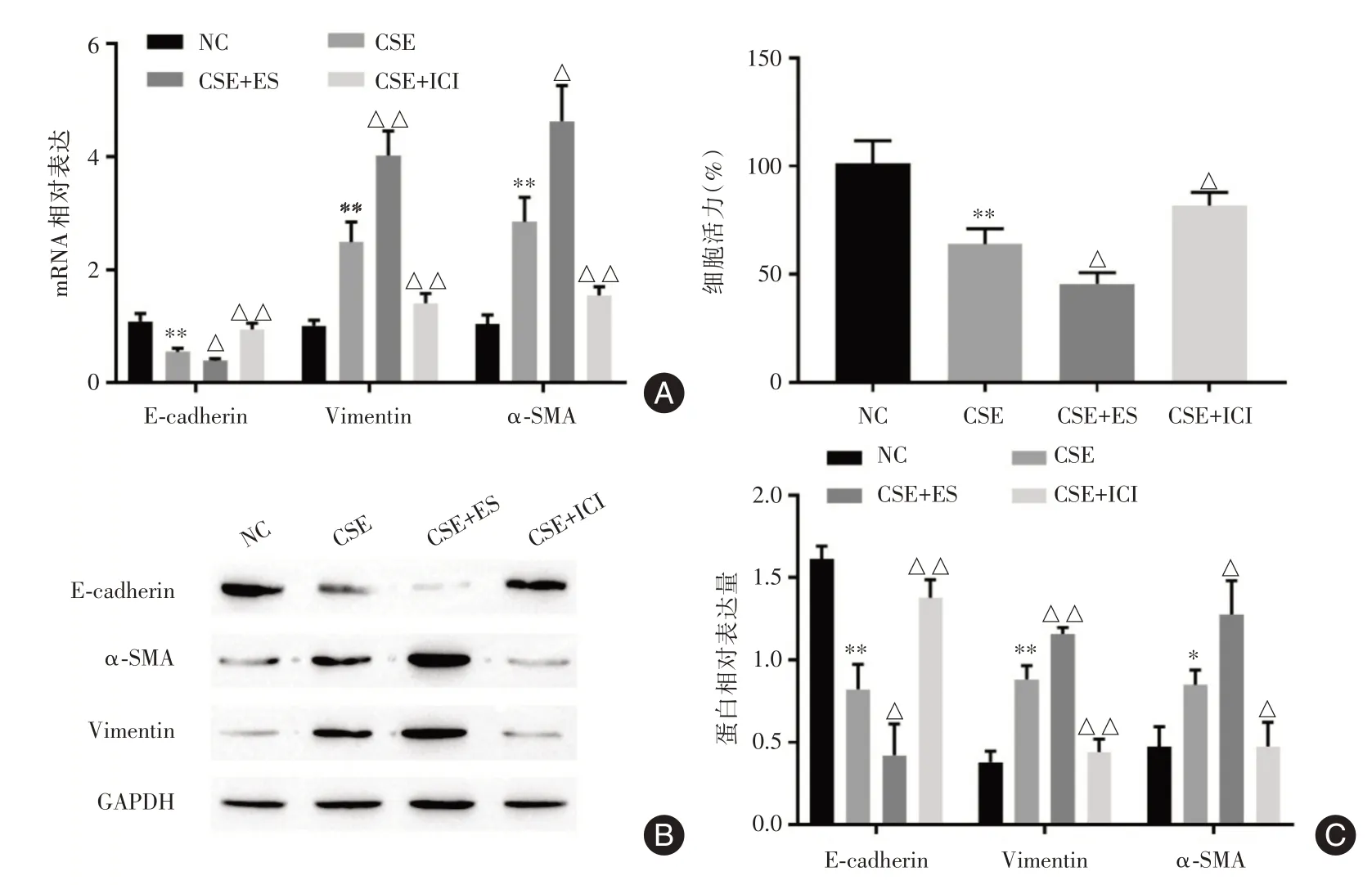
图1 雌激素促进CSE 诱导的EMTFig.1 Estrogen promotes CSE⁃induced EMT
2.2 雌激素对miR⁃21 和SMAD 通路的影响RT⁃qPCR结果显示,CSE显著上调miR⁃21的表达(2.377±0.12);与CSE 组相比,雌二醇处理组miR⁃21表达进一步上调(3.193±0.14),ICI182780处理组miR⁃21表达降低(1.277 ± 0.06),见图2A。Western blot 检测结果显示,CSE 显著上调p⁃SMAD2/SMAD2(0.804±0.09)及p⁃SMAD3/SMAD3(0.819±0.12)的表达。与CSE 组相比,雌二醇处理组p⁃SMAD2/SMAD2(1.2 ± 0.21)及p⁃SMAD3/SMAD3(1.20 ± 0.12)表达进一步上调,ICI182780 处理组p⁃SMAD2/SMAD2(0.462±0.09)及p⁃SMAD3/SMAD3(0.532±0.06)表达降低,见图2B。由此可知,雌激素可上调miR⁃21表达,并激活SMAD 通路。
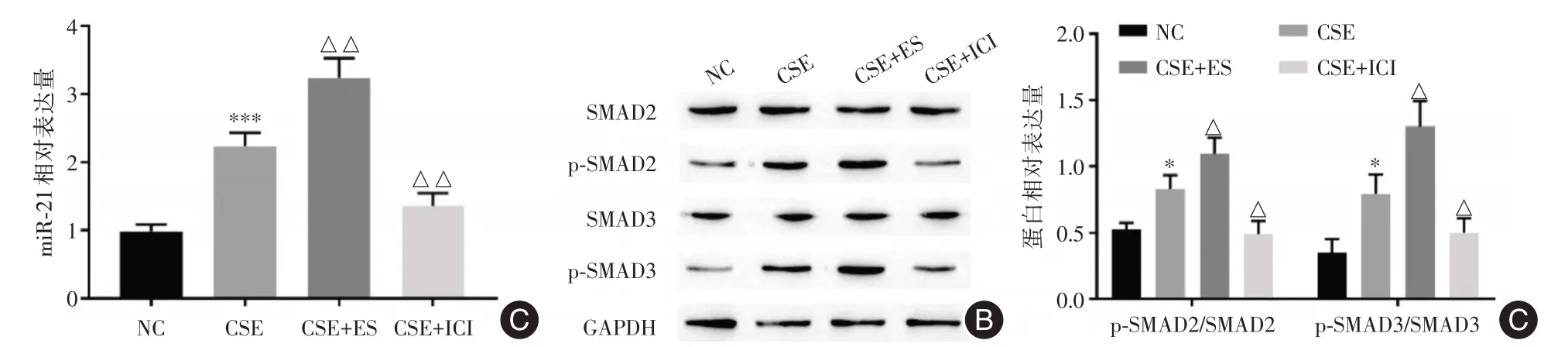
图2 雌激素对miR⁃21 和SMAD 通路的影响Fig.2 Effects of estrogen on miR⁃21 and SMAD pathway
2.3 雌激素通过miR⁃21 促进CSE 诱导的EMTRT⁃qPCR 结果显示,转染miR⁃21 mimic 后,miR⁃21表达显著增加(2.570±0.10),转染miR⁃21 inhibitor后,miR⁃21 表达显著降低(0.477 ± 0.05),见图3A。与CES+ES 组相比,CES+ES+miR⁃21 mimic 组中E⁃cadherin mRNA 表达降低(0.286 ± 0.08),α⁃SMA mRNA(4.036±0.23)、Vimentin mRNA(3.973±0.18)表达增加。而CES+ES+miR⁃21 inhi 组E⁃cadherin mRNA 表达较CES+ES 组显著增加(0.648±0.07),α⁃SMA mRNA(1.204±0.19)、Vimentin mRNA(1.978±0.53)表达较CES+ES 组显著降低,见图3B。
Western blot 结果显示,与CES+ES 组相比,CES+ES+miR⁃21 mimic 组中E⁃cadherin 蛋白表达显著降低(0.163±0.01),α⁃SMA 蛋白(1.124±0.09)、Vimentin 蛋白(1.070 ± 0.10)表达显著增加。而CES+ES+miR⁃21 inhi 组E⁃cadherin 蛋白表达较CES+ES 组显著增加(0.736 ± 0.14),α⁃SMA 蛋白(0.658±0.09)、Vimentin 蛋白(0.694±0.04)表达较CES+ES 组显著降低,见图3C。
MTT 结果显示,雌二醇抑制了HBE 细胞的增殖活力(46.79%),miR⁃21 mimic 促进了雌二醇对HBE 细胞增殖活力的抑制作用(32.69%),而miR⁃21 inhibitor 部分抑制了雌二醇对HBE 细胞增殖活力的抑制作用(59.62%)(图3D)。由此可知,雌激素可通过上调miR⁃21 的表达促进CSE 诱导的EMT和细胞活力下降。
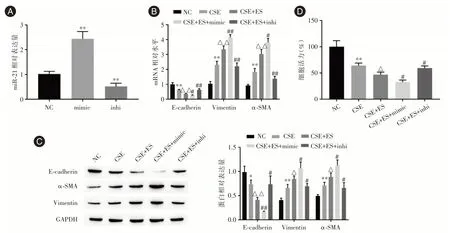
图3 激素通过miR⁃21 促进CSE 诱导的EMTFig.3 Hormones promote CSE⁃induced EMT through miR⁃21
2.4 miR⁃21对SMAD通路的影响Western blot结果显示,miR⁃21 mimic 显著促进p⁃SMAD2/SMAD2(1.251±0.07)及p⁃SMAD3/SMAD3(1.112±0.12)的表达;miR⁃21 inhibitor 显著降低p⁃SMAD2/SMAD2(0.385 ± 0.05)及p⁃SMAD3/SMAD3(0.477 ± 0.26)的表达,见图4。由此可知,过表达miR⁃21 可激活SMAD 通路,低表达miR⁃21 可抑制SMAD 通路激活。
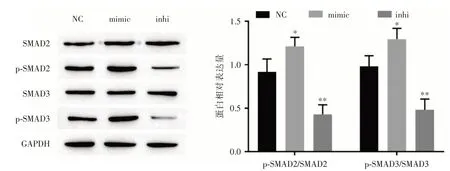
图4 miR⁃21 对SMAD 通路的影响Fig.4 The effect of miR⁃21 on SMAD pathway
2.5 雌激素通过调控SMAD 通路促进CSE 诱导的EMTWestern blot 显示,与CSE 组相比,CSE+ES 组p⁃SMAD2/SMAD2(1.335 ± 0.10)及p⁃SMAD3/SMAD3(1.374 ± 0.31)的表达显著增加。而SMAD通路抑制剂A⁃8301可部分回复雌二醇对p⁃SMAD2/SMAD2(0.973 ± 0.10)及p⁃SMAD3/SMAD3(0.975 ±0.19)表达的上调作用,见图5A。RT⁃qPCR 结果显示,经雌二醇处理后抑制E⁃cadherin mRNA 表达(0.302±0.03),上调α⁃SMA mRNA(4.368±0.63)、Vimentin mRNA(3.873 ± 0.50)的表达。A⁃8301 可部分回复雌二醇对E⁃cadherin mRNA 的抑制作用(0.393±0.31)以及对α⁃SMA mRNA(2.905±0.17)、Vimentin mRNA(2.795±0.22)的上调作用,见图5B。Western blot 检测蛋白表达,结果显示,雌二醇显著抑制E⁃cadherin 表达(0.484 ± 0.10),上调α⁃SMA(1.236±0.03)和Vimentin 蛋白(1.071±0.12)表达,A⁃8301 可部分回复雌二醇对E⁃cadherin 蛋白表达的抑制作用(0.898 ± 0.16)以及对α⁃SMA 蛋白(0.820± 0.12)和Vimentin 蛋白(0.723± 0.13)的上调作用,见图5C。MTT 检测结果显示,雌二醇抑制HBE细胞的增殖(46.54%),A⁃8301部分抑制了雌二醇对HBE 细胞增殖活力的抑制作用(59.75%),见图5D。由此可知,雌激素可通过激活SMAD 通路促进CSE 诱导的EMT 和细胞活力下降。
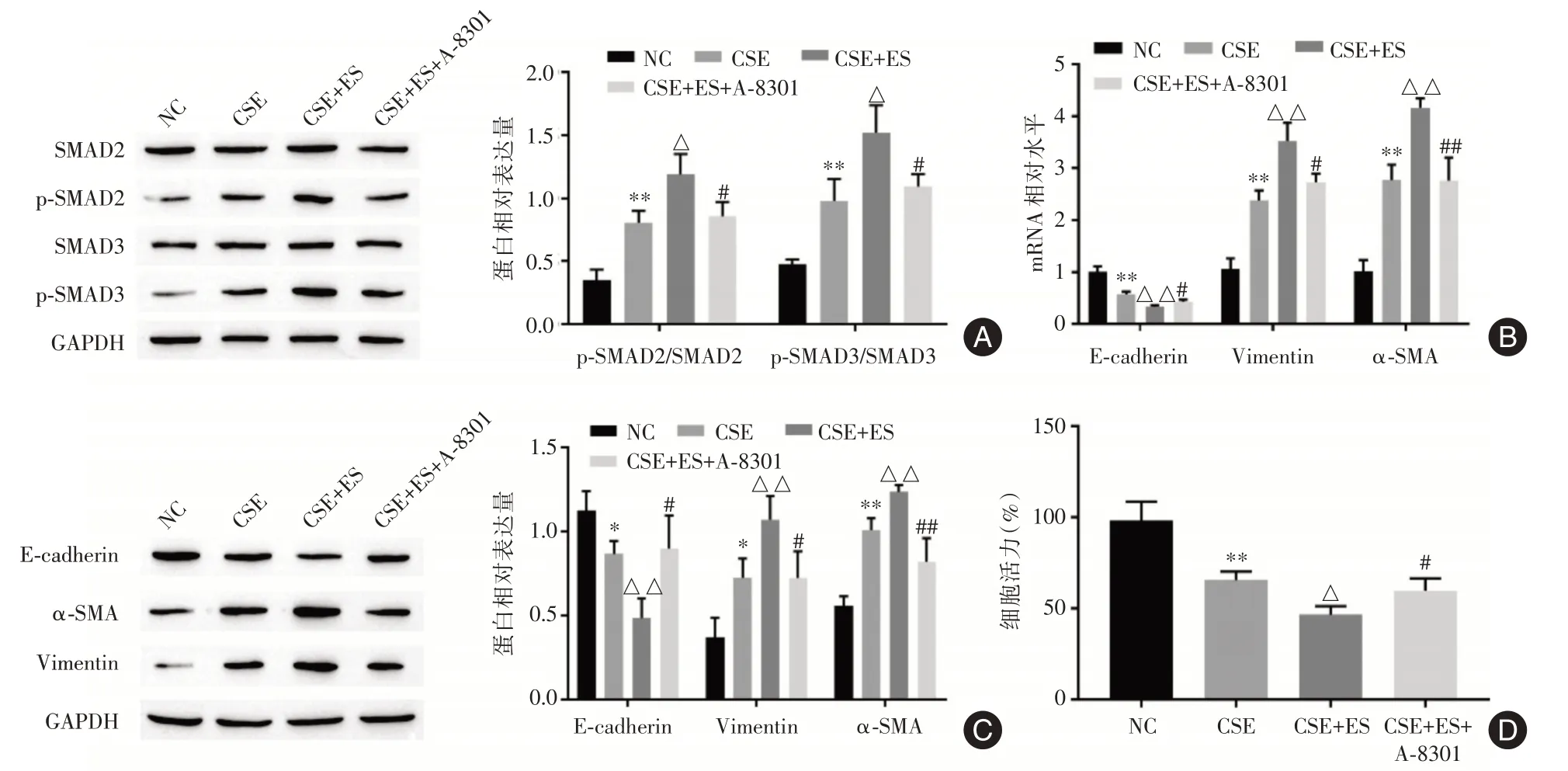
图5 雌激素通过调控SMAD 通路促进CSE 诱导的EMTFig.5 Estrogen promotes CSE⁃induced EMT by regulating SMAD pathway
3 讨论
COPD 以气道炎症、纤维化引起的持续咳嗽、咳痰、呼吸困难为典型症状[1-2],吸烟是COPD 最重要的危险因素,若气道长期暴露于香烟烟雾,会导致上皮细胞损伤、肺毛细血管系统破坏、上皮细胞衰老加速和气道重塑,肺顺应性的丧失最终导致COPD,而且肺癌的发生率会增加4~5 倍。CSE 可引起上皮细胞形态和功能的变化,上皮细胞失去细胞间粘附并获得间充质细胞特征,这一生物学过程即为EMT[14-15]。在临床研究中发现,EMT 参与了COPD 的发病[16]。
有文献报道,COPD 的发展进程与雌激素相关[7,17],17β⁃雌二醇可通过激活SMAD2/3 信号通路促进EMT的发展[18]。同时也有研究表明,雌激素信号传导和暴露可能在包括COPD在内的肺部疾病中发挥作用[6]。因此,本课题组采用CSE 处理HBE 细胞诱发EMT,随后以雌二醇与雌激素拮抗剂处理,探究雌激素对EMT 的作用。实验结果显示,CSE处理HBE 细胞后,细胞增殖活力显著降低,抑制EMT的分子标志物E⁃cadherin表达降低,而促进EMT的分子标志物α⁃SMA 及Vimentin 表达显著增加,雌二醇可促进这一结果,而雌激素拮抗剂ICI182780抑制这一结果,说明雌激素促进EMT 的发生。
miR⁃21 已被证实可增加COPD 中HBE 细胞的自噬而促进其凋亡[19],其主要依靠SMAD 信号通路来介导细胞内外的信号传导。研究表明,miR⁃21 及其下游SMAD 信号通路在EMT 过程中发挥着关键作用[9,20-21]。文献报道,呼吸道中SMAD 信号通路的激活与COPD 中EMT 和肺功能的丧失有关[21]。还有研究表明,COPD 和肺癌有许多共同的生物学机制,包括慢性炎症、基质降解、细胞增殖和抗凋亡、异常创伤修复和血管生成以及EMT。在COPD 患者肺组织中,SMAD 通路中的分子会异常表达,一些驱动EMT 的关键信号通路在肺癌中会被异常激活[10]。而且,抑制SMAD 信号通路可以减轻CSE 诱导的EMT,进而对肺癌的治疗提供一个有效方向[22-23]。本研究发现,CSE 可上调HBE细胞中miR⁃21 表达,雌二醇处理后可进一步促进miR⁃21 表达,而ICI182780 可抑制CSE 诱导的miR⁃21 上调,过表达miR⁃21 可激活SMDA 信号通路,进而抑制HBE 细胞增殖,促进HBE 细胞发生EMT。
综上所述,本研究通过体外实验证实了雌二醇可通过上调miR⁃21 激活SMDA 信号通路,进而抑制HBE 细胞增殖,促进HBE 细胞发生EMT,促进COPD 的发展进程;探索了雌激素影响下miR⁃21 调控SMDA 信号通路促进COPD 发展进展的生物学机制。这一结论表明雌激素能在肺部疾病中发挥相关作用,为雌激素在CSE 诱导EMT 中的分子机制提供了一个新的视角。
但是,雌激素及其差异信号在男性和女性的肺中都存在,且在不同个体的正常生理过程中的表现作用也存在差异。而本研究仅通过细胞培养实验探索了雌激素对香烟烟雾诱导的上皮间质转化的影响,并未考虑患者的性别、年龄、患病程度的差异、雌激素调节剂量以及雌激素作用于个体带来的整体作用等多重影响因素,也未考虑雌激素在COPD 发展过程中是否会与某些分子靶向药物的使用形成协同/拮抗作用,是否会对患者造成二次伤害等。因此,下一步需深入研究雌激素在动物体内CSE 诱导EMT 过程中的作用效果、分子机制及其调控因素。
