miR⁃26b⁃5p通过靶向NFE2L3调控结直肠癌细胞生长、迁移和侵袭
2022-02-22黄波李慧雯常诚
黄波 李慧雯 常诚
1广州市红十字会医院普外科(广州510220);2广州市妇女儿童医疗中心消化内科(广州510623)
结直肠癌(colorectal cancer,CRC)是常见的结直肠系统恶性肿瘤之一,恶性程度排第三,死亡率排第二,全球每年新增患者约185 万例,死亡病例约88 万[1]。我国结直肠癌的发病率和死亡率近十年呈上升趋势[2]。阐明结直肠癌发生发展的分子机制,寻找临床诊断标志物及治疗靶点,具有重要意义。转录因子(NF⁃E2)相关因子3(NFE2L3,Nrf3)是NF⁃E2 家族成员,在抗氧化作用的表达调控上发挥重要作用。NFE2L3 与乳腺癌等多种恶性肿瘤相关[3-4],但其在结直肠癌中的作用及其分子调控机制目前未见明确报道。MicroRNA(miRNA)是一类长度约20~25 个核苷酸的非编码RNA,高度保守,其通过与靶向基因mRNA 的3′端非翻译区(3′ untranslational region,3′ UTR)互补,从而导致靶向基因mRNA 降解,从而抑制靶基因的翻译表达[5-6]。越来越多的证据表明,miRNA 参与了结直肠癌的发生发展过程[7-10]。前期笔者通过生物信息学分析预测发现,miR⁃26b⁃5p 在NFE2L3 mRNA 的3′ UTR 区存在一个潜在的靶向位点,提示miR⁃26b⁃5p 可能调控NFE2L3 蛋白水平,参与结直肠癌的生物新过程,相关研究未见报道。因此,本研究旨在探讨miR⁃26b⁃5p 调控NFE2L3 在结直肠癌中的作用及其具体分子机制,分析该信号轴对结直肠癌细胞生长、迁移和侵袭能力的影响。
1 材料与方法
1.1 实验材料及来源人正常肠上皮细胞(NCM460)及结直肠癌细胞系(HT29、SW620 及HCT116)购自中国科学院上海细胞库;细胞培养用胎牛血清,DMEM 培养液购自美国Gibco 公司;TRIzol、总RNA提取试剂盒,Lippofectamine2000 购自美国Invitro⁃gen 公司;RIPA 裂解液、BCA 定量试剂盒等购自中国碧云天;抗NFE2L3 和GAPDH 购自美国Sigma 公司;Transwell 小室购自美国Corning 公司;双荧光素酶报道基因试剂盒购自美国Promega 公司。miR⁃26b⁃5p 的引物、mimics 由上海生工合成。NFE2L3质粒构建:通过PCR 调取NFE2L3 的全长编码区。回收PCR 扩增产物,酶切连接到pEGFP⁃C1 质粒中,通过测序确定连接成功。
1.2 细胞培养和转染细胞系在10%胎牛血清和1%青链霉素混合的DMEM培养基中,37 ℃,5%CO2的培养箱中培养。通过转染试剂盒对结直肠癌细胞系进行转染,将miR⁃26b⁃5p 对照或者mimic 片段,或与NFE2L3 过表达质粒混合以共转染。转染24 h 后观察荧光,确认转染效率。转染方法按照Lipofectamine 2000 的说明书进行。
1.3 RT⁃qPCR 检测细胞的总RNA 经由Trizol 法提取,与液氮中保存。使用逆转录试剂盒进行逆转录反应合成互补脱氧核糖核酸(cDNA),然后加入SYBR green进行PCR扩增。引物信息如下:miR⁃26b⁃5p上下游引物:5′⁃GGGGTTCAAGTAATTCAGG⁃3′和5′⁃CAGTGCGTGTCGTGGAGT⁃3′;NFE2L3 的上下游引物:5′⁃CTGACTGGGAAGGCAGAAAAG⁃3′和5′⁃TCAGGCTGTGATGAAAGCAA⁃3′;U6 的上下游引物分别为:5′⁃TGCGGGTGCTCGCTTCGGCAGC⁃3′和5′⁃CCAGTGCAGGGTCCGAGGT⁃3′;Actin 的上下游引物分别为:5′⁃CCAACCGCGAGAAGAT⁃3′和5′⁃CCAGAGGCGTACAGGG⁃3′。
1.4 Western blot 实验各组细胞经RIPA 裂解液裂解变性后采用BCA 法进行蛋白定量,然后取上清进行蛋白上样。按照Western blotting 实验的常规步骤进行上样、电泳、转膜、封闭、孵育一抗二抗、显影曝光。X 光片经扫描后采用ImageJ 进行条带灰度的分析,以目的条带与内参GAPDH 的灰度比值表示NFE2L3 的相对含量。
1.5 CCK⁃8 实验按1∶10 的比例在基础培养基中加入CCK⁃8,配置成工作液,而后对处理后细胞进行换液,1~ 4 h 后测定A450 的值,记为day 0 的初始值。分别于转染后day 1,day 2 和day 3 进行收样并测定A450 的值,绘制细胞生长曲线,观察细胞增殖情况。
1.6 Transwell 实验细胞进行转染处理24 h 后,通过胰酶消化进行无血清培养基重悬,调整细胞密度,取细胞悬液200 μL,加在Transwell 小室的上层,小室下层加入500 μL 含10%胎牛血清的完全培养基,而后置于孵箱继续培养48 h 后取出小室,PBS 清洗后擦去上室残留细胞,4%多聚甲醛固定,然后用结晶紫染色,随机取5 个视野,进行染色细胞计数。对于侵袭实验,Transwell 上室预先铺设matrigel 基质胶。
1.7 双荧光素酶报道基因实验取对数生长期的细胞接种于96 孔板中,通过脂质体转染试剂盒,将Renilla 荧光素酶报道基因和miR⁃26b⁃5p mimic片段进行共转染。继续培养48 h 后,检测海参荧光素酶的发光强度与萤火虫荧光素酶发光强度。
1.8 克隆形成实验细胞胰酶消化后接种5 000个细胞到6 孔培养板中,于培养箱中培养2 周。镜下观察出现肉眼可见的细胞克隆时,终止培养,弃去培养液清洗后用4%多聚甲醇固定15 min,然后进行结晶紫染色。镜下拍照并计数相对克隆形成数量。
1.9 流式细胞术各组细胞转染后,经0.25%的胰酶消化,然后转至1.5 mL EP管离心(4 ℃、1 000 r/min、5 min)收集细胞,加入结合缓冲液悬浮细胞,然后加入5 μL Annexin Ⅴ⁃FITC 和5 μL PI,15 min 后用BD⁃FACSCalibur 进行流式细胞术分析。
1.10 统计学方法所有实验数据录入GraphPad Prism 9.0.0 进行统计分析。所有实验均重复3 次,计量资料采用均数±标准差表示。两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 miR⁃26b⁃5p 和NEF2L3 在结直肠癌细胞系中的表达培养了人正常肠上皮细胞(NCM460)及结直肠癌细胞系(HT29、SW620 及HCT116),并通过qRT⁃PCR 检测了miR⁃26b⁃5p 的水平。结果如图1A所示,miR⁃26b⁃5p的表达水平在结直肠癌细胞系中中显著低于正常肠上皮细胞(均P<0.05)。同样进行了NEF2L3 在上述细胞系的检测,qRT⁃PCR 的结果显示(图1B),NEF2L3 的mRNA 水平在结直肠癌细胞系的水平均高于正常肠上皮细胞(均P<0.05)。而western blotting 的结果显示(图1C),NEF2L3 的蛋白水平也存在同样的趋势,在癌细胞系中显著上调,统计结果见图1D(均P< 0.05)。这些结果表明,miR⁃26b⁃5p 在结直肠癌细胞系中下调,而NEF2L3 的mRNA 和蛋白水平则上调。
进一步构建了NEF2L3表达质粒,并在HT29细胞中过表达。CCK⁃8 的结果表明,过表达NEF2L3可显著促进癌细胞生长(图1E);Transwell 实验表明,过表达NEF2L3 可显著促进癌细胞迁移和侵袭(图1F)。
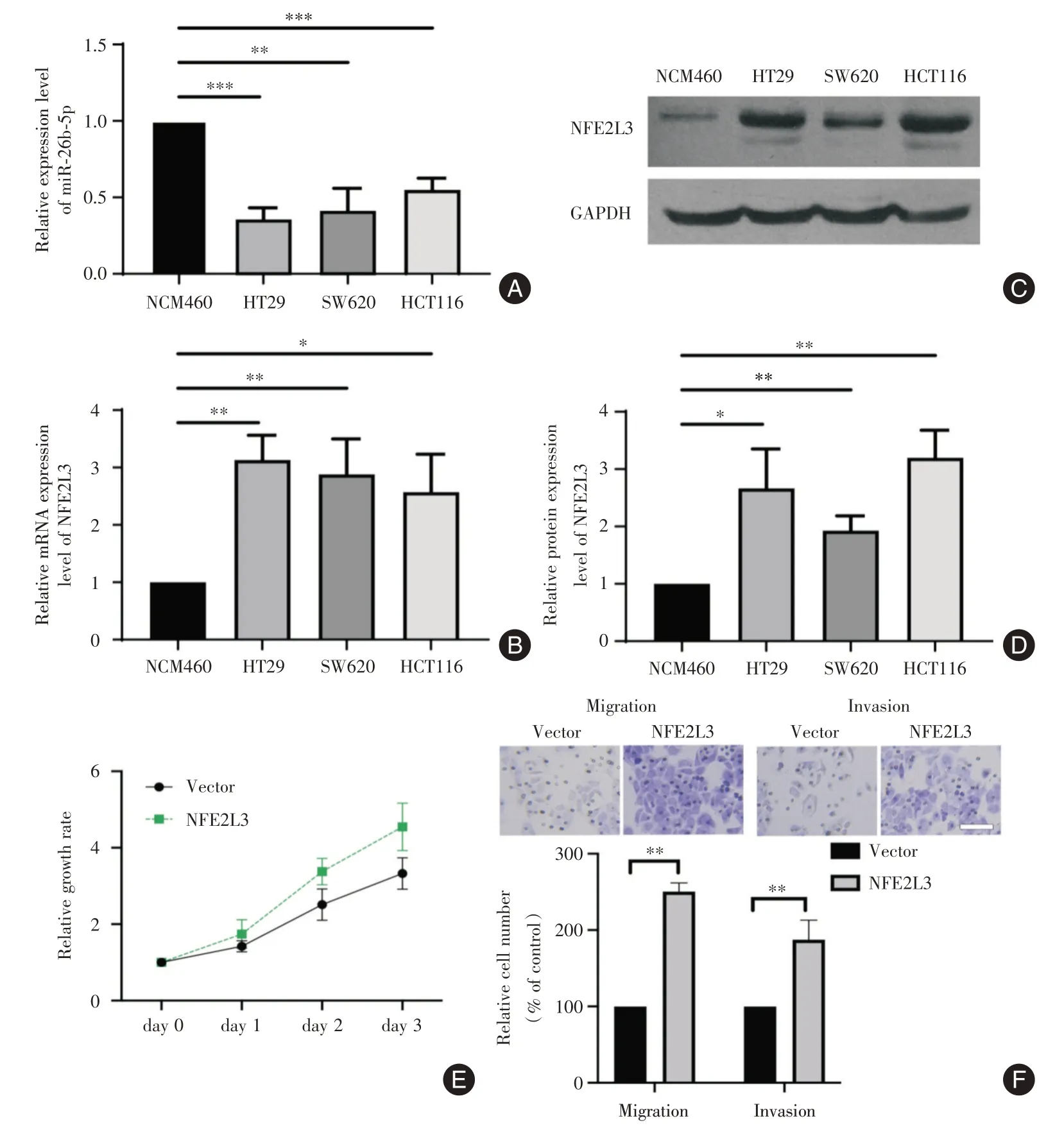
图1 miR⁃26b⁃5p 和NEF2L3 在结直肠癌细胞系中的表达水平Fig.1 Expression levels of miR⁃26b⁃5p and NEF2L3 in colorectal cell lines
2.2 miR⁃26b⁃5p 靶向调控NEF2L3前面的结果提示miR⁃26b⁃5p 和NEF2L3 的表达水平在结直肠癌细胞系中呈现反向关系,而miRNA及其下游底物大多数为负向调控,提示miR⁃26b⁃5p 和NEF2L3 存在靶向关系。通过TargetScan在线数据库进行生物信息学分析,发现NEF2L3 的3′UTR 区域上确实存在能与miR⁃26b⁃5p 匹配的序列(图2A),而且该序列在人、大鼠和小鼠的NEF2L3 的3′ UTR 区域上均保守。为此,笔者合成了miR⁃26b⁃5p 的mimic 片段,并构建了含NEF2L3 3′UTR 靶向序列的荧光素酶报道基因质粒。见图2B,荧光素酶报道基因的实验结果显示,过表达miR⁃26b⁃5p 的mimic 片段可以显著抑制NEF2L3 的野生型(NEF2L3 WT)信号(P< 0.05),但对其突变质粒(NEF2L3 MUT)则无效。RT⁃qPCR 的结果表明,过表达mimic 可显著抑制NEF2L3 mRNA水平(图2C);而Western blot 的结果表明,过表达mimic 可显著抑制NEF2L3 的蛋白水平(图2D)。这些结果提示,miR⁃26b⁃5p 可直接靶向调控NEF2L3。

图2 双荧光素酶报道基因实验验证NEF2L3 作为miR⁃26b⁃5p 的靶基因。Fig.2 The dual luciferase reporter gene experiment verified NEF2L3 as the target gene of miR⁃26b⁃5p
2.3 miR⁃26b⁃5p/NEF2L3 信号调控结直肠癌细胞增殖和克隆形成选取两株结直肠癌细胞系HT29和SW620进行功能研究。在两株细胞系中转染了miR⁃26b⁃5p 及其对照片段、共转了NEF2L3 过表达质粒及对照进行拮抗实验。Western blot 的结果验证了各组对NEF2L3 蛋白的影响(图3A⁃B)。CCK⁃8 实验表明过表达miR⁃26b⁃5p 可抑制结两株直肠癌细胞的生长(图3C⁃D,均P< 0.05),而共表达NEF2L3 则可抵消miR⁃26b⁃5p 的抑制作用,细胞生长恢复到正常水平(均P< 0.05)。同样的克隆形成实验结果表明,miR⁃26b⁃5p 可抑制结直肠癌细胞克隆的形成,而共表达NEF2L3 则可抵消miR⁃26b⁃5p 的抑制作用,癌细胞克隆形成能力恢复(均P<0.05,图3E⁃F)。

图3 共转染NEF2L3 和miR⁃26b⁃5p 对结直肠癌细胞生长和细胞克隆形成能力的影响Fig.3 The effect of co⁃transfection of NEF2L3 and miR⁃26b⁃5p on the growth and cloning formation of colorectal cancer cells
2.4 miR⁃26b⁃5p/NEF2L3 信号调控结直肠癌细胞凋亡通过流式细胞术观察miR⁃26b⁃5p/NEF2L3信号对结直肠癌细胞凋亡的影响。见图4A,过表达miR⁃26b⁃5p mimic 显著促进HT29 及SW620 细胞的凋亡,而过表达NEF2L3 可显著削弱其引起细胞凋亡的作用(均P<0.05,图4B)。

图4 共转染NEF2L3 和miR⁃26b⁃5p 对结直肠癌细胞凋亡能力的影响Fig.4 The effect of co⁃transfection of NEF2L3 and miR⁃26b⁃5p on the apoptosis of colorectal cancer cells
2.5 miR⁃26b⁃5p/NEF2L3 信号调控结直肠癌细胞增迁移和侵袭见图5A,miR⁃26b⁃5p 可显著抑制HT29 及SW620 细胞的迁移能力,NEF2L3 可显著减弱miR⁃26b⁃5p 的抑制作用,使癌细胞迁移能力恢复(均P< 0.05,图5A)。同样的,对于结直肠癌细胞的侵袭能力,miR⁃26b⁃5p 及NEF2L3 存在相同的调控趋势(均P< 0.05,图5B)。结合前面的结果,表明miR⁃26b⁃5p 可通过靶向调控NEF2L3,影响结直肠癌细胞的生长、克隆形成、细胞迁移和侵袭。

图5 共转染NEF2L3 和miR⁃26b⁃5p 对结直肠癌细胞迁移和侵袭能力的影响Fig.5 The effect of co⁃transfection of NEF2L3 and miR⁃26b⁃5p on the migration and invasion of colorectal cancer cells
3 讨论
miRNAs 具有广泛的基因调节功能,参与肿瘤发生发展的多个环节,扮演着重要角色[6,11-13]。研究表明,miRNA 的表达调节失衡与结直肠癌的发生和转移及恶性表型密切相关[14-15]。
肿瘤组织和外周血中存在miR⁃26 的异常表达,且在多种类型的实体瘤组织中可以检测到miR⁃26a/b 的低表达。通过miRNA 表达谱和qPCR测定,JI 等[16]测量了455 个肝癌组织中miR⁃26a/b的表达,发现miR⁃26a/b 在肝细胞癌(HCC)组织中的表达显著低于邻近正常组织,肝癌组织中miR⁃26a/b 低表达的患者总生存期较短,但对干扰素α(IFN⁃α)治疗反应较好。且IFN⁃α 治疗可提高miR⁃26 低表达的HCC 患者后的总生存率[17]。此外,miR⁃26 家族在食管癌组织中的低表达[18],并且miR⁃26a 的低表达与食管腺癌的发生和转移密切相关[19]。在胃癌组织中也可检测到miR⁃26a 水平降低,与miR⁃26a 高表达患者相比,miR⁃26a低表达患者的中位OS时间和无复发生存时间(RFS)更短[20]。ZHANG等[21]报道,乳腺癌组织中miR⁃26a的表达明显低于肿瘤邻近的正常组织,这与患者的年龄和肿瘤组织中HER2的表达有关。miR⁃26b 的低表达与乳腺癌患者较短的无远处转移生存期和总生存期相关[22]。miR⁃26 在某些肿瘤里面高表达。比如KIM 等[23]报道,胶质母细胞瘤组织中miR⁃26a 的表达增加,且miR⁃26a 高表达的患者生存时间缩短。miR⁃26a⁃2 在脂肪肉瘤肿瘤组织中也高表达,miR⁃26a⁃2 的高表达与脂肪肉瘤患者的预后呈负相关[24]。LAUREN等[25]报道miR⁃26a在结直肠癌样本中低表达,且miR⁃26a通过调节PTEN参与结直肠癌的发生发展。我们的研究表明,miR⁃26b⁃5p 在结直肠癌细胞系中低表达,进一步的功能实验表明miR⁃26b⁃5p 能够通过下游靶基因调控结直肠癌细胞系的生长、增殖、凋亡、迁移和侵袭,与以往研究结论一致。我们及前人的研究结果表明,miR⁃26b⁃5p 在恶性肿瘤中的作用具有异质性,在肝癌、食管癌、乳腺癌、胶质瘤、肉瘤及结直肠癌中发挥不同作用。
NEF2L3 在多种恶性肿瘤样本中呈高表达,如淋巴瘤,乳腺癌、大肠癌,胰腺癌等,在肿瘤发生发展等生物学进程中起着关键作用。但是,对于NFE2L3 到底是抑癌基因还是促癌基因,不同肿瘤环境下有着不同发现。NEF2L3 对于淋巴肿瘤起着保护作用,为抑癌基因。在肝癌中,NEF2L3 高表达,抑制NEF2L3 可以抑制肝癌细胞增殖,诱导癌细胞凋亡,其机制可能通过Wnt/β⁃catenin 通路发挥作用[26]。在胰腺癌中NEF2L3 高表达,与患者TNM呈正相关,且高表达患者生存期更短,该结果提示NEF2L3 在胰腺癌中为促癌基因。BURY 等[27]发现NEF2L3 在大肠癌患者的样本中显著上调,而且小分子干扰抑制NEF2L3 可抑制大肠癌细胞的生长,增殖和迁移侵袭,其机制可能是通过DUX4/CDK1 复合物发挥作用。CHOWDHURY 等[28]则发现NEF2L3 在大肠癌中有着多重调控机制,正常生理状态下,NEF2L3 可通过HRD1/VCP 复合物标记而被泛素化降解,NEF2L3 通过与sMaf 结合促进UHMK1 的表达,从而促进癌细胞的生长。而在结直肠中,NFE2L3 高表达的患者预后差,生存率低,抑制NFE2L3 可通过CCND1 和pRb1⁃ser807/811。可诱导细胞周期停驻[29]。而实验结果表明,NFE2L3在结直肠癌中上调,其促进癌细胞生长,是癌基因;NFE2L3 受miR⁃26b⁃5p 的调控。因此,NFE2L3 同样存在肿瘤异质性,可能与其上下游不同的机制有关,值得深入探索。
综上所述,miR⁃26b⁃5p 可通过靶向抑制癌基因NEF2L3 的表达抑制肿瘤细胞的生长、迁移和侵袭,从而参与结直肠癌的发生、发展。miR⁃26b⁃5p作为一种抑癌基因NEF2L3 作为致癌基因,可能成为结直肠癌治疗的潜在新靶点。
