一例猪流行性腹泻的综合诊断与防治
2022-02-22林淑玲杨玉栋马海营沈叶盛孟凡亮
林淑玲,杨玉栋,马海营,沈叶盛,赵 君†*,孟凡亮*
(1.山东省栖霞市农业农村局,山东 栖霞 265300;2.山东农业大学动物科技学院/山东省动物生物工程与疾病防治重点实验/山东省畜禽疫病防制工程技术研究中心,山东 泰安)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(PED virus,PEDV)引起的以感染猪呕吐、腹泻为主要临床特征的高度传染性肠道疾病,各年龄段猪均易感,尤其对仔猪危害最大。1973年,上海农科院兽医研究所从发生腹泻病猪中分离到一株病毒,经鉴定确认为猪流行性腹泻病毒。该病自 2010年发生较大变异,对我国养猪业造成巨大的经济损失。
PEDV属于尼多病毒目(idovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)的一种单链 RNA 病毒[1]。该病毒粒子呈多边形,大部分为球型,直径 95~100 nm,由于具有包裹病毒的囊膜结构,因此对有机溶剂敏感,对热相对不敏感[2]。病毒全长28kb左右,编码4个结构蛋白(S、E、M、N)、16个非结构蛋白(NSP1-NSP16)及由ORF3编码的辅助蛋白[3]。其中结构蛋白 S是病毒表面蛋白,与病毒的入侵、体外复制的适应性有关,有报道近几年流行毒株中 S基因出现多处插入与缺失,呈现遗传多样性,因此S基因常用于PEDV遗传进化研究,作为研究其分子生物学特征的主要检测对象[4]。
2021年2月,山东省泰安市某猪场仔猪出现腹泻、呕吐症状,仔猪大批死亡。笔者实地考察后,剖检病死猪,采集病料,经 PCR、病理组织学观察,扩增其 S基因进行遗传进化分析,最终确诊该病例为PEDV感染导致的猪流行性腹泻。针对临床症状采取相应的治疗措施,效果良好。本试验为研究PEDV遗传进化规律提供了一定的理论依据,对目前PEDV的防控具有重要意义。
1 材料与方法
1.1 材料
1.1.1 发病猪粪便 2021年2月,山东省泰安市某规模化猪场 9日龄仔猪出现腹泻、呕吐症状2 d,表现该症状后的猪仔死亡率近 45 %。剖检送检猪只发现小肠趋于透明,内含有大量黄色液体,为PED的典型症状,疑似PEDV感染。采集发病猪的粪便样品,共8份,置于青霉素瓶中冻存送检。
1.1.2 主要试剂与材料 核酸提取试剂盒(Easypure Viral DNA/RNA Kit)、克隆试剂盒(pEASY-T1 Simlie)均购自北京全式金生物技术有限公司;胶回收试剂盒(Biospin Gel Extraction Kit )购自杭州博日科技有限公司;琼脂糖粉购自 Sigma 公司;Taq 酶(VazymeHiScript II One Step RT-PCR Kit、DL 2 000 DNAMarker)购自诺威赞(南京)有限公司,其他化学试剂均为分析纯产品。
1.2 方法
1.2.1 临床剖检与病理组织学观察 对病死猪进行病理剖检,观察记录病死猪各脏器组织病变。取肠道样品,4%福尔马林固定,按照常规方式制作石蜡切片,经 HE染色后镜检观察组织病理学变化。
1.2.2 粪便样品处理 每份粪便加入 5倍体积的PBS缓冲液稀释,5 000 r/min 4 ℃ 离心10 min,吸取上清液用于提取 RNA或接种细胞。待 Vero细胞单层密度达 80 % 后,取适量的粪便处理液,经 0.22 μm滤器过滤除菌,DMEM 1:1稀释粪便处理液,然后接种细胞,同时加入适量胰酶,培养3 d后,反复冻融3次后,过滤取1 ml接种下一瓶细胞,如此连续盲传 5代,然后吸取第五代细胞上清液进行PEDV病原检测。
1.2.3 PEDV的PCR检测与遗传进化分析 按照核酸提取试剂盒提取细胞上清 RNA,反转录成cDNA。针对PEDV的S基因设计特异性引物:上游引物;TTCTGAGTCACGAACAGCCA,下游引物:CATATGCAGCCTGCTCTGAA,引物由上海生工合成,使用时稀释为 10 μM。按照VazymeHiScript II One Step RT-PCR Kit(Dye Plus)试剂盒说明书反转录,反应程序为:逆转录,50 ℃ 30 min;预变性,94 ℃ 3 min;变性,94 ℃ 30 s;退火,53 ℃ 30 s;延伸,72 ℃1 min;35个循环;总延伸,72 ℃ 7 min。琼脂糖凝胶电泳 40 min,观察 651 bp处有无特异性条带。将阳性特异性条带进行切胶回收,纯化后,连接 pMD18-T载体构建重组质粒,随后转入大肠杆菌,筛选阳性菌落后,提取质粒,送上海生工测序。测序结果通过 MEGA6软件中的Maximum Likehood tree方法进行该分离菌株的遗传进化分析。
2 结果与分析
2.1 临床剖检结果
患病猪精神沉郁,由于脱水导致形体消瘦,排黄色稀便。剖检病死猪可见肠壁变薄透明,如图 1所示,并在肠腔内聚集大量黄色液体,肠系膜血管充血,且肠系膜淋巴结水肿,肠道乳糜管减少,疑似PEDV感染。

图1 临床剖检症状
2.2 病理组织学观察
组织学病变包括急性弥漫性严重的萎缩性肠炎,盲肠和结肠皮下水肿及浅层上皮细胞轻度空泡化。肠上皮细胞空泡化或大量细胞脱落。萎缩的绒毛发生融合并由退行性或再生的扁平上皮覆盖,在固有层中存在炎性细胞浸润,见图2。
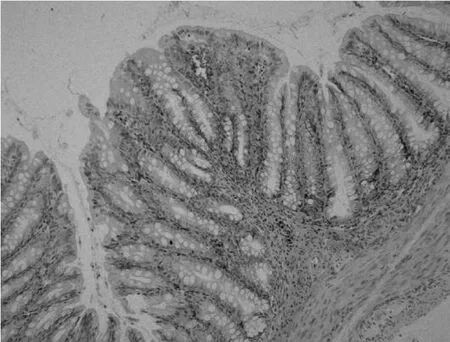
图2 肠道病理组织学观察结肠绒毛萎缩变性,充血出血
2.3 PCR检测结果
提取盲传5代后的细胞上清中的RNA,以反转录后的cDNA为模板,以F:TTCTGAGTCAC GAACAGCCA,R:CATATGCAGCCTGCTCTG AA为引物,进行PCR扩增,琼脂糖凝胶电泳,结果如图3所示,采集的8份样品中,有3份为PEDV阳性,阳性率为37.5 %。

图3 临床样品中PEDV的PCR检测结果
2.4 分离毒株TA2020的S基因遗传进化分析
将阳性特异性条带进行切胶回收,连接转化后筛选阳性菌,提取质粒,送上海生工测序。测序结果显示,三份样品 S基因同源性 99.5 % 为同一毒株。通过MEGA6软件中的Maximum Likehood tree方法进行该分离毒株的遗传进化分析。从GeneBank中选取不同年份的8株PEDV序列进行比对,结果发现分离株TA2020属于GII群。
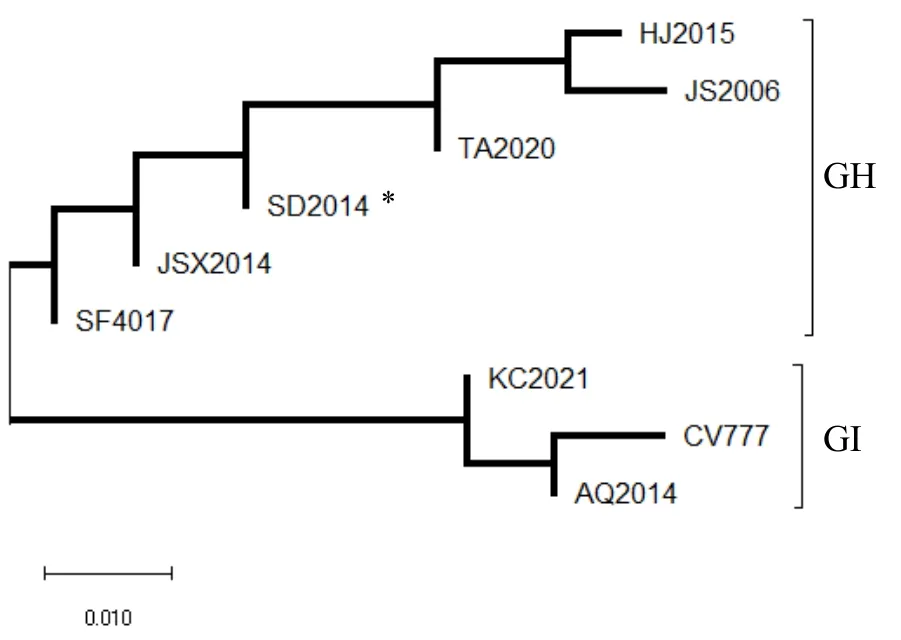
图4 分离株TA2020遗传进化分析(*为分离株)
3 讨论
PEDV于1997年在比利时首次被分离并划分为冠状病毒,20世纪80~90年代该病毒在日本、韩国流行。2005~2008年在意大利、泰国等国时有发生,2010年在我国暴发PED。每一次的暴发流行,都会给当地的养猪产业造成巨大经济损失[5]。本次猪场虽然接种了CV777灭活苗,但仍然检测到 PEDV,这说明类似的疫苗保护性较差。在本研究中,被感染猪为 9日龄哺乳仔猪,患病后死亡率接近95 %,病猪精神沉郁排黄色稀便。剖检病死猪可见肠壁变薄透明,在肠腔内聚集大量黄色液体,并且胃内有乳凝块,肠系膜血管充血,且肠系膜淋巴结水肿,肠道乳糜管减少。病理组织学观察发现,盲肠和结肠皮下水肿及浅层上皮细胞轻度空泡化,这与该病毒的致病机制相关。
此外,取病料检测到PEDV感染,且阳性率为37.5 %,扩增其S基因,并进行序列比对发现其与 SD2014株 S基因同源性 96.67 %,据报道,SD2014株是属于 GII群(突变群),但是此猪场之前免疫的经典毒株CV777属于GI群(经典群),故而分析这可能是导致免疫效果不理想的原因[6]。这一点提示,不同猪场应该根据实际情况,有选择地接种市面上的其他有关 GII群的疫苗株。
此病例提示,在平时要做好预防策略,做好安全措施,加强防御工作,加强保温,定期消毒[7]。养猪户要对猪舍进行大范围的消毒杀菌工作,在猪舍的周围撒上生石灰,防止猪流行性腹泻导致的腹泻的大范围传播,避免对其他的养猪场产生不利影响[8]。有病猪出现时,应立刻病猪注射疫苗、血清或干扰素等,阻止该病毒的蔓延。同时对症治疗,在水中加入口服补盐液以防止脱水,当病猪出现肠道痉挛的现象,用阿托品等来缓解治疗,给病猪服用次硝酸铋、木炭等药物可以止泻;可在病猪的饮水中添加氟苯尼考、丁胺卡那霉素、可以防止病猪肠道进一步感染[9]。
本研究对该猪场暴发的流行性腹泻进行了较为系统的诊断,并提出防控措施,可为该病的诊断和防控提供一定帮助。
