分泌型蛋白DKK1在宫颈癌中的表达及其临床意义
2022-02-22杨晴晴王皓梵蒋冬媛田庆丰封全灵
杨晴晴,段 畅,王皓梵,蒋冬媛, 田庆丰,封全灵
宫颈癌(cervical cancer,CC)是女性生殖系统中最常见的恶性肿瘤之一,其发病率和病死率在各大肿瘤中排名第四[1]。在大多数情况下,人乳头状瘤病毒(HPV)的高危亚型是该病的病因,这种病基本上是可以预防的。大约90%的宫颈癌发生在低收入和中等收入国家,这些国家缺乏有组织的筛查和HPV疫苗接种计划[2]。近年来,宫颈癌的发病朝着年轻化方向发展,除了高危的HPV感染因素外,遗传因素和免疫因素也在宫颈癌的发生发展过程中起着重要作用。Wnt家族是进化上高度保守的蛋白质家族,Wnt信号参与了胚胎发育和维持正常成人体内平衡的许多基本过程[3]。这种信号通路的功能障碍可能会导致人类出生缺陷、神经退行性变、骨骼缺陷以及各种癌症,包括胃肠道肿瘤、乳腺癌、上皮性恶性肿瘤等的发生[4-7]。Dickkopf-1(DKK1)是一种分泌型Wnt拮抗剂,在人体组织中参与组织的形成、再生和修复过程[8]。分泌型DKK1被认为通过与LRP6共受体结合来抑制典型Wnt信号传导,阻止激活信号复合物的形成,从而导致胞浆β-catenin降解和核β-catenin依赖基因转录的降低[9]。DKK1表达的失调与多种癌症的转移有关,DKK1表达水平升高与多发性骨髓瘤,前列腺癌和肝细胞癌的不良预后相关[10]。然而,在肾细胞癌和结直肠癌中,DKK1表达水平下调,充当抑癌基因[11-12]。目前,有关DKK1与宫颈癌的关系研究较少。该研究采用RT-PCR技术和免疫组化方法来探讨DKK1在宫颈癌中的表达及其在宫颈癌中的临床意义。
1 材料与方法
1.1 一般资料收集2018年1月—2020年4月在郑州大学第三附属医院手术治疗后经病理证实为宫颈癌的标本30例,所有患者均收集宫颈癌组织和对应的癌旁织,对应癌旁组织距离癌组织均1 cm以上。患者平均年龄26~68(45.0±5.5)岁,以上患者术前均未接受放化疗,标本收集后存放在-80 ℃冰箱中保存,所有患者在获得样本前均获得知情同意。然后,在郑州大学第三附属医院病理中心收集了2015年9月—2018年9月手术治疗后的60例石蜡包埋的宫颈癌样本,以30例因子宫良性病变行子宫全切的患者标本作为对照。根据WHO分级对肿瘤的组织学类型和等级进行分类,根据国际妇产科联合会(FIGO)标准确定肿瘤分期。
1.2 方法
1.2.1RNA提取和实时定量逆转录酶聚合酶链反应(qRT-PCR) 使用TRIzol试剂(美国Invitrogen公司)从临床组织中提取总RNA,根据制造商的说明,使用RT-for-PCR试剂盒(日本Takara公司)将1 μg RNA转化为cDNA(反应系统10 μl)。将2 μl cDNA与SYBR Green混合后,使用CFX96TMReal-Time系统(Bio-Rad)进行定量实时qPCR(RT-qPCR)(反应系统20 μl):95 ℃、5 min,95 ℃、30 s,56 ℃、30 s,72 ℃、30 s,40个循环。GAPDH的上游引物:5′-CAGGGCTGCTTTTAACTCTG-3′,下游引物:5′-CTGTTGTCGGAGTTCTAGTAG-3′;DKK1的上游引物:5′-TATCACACCAAAGGACAAG-3′,下游引物:5′-TGATGGTGATCTTTCTGTAT-3′;GAPDH用作内部对照,使用2-△△Ct法计算基因相对表达,独立重复实验3次。
1.2.2免疫组化法 通过免疫组化分析检测60例宫颈癌组织,30例正常组织。将5 μm厚的石蜡包埋切片在60 ℃下烘烤1 h,用二甲苯脱石蜡,再水化,用EDTA缓冲液高压处理进行抗原修复,再用PBS冲洗3遍,非特异性抗体用0.5%小牛血清白蛋白来封闭15 min,加一定稀释度的一抗 50 μl(1 ∶500),阴性对照用PBS,用已验证的阳性切片为阳性对照,放4 ℃冰箱中孵育过夜。生物素标记羊抗兔IgG 50 μl滴加在每张切片上,每张切片上滴加50 μl链霉亲和素-过氧化物酶溶液,Tris缓冲液震洗3次,5 min/次。在显微镜下,用0.04% DAB-H2O2显色5~20 min。用苏木精复染细胞核,用乙醇分化 ,梯度乙醇脱水,二甲苯透明,中性树胶封片观察。 请2名病理科医师,采用双盲法观察免疫组化染色后的组织并评分。阳性细胞判断标准:根据胞浆染色情况和阳性细胞数来判定蛋白的表达水平。先按染色强度打分:无色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分;再按阳性细胞百分比打分:阳性细胞数≤10%为0分,10%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;染色强度分数×阳性细胞百分比分数≥2为阳性,染色强度分数×阳性细胞百分比分数<2分为阴性。
2 结果
2.1 检测30例冰冻宫颈癌组织中DKK1的表达量qRT-PCR 结果显示,CC组中DKK1 mRNA的表达量小于癌旁对照组中DKK1 mRNA的表达量,差异有统计学意义(t=4.019,P<0.05)。见图1。
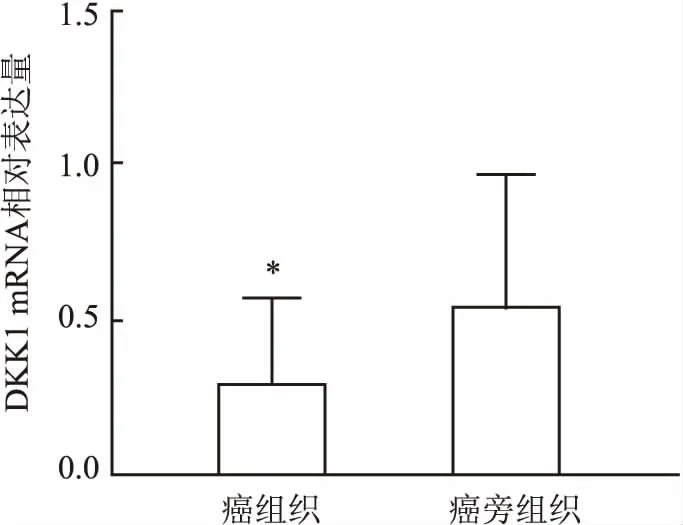
图1 DKK1 mRNA在癌组织和癌旁组织中的表达量与癌旁组织比较:*P<0.05
2.2 CC组和对照组临床病理特征60例CC组患者和30例对照组临床病理特征见表1,根据临床病例报告显示,CC组和对照组在年龄、初潮年龄、绝经状态、妊娠次数、分娩次数和癌症家族史等方面差异无统计学意义。但是,与对照组相比,DKK1在CC组的表达低于对照组,差异有统计学意义(P=0.032),见图2、表2。
表1 CC组和对照组的部分临床特征
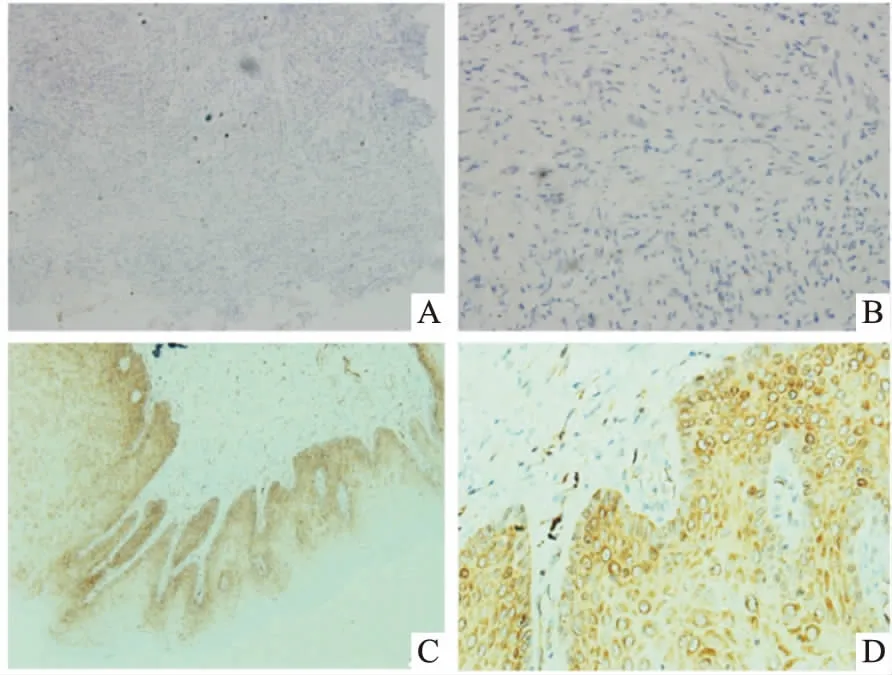
图2 DKK1蛋白在CC组织和正常宫颈组织中的表达A:DKK1在CC组织中低表达 ×100;B:DKK1在CC组织中低表达 ×400;C:DKK1在正常宫颈组织中高表达 ×100;D:DKK1在正常宫颈组织中高表达 ×400
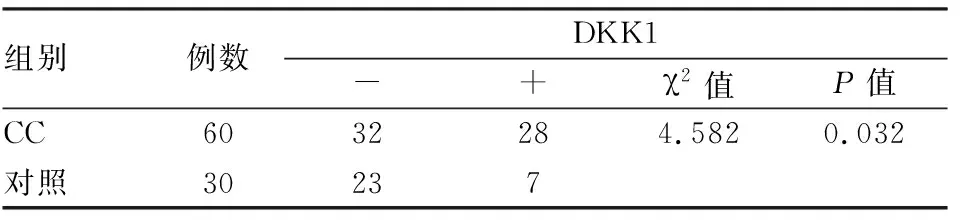
表2 DKK1在宫颈癌组织和正常宫颈组织中的表达(n)
2.3 DKK1表达与宫颈癌组织的临床病理特征的关系χ2检验显示(表3),DKK1蛋白表达与年龄、肿瘤大小、HPV感染和组织学类型无关(P>0.05)。在宫颈癌早期中的表达高于晚期(P=0.031),无盆腔淋巴结转移组高于有淋巴结转移组(P=0.017),浸润深度浅肌层组高于深肌层组(P=0.009),高分化组的表达高于低分化组(P=0.022)。此外,斯皮尔曼相关分析显示,DKK1表达与与患者年龄(ρ=-0.129,P=0.324)、肿瘤大小(ρ=-0.158,P=0.228)、HPV有无感染(ρ=0.184,P=0.159)以及组织病理类型(ρ=-0.094,P=0.473)无明显相关。DKK1低表达与临床病理分期(ρ=-0.279,P=0.031)、组织分化程度(ρ=-0.295,P=0.022)、有无淋巴结转移(ρ=-0.307,P=0.017)及浸润深度(ρ=-0.339,P=0.008)密切相关,相关性为负相关,这些结果表明DKK1低表达可能在宫颈癌的发生发展中起到重要作用。
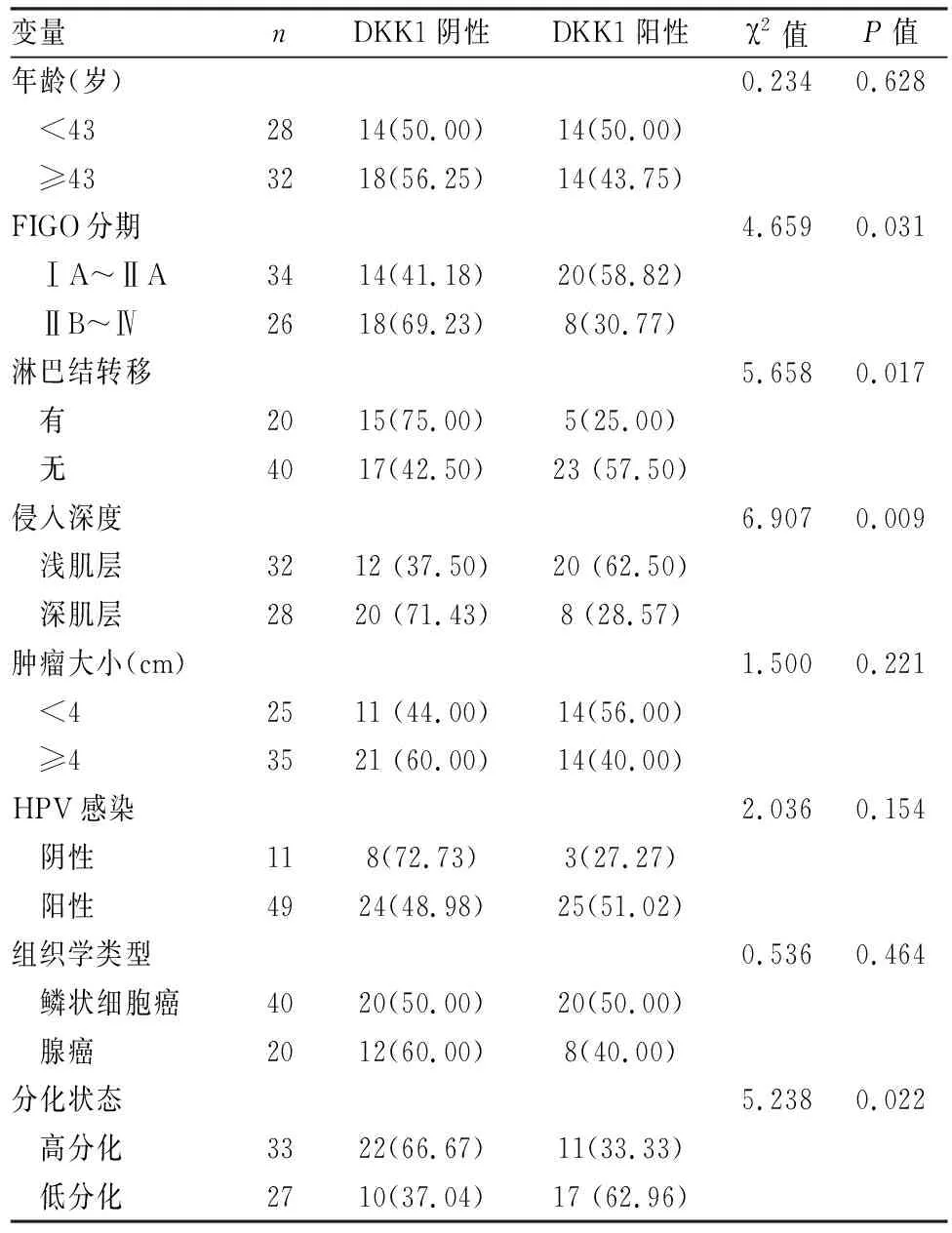
表3 DKK1表达与宫颈癌组织的临床病理特征的关系[n(%)]
3 讨论
在女性癌症患者中,宫颈癌排名第四,尽管宫颈癌的发病率和病死率呈下降趋势,但它仍然是威胁女性生命健康的重要“杀手”。目前,宫颈癌的主要治疗方法是手术、化疗、放疗和联合治疗等,但对于晚期转移患者治疗效果并不理想。宫颈癌的发展是一个多基因、多步骤的癌变过程,涉及癌基因、抑癌基因的失活及基因调控的失衡等[13]。最近研究证实Wnt信号通路在肿瘤的转移和免疫监视中具有重要意义,Wnt通路通常分为β-连环蛋白依赖(典型)和独立(非典型)信号通路。DKK1是DKK蛋白家族的一部分,属于分泌型Wnt糖蛋白,这种分泌蛋白具有高度保守的半胱氨酸结构域,它能抑制Wnt/ β-连环蛋白信号转导,Wnt配体通过与Frizzled受体和低密度脂蛋白受体相关蛋白-5/6(LRP5/6)结合激活Wnt信号通路,导致β-catenin的核移位,而DKK1与LRP5/6竞争性结合,阻止Wnt-Frizzled-LRP5/6复合物的形成,从而阻断Wnt信号通路,引起蛋白酶体β-catenin降解、诱导凋亡和阻止细胞增殖[14]。
DKK1的功能在不同类型的癌症中有所不同。一些研究者认为DKK1是一种抑制肿瘤细胞增殖和转移的抑癌基因,如DKK1在肾细胞癌和结直肠癌中下调,在肺癌患者血清中也显著降低,治疗后能迅速恢复正常水平[11]。然而,一些研究认为DKK1的高表达是独立有害的因子,如DKK1在肝细胞癌和骨髓瘤中作为癌基因过度表达,在乳腺癌细胞中还参与骨转移[15]。在众多癌症研究的基础上,该研究采用RT-PCR技术和免疫组化法检测DKK1在宫颈癌组织中的表达。结果显示在转录水平上,DKK1在宫颈癌组织中的mRNA表达量低于癌旁正常组织,在蛋白质水平上,免疫组化显示DKK1在宫颈癌组织中低表达,由此分析在正常宫颈发展为宫颈癌的过程中,DKK1下调可能促进其发生,具有肿瘤启动子的特性。另外,DKK1作为Wnt信号通路中的核心成员,它的表达与肿瘤生长分化和向远处转移密切相关,这一过程常涉及癌细胞失去上皮特征而获得间质特性,血管生成和上皮间质转化及淋巴扩散均受Wnt信号传导的调控[16]。该研究对免疫组化的结果进行临床分析显示宫颈癌中DKK1的表达水平在临床病理分期越高、有淋巴结转移、侵入深肌层和低分化状态中减少,由此可见DKK1下调可能与宫颈癌的恶性发展相关,是促进宫颈癌进一步恶化的重要因子。
从HPV感染到宫颈癌的发生是一个相对缓慢的过程,多数HPV感染是“一过性”的,并不引致宫颈病变,高危型HPV的持续感染是宫颈癌的主要病因。高危型HPV感染中,约70%与HPV16型和HPV18型相关,高危型HPV产物E6蛋白结合抑癌基因p53,通过刺激泛素化介导p53蛋白降解。同样,高危型HPV产物E7蛋白抑制pRb抑癌蛋白活性,导致细胞恶性增殖[17]。根据免疫组化结果,该研究采用斯皮尔曼相关分析DKK1表达与宫颈癌组织的临床病理特征的关系,结果并未显示DKK1的表达与患者年龄、肿瘤大小、HPV有无感染以及组织病理类型明显相关。
综上所述,在宫颈癌中,DKK1是抑制肿瘤细胞增殖和迁移的抑癌基因,可能作为抑制性配体拮抗Wnt信号转导。DKK1在宫颈癌组织中表达的临床意义需要大样本数据,本次免疫组化的样本量不足够,存在局限性。另外,该实验未涉及DKK1在宫颈癌中的发生发展机制研究,还需进一步深入探讨。
