脂联素对脓毒症小鼠心肌损伤的保护作用及其机制
2022-02-22刘鲁倩秦叙青何文君单莉娅李新芝马克涛
刘鲁倩,陈 玲,秦叙青,3,何文君,杨 瑞,3,单莉娅,3,李新芝,马克涛,3
脓毒症是危害人类健康的一大疾病,尽管抗感染的水平有了很大的提高,但是脓毒症病死率依然居高不下[1-2]。其中,脓毒症心肌损伤是脓毒症及多器官功能衰竭的重要表现,其发病率较高,预后较差,涉及多种信号分子机制,如细胞凋亡、钙离子转运障碍等。脂多糖(lipopolysaccharide,LPS)是一种内毒素,由革兰阴性细菌产生,可以引起炎症和心肌细胞凋亡。因此,抑制LPS引起的心肌损伤可能会成为脓毒症治疗的突破口。脂联素(adiponectin,APN)是一种细胞因子,由脂肪细胞合成和分泌,大约占血浆总蛋白的0.01%[3]。APN具有抗炎,抗动脉粥样硬化的作用[4],对心脑血管疾病的发生发展亦起着调控作用[5]。但是APN对LPS诱导的小鼠脓毒症心肌损伤的保护作用以及可能的机制,目前尚不明确。该研究旨在通过LPS诱导小鼠脓毒症心肌损伤,探讨APN是否有保护作用及其可能的机制。
1 材料与方法
1.1 实验动物与模型制备选取体质量控制在(25±5)g的健康雄性C57BL/6J小鼠30只,该小鼠购买于北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京)2016-0006。将所有的C57BL/6J小鼠置于石河子大学动物实验饲养中心,并按照石河子大学动物实验伦理委员会的要求进行整个实验。所有小鼠在适宜温度下饲养,湿度和光线良好。所有的小鼠适应性喂养1周后,将30只小鼠随机分为3组,10只/组,分为假手术组(sham组)、脓毒症心肌损伤组(LPS组)、脂联素干预组(LPS+APN组)。参考前期文献[6]的方法每只小鼠腹腔注射10 mg/kg的革兰阴性细菌LPS以制备脓毒症心肌损伤模型,同时sham组予以等量的0.9%氯化钠溶液进行腹腔注射,LPS+APN组于注射LPS前12 h给予腹腔注射6 mg/kg[7]的脂联素,12 h后小鼠处死,并进行实验检测。
1.2 主要试剂APN(美国PeproTech公司);脂多糖(美国sigma公司);凋亡相关蛋白如兔抗Bax抗体(货号ab199677)、兔抗Bcl2抗体(货号ab196495)、兔抗Caspase3抗体(货号ab13847)以及兔抗连接蛋白43(Cx43)抗体(货号ab11370)均购于美国Abcam公司;小鼠抗β-actin抗体、小鼠抗GAPDH抗体、辣根过氧化物酶标记的山羊抗兔IgG和辣根过氧化物酶标记的山羊抗小鼠IgG均购于北京中衫金桥生物技术有限公司。
1.3 实验方法
1.3.1心肌HE染色 将每组心肌组织置于10%甲醛中过夜,然后脱水并包埋在石蜡中。将所有心肌组织切成5 μm厚的切片,固定在载玻片上并烘烤干燥,然后染色。根据使用说明书,将切片分别浸入二甲苯、浓度梯度的乙醇和苏木精中,并用中性树胶密封。使用光学显微镜观察心肌细胞、心脏基质和肌丝的形态。
1.3.2Western blot法检测各组凋亡蛋白Bax、Caspase-3、Bcl-2以及Cx43的表达 各组造模结束后,迅速取出小鼠心肌组织,用研磨机将心肌组织打碎,加入裂解液在冰上裂解至少20 min,每隔10 min摇匀一下,4 ℃离心组织并用BCA法测蛋白浓度并配平,待蛋白冷却后分装储存。用SDS-PAGE分离,电泳结束后将蛋白转移至PVDF膜上电转,电转结束后,用TBST洗去多余的电转液,并用50 g/L脱脂牛奶室温封闭2 h,封闭结束后,加入以下抗体4 ℃过夜:兔抗Bax抗体(1 ∶1 000)、兔抗Bcl-2抗体(1 ∶1 000)、兔抗Caspase3抗体(1 ∶1 000)、兔抗Cx43抗体(1 ∶1 000)、小鼠抗β-actin抗体(1 ∶1 000)和小鼠抗GAPDH抗体(1 ∶1 000)。次日,用TBST洗膜3次,10 min/次,加入辣根过氧化物酶标记的山羊抗兔IgG(1 ∶5 000)和辣根过氧化物酶标记的山羊抗小鼠IgG(1 ∶10 000)室温孵育2 h,用TBST洗去二抗,于暗室中滴加发光试剂,压片、显影、定影,使用Quantity One软件(Bio-Rad公司)获取图像并分析。
1.3.3免疫组织化学染色 将心肌组织切片在60 ℃的烤箱中烘烤2 h,分别用二甲苯脱蜡3次,5 min/次,100%、90%、80%、70%乙醇脱水,5 min/次,自来水冲洗干净,枸橼酸钠修复并用3%的过氧化氢抑制内源性过氧化酶活性,用山羊血清37 ℃封闭1 h,随后,加入相应的一抗(Bax,1 ∶100;Bcl-2,1 ∶100;Caspase3,1 ∶100;Cx43,1 ∶100)4 ℃过夜,次日,洗净一抗后加入二抗,37 ℃孵育1 h,加入DAB显色,待标本抗体标记的阳性部位显色后,立即用自来水冲洗掉,接着,用苏木精复染3 min,自来水洗3次,1%盐酸酒精分化6~7 s,自来水冲洗3次,然后自来水蓝化3 min,并在70%、80%、90%、100%乙醇脱水,烘干后中性树胶封片。随机选择6个样本/组,并在每个样本中随机选择5个视野,然后在光学显微镜下拍照。
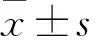
2 结果
2.1 各组心肌组织病理学观察sham组心肌纤维排列整齐且胞质丰富均匀,细胞间隙正常,边界清晰,无病理变化;LPS组可见多数炎性细胞浸润,且伴有心肌细胞坏死情况;LPS+APN组心肌细胞坏死情况改善,心肌纤维数量增多,心肌损伤情况降低,炎性细胞浸润减少。见图1。
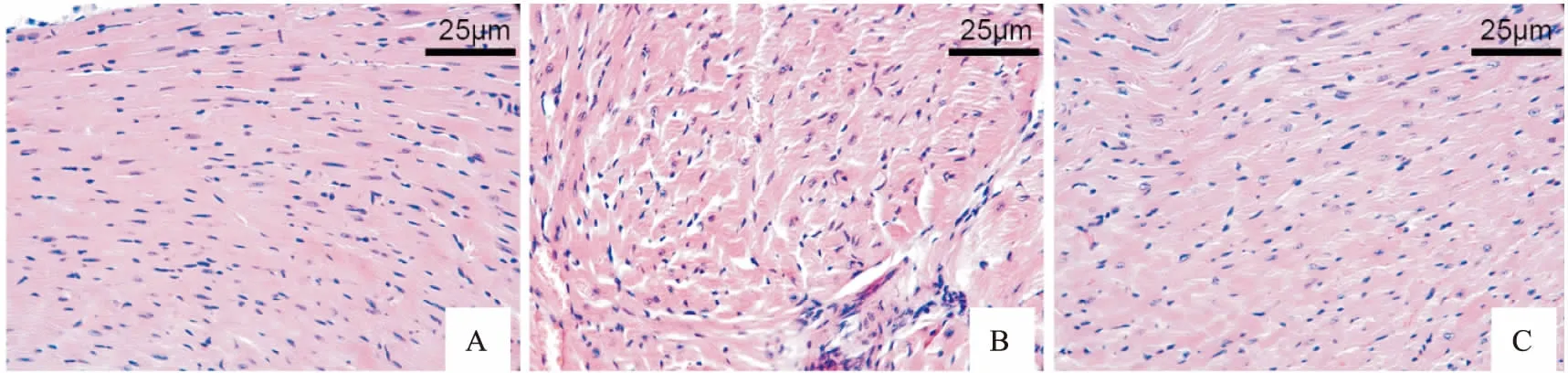
图1 各组小鼠心肌组织的HE ×400A:sham组;B:LPS组;C:LPS+APN组
2.2 各组凋亡蛋白指标Caspase3、Bcl-2、Bax表达通过Western blot检测sham、LPS、LPS+APN组各指标蛋白相对表达量。与sham组比,LPS组促凋亡蛋白cleaved caspase3、Bax表达增高,然而抗凋亡蛋白Bcl-2表达低于sham组,LPS+APN组cleaved caspase3、Bax蛋白表达低于LPS组,Bcl-2蛋白表达高于LPS组(P<0.05)。同时进行免疫组织化学染色检测各组心肌组织Caspase、Bcl-2、Bax蛋白表达,Caspase3及Bax的表达情况:sham组中偶见棕黄色颗粒,LPS组的表达明显高于sham组,LPS+APN中棕黄色颗粒明显降低。Bcl-2的表达情况:
sham组中可见棕黄色颗粒表达,LPS组的表达明显低于sham组,LPS+APN中棕黄色颗粒表达明显升高,差异有统计学意义(P<0.05),见图2、3。

图2 Western blot法检测各组小鼠心肌组织中凋亡蛋白A:Western blot法检测心肌组织内凋亡蛋白cleaved caspase-3、Bax、Bcl-2蛋白表达;B:心肌组织内凋亡蛋白cleaved caspase-3蛋白水平的半定量分析;C:心肌组织内凋亡蛋白Bcl-2蛋白水平的半定量分析;D: 心肌组织内凋亡蛋白Bax蛋白水平的半定量分析;1:sham组;2:LPS组;3:LPS+APN组;与sham组比较:**P<0.01;与 LPS组比较:#P<0.05,##P<0.01
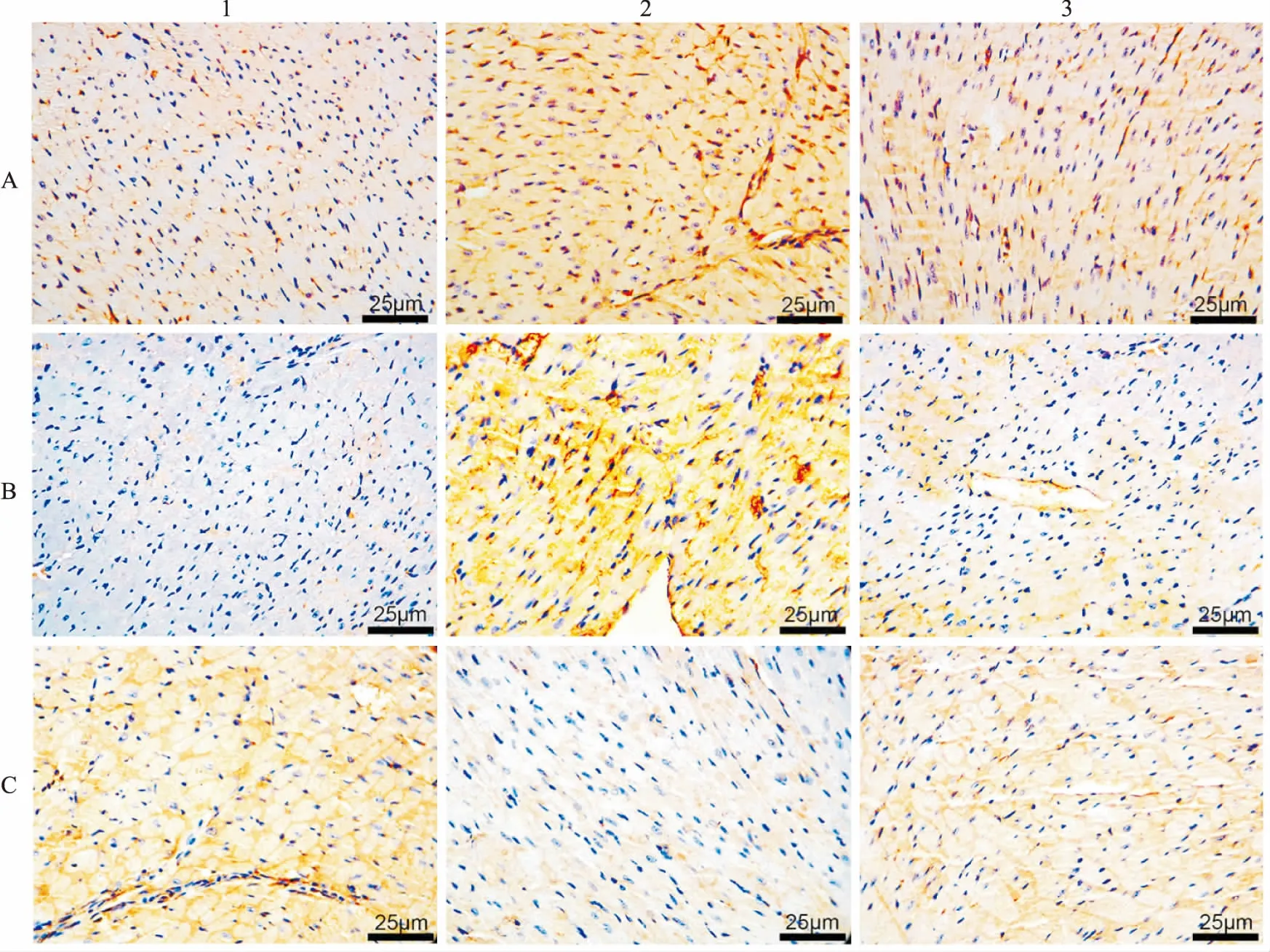
图3 免疫组织化学染色检测心肌组织中Caspase3、 Bax、Bcl2蛋白表达 ×400A:心肌组织内凋亡蛋白Caspase3蛋白表达;B:心肌组织内凋亡蛋白Bax蛋白表达;C: 心肌组织内凋亡蛋白Bcl-2蛋白表达;1:sham组;2:LPS组;3:LPS+APN组
2.3 各组Cx43的表达通过Western blot检测sham组、LPS组、LPS+APN组Cx43相对表达量。与sham组比较,LPS组Cx43的表达增高,然而LPS+APN组Cx43的表达低于LPS组(P<0.05)。免疫组织化学染色检测各组心肌组织中Cx43的表达:sham组中可见棕黄色颗粒,LPS组的表达高于sham组,LPS+APN中棕黄色颗粒明显降低,差异有统计学意义(P<0.05)。见图4、5。

图4 Western blot法检测各组小鼠心肌组织中Cx43 A:Western blot法检测心肌组织Cx43的表达;B:心肌组织内Cx43水平的半定量分析;1:sham组;2:LPS组;3:LPS+APN组;与sham组比较:*P<0.05;与LPS组比较:#P<0.05
图5 免疫组织化学染色检测心肌组织中Cx43的表达 ×400A:sham组;B:LPS组;C:LPS+APN组
3 讨论
临床上,脓毒症具有起病快、发病急、病死率高等特点,发生脓毒症时,炎症、氧化应激、线粒体损伤、微循环障碍、免疫紊乱、自噬损伤、凋亡等病理机制使全身各种组织和器官损伤,最终导致多器官功能衰竭。其中,脓毒症心肌损伤是脓毒症多器官功能衰竭的一个重要环节,越来越多的研究[8]表明,因脓毒症感染性休克的患者多表现为心功能不全。因此,保护心脏功能是治疗脓毒症的一个重要环节。目前已经有研究[9]报道腹腔注射脂多糖可以诱发脓毒症且导致心脏损伤,该研究使用LPS诱导脓毒症心肌损伤,与前期的研究结果一致,实验显示,注射LPS可使小鼠诱发脓毒症,且会发生脓毒症心肌损伤,具体表现为心肌组织有多数炎性细胞浸润,且伴有心肌细胞坏死情况。APN具有多种作用,如抗炎、抗凋亡和抗动脉粥样硬化。既往的研究[10]表明APN有心脏保护作用。该研究提示,APN可保护LPS所致的脓毒症心肌损伤,APN预处理后,心肌组织中炎性细胞浸润及心肌细胞坏死情况明显缓解,心肌纤维数量增多,心肌损伤获得改善。
许多调节因子在脓毒症心肌损伤的发病机制中起着至关重要的作用[11]。细胞凋亡已被证明是心脏功能下降的主要原因之一[12]。有研究[13]表明脓毒症休克大鼠心肌细胞会发生凋亡,并证实凋亡在脓毒症诱导的儿童心肌抑制中起着更重要的作用。本研究中,也出现了类似的结果,与假手术组相比,脓毒症心肌损伤组凋亡蛋白Caspase3、Bax表达水平明显增多,抗凋亡蛋白Bcl-2表达下调,使用脂联素干预后,脓毒症心肌损伤的凋亡蛋白指标明显改变,与脓毒症心肌损伤组相比,凋亡蛋白Caspase3、Bax表达水平明显降低,抗凋亡蛋白Bcl-2表达增高。实验表明,APN可以通过调节细胞凋亡来保护脓毒症心肌损伤 。
缝隙连接是一种膜通道结构,介导细胞间的通讯,存在于两个细胞之间,具有重要的生物学功能。Cx43是最主要的缝隙连接蛋白,尤其在心室肌中,对于电传导发挥着不可或缺的作用。有学者发现在肥厚型心肌病、心力衰竭、缺血性心肌病等多种心脏病中,Cx43的分布和表达均发生改变[14]。Cx43在细胞生长、增殖和凋亡中起重要作用。林俊敏 等[15]研究证明,在心力衰竭大鼠心脏中Cx43表达明显增加,且分布紊乱。该实验显示,与假手术组相比,脓毒症心肌损伤组Cx43的蛋白表达明显增高,使用APN预处理后,Cx43的水平有所降低,提示APN可能通过调节Cx43的表达来保护脓毒症心肌损伤。
综上所述,该研究表明,APN可有效地保护脓毒症心肌损伤,其机制可能是调节细胞凋亡途径以及Cx43的表达。因此,APN为临床上治疗脓毒症心肌损伤成为了一种新的可能。
