猴头菌-人参双向固体发酵菌质口服液澄清工艺研究
2022-02-22唐敏王淑敏王欢陈长宝王恩鹏陈雪李琼
唐敏,王淑敏,王欢,陈长宝,王恩鹏,陈雪,李琼
(长春中医药大学吉林省人参科学研究院,吉林 长春 130117)
猴头菌(Hericium erinaceus)隶属担子门(Basidiomycota)伞菌纲(Agaricomycetes)红菇目(Russulales)猴头菌科(Hericiaceae)猴头菌属(Hericium)[1],作为珍贵的药食兼用菌,其富含多肽、萜类和甾醇等多种活性物质,具有保肝护胃、降血糖、保护神经、抗辐射、抗肿瘤及抗癌等功效[2-6]。猴头菇经发酵后,分泌的次级代谢产物药理活性作用更大。人参(Panax ginseng C.A.Mey.)属多年生宿根阴性草本双子叶植物,为传统的名贵中草药之一,含有多种人参皂苷、人参多糖、萜类和酚类物质,具有多种生物活性,如免疫调节、抗癌、神经保护、抗氧化和抗菌等[7-12]。人参经发酵后,其发酵产物中稀有皂苷种类及含量明显上升。发酵后的人参燥性大幅度降低,使人参的药性更加温和耐用,更易被人体吸收。
本研究主要以猴头菌与人参进行双向固体发酵,即以猴头菌为发酵菌种,人参为药性基质进行双向固体发酵的过程。通过猴头菌的生物学活性物质分解代谢人参中的纤维、蛋白质和糖类等成分为自身提供生长所需的营养及能量,同时,利用次生代谢产物对人参中的活性成分结构进行修饰改造,从而得到新的药效活性成分。与未进行发酵的猴头菌和人参相比,发酵菌质中兼具猴头菌和人参的药效活性作用,同时提高了人参中某些活性皂苷含量及猴头菌中麦角甾醇和麦角甾酮等活性物质的含量。本研究以猴头菌人参双向固体发酵菌质提取液为原材料进行口服液开发,并着重对口服液的澄清工艺进行研究。
中药提取液中成分较为复杂,既含有多种有效成分,也含有如色素、鞣质、果胶和蛋白质等影响中药提取液澄清度和稳定性的高分子物质[13]。在中药提取液加工的过程中,澄清度作为反应产品外观和稳定性的指标之一,具有十分重要的地位。目前,提高澄清度的方法有自然沉淀法、膜分离法、水提醇沉法、高速离心法和吸附剂澄清法等[14]。其中,自然沉淀法耗费时间较长且澄清效果不佳;膜分离法在中药制剂生产中易造成膜堵塞,降低膜使用寿命,造成中药中有效成分保留率降低;水提醇沉法和吸附剂澄清法应用较为广泛。据报道,在吸附剂澄清法中,壳聚糖是最常用的澄清剂之一,是世界上第二大天然可再生资源,其制备过程简单,毒性低,具有良好的生物可降解和生物相容性等特点,在果汁、中药制剂及功能性饮料等制备过程中得到了广泛的应用[15]。据此,本实验通过单因素考察及正交优化实验对猴头菌人参双向固体发酵菌质口服液的澄清工艺进行研究。
希望通过本文的研究结果,为口服液的工艺开发提供理论基础,为发酵菌质的产品开发提供思路。同时,希望以“药用真菌双向发酵工程”的新型发酵技术为桥梁,推动猴头菌和人参市场的二次开发。
1 仪器与材料
1.1 实验材料
猴头菌由吉林省生物研究所张金亭研究员赠予;人参购自吉林省怡生对外贸易有限公司;葡萄糖、无水葡萄糖、蛋白胨、磷酸二氢钾、硫酸镁、酵母粉及琼脂粉购自国药集团化学试剂有限公司;浓硫酸、正丁醇和三氯甲烷购自北京化工厂;3,5-二硝基水杨酸、壳聚糖和人参皂苷Re购自北京索莱宝科技有限公司;香草醛购自天津市光复精细化工研究所;柠檬酸、木糖醇和山梨酸钾购自南通奥凯生物技术开发有限公司。
1.2 实验仪器
YXQ-LS-50A压力蒸汽灭菌器(上海博迅实业有限公司);ZQZY-85CNS震荡培养箱(上海知楚仪器有限公司);BT25S型电子天平[赛多利斯科学仪器(北京)有限公司];A11BS025粉碎机(德国IKA);SWCJ-2FD超净工作台(苏州安泰空气技术有限公司);M200 Pro多功能酶标仪(瑞士TECAN集团公司);Centrifuge 5810 R型离心机(德国Eppendorf公司)。
2 试验方法
2.1 固体发酵菌质提取物的制备
将保存于4℃冰箱中的猴头菌菌种转接至PDA培养基,在26℃恒温黑暗条件下培养至菌丝布满培养基表面。取适量固体培养物转接至液体培养基(葡萄糖20 g、蛋白胨10 g、KH2PO4 2 g、MgSO4 7 H2O 1 g、蒸馏水1 L)中,在26℃、160 r/min的黑暗条件下进行液体摇瓶培养,当液体摇瓶中含有大量黄色菌球时,终止液体发酵,备用。将人参药材粉碎,过筛,装至固体发酵培养瓶,加入适量水,121℃高压灭菌30min,待人参基质冷却至室温后,将上述液体发酵菌种接至人参药性基质中,避光培养至猴头菌菌丝布满整个药性基质且形成明显的菌蕾结构,即得到发酵菌质。将发酵菌质于40℃条件下烘干,密封保存。
2.2 口服液的制备工艺
根据前期对发酵菌质活性物质的基础研究,结合文献中关于人参、猴头菌及其他药食两用物质的口服液制备的研究,考虑实际生产设备及生产成本等诸多方面因素影响,制定猴头菌人参口服液的制备工艺路线。研究表明,发酵菌质水提液中含有大分子蛋白质,可能在一定程度上会对口服液的澄清度及稳定性产生复合影响。口服液作为一种直接吸收的内服制剂,考虑到药效及对人体安全性的要求,本实验选择对澄清工艺进行优化。
猴头菌人参发酵菌质口服液制备工艺路线如下图所示:

图1 猴头菌-人参固体双向发酵菌质口服液工艺研究流程图Fig.1The process flow chart of ginseng solid two-way fermentation fungal substance oral liquid
2.3 样品提取液的制备
本实验采用水煎煮法进行提取,通过前期考察,影响提取效果的因素主要有料液比、提取次数和提取时间。根据本课题组前期实验结果,以料液比为8:1、提取次数为3次、提取时间为2 h为最佳提取工艺对菌质进行提取。
2.4 壳聚糖对澄清度的影响
取1.0 g壳聚糖,加入100 mL的1%体积分数乙酸溶液,并在80℃水浴中溶胀2 h,搅拌15 min直至均匀,冷藏备用。取猴头菌人参固体双向发酵菌质提取物25.0 mL,在水提液中边加边搅拌1%的壳聚糖溶液,并在室温下磁力搅拌保持15min,室温静置24h,取上清即得。
2.4.1 单因素考察以溶液中含有的人参总皂苷含量和多糖含量为评价指标,依次考察壳聚糖加入量、絮凝温度、搅拌速度对口服液澄清度的影响。各因素水平分别设置为壳聚糖加入量为4%、6%、8%、10%和12%,絮凝温度分别为30℃、40℃、50℃、60℃和70℃,搅拌速度分别为160 r/min、320 r/min、480 r/min、640 r/min和800 r/min。建立因素水平表,如表1所示,每次试验时做3组平行试验。

表1 因素水平表Table 1 The table of the factor level
2.4.2 正交实验为进一步对澄清工艺考察,结合单因素的考察结果,以人参皂苷含量和多糖含量的权重系数各为50%为评价指标,建立正交表,根据表2进行正交试验考察。
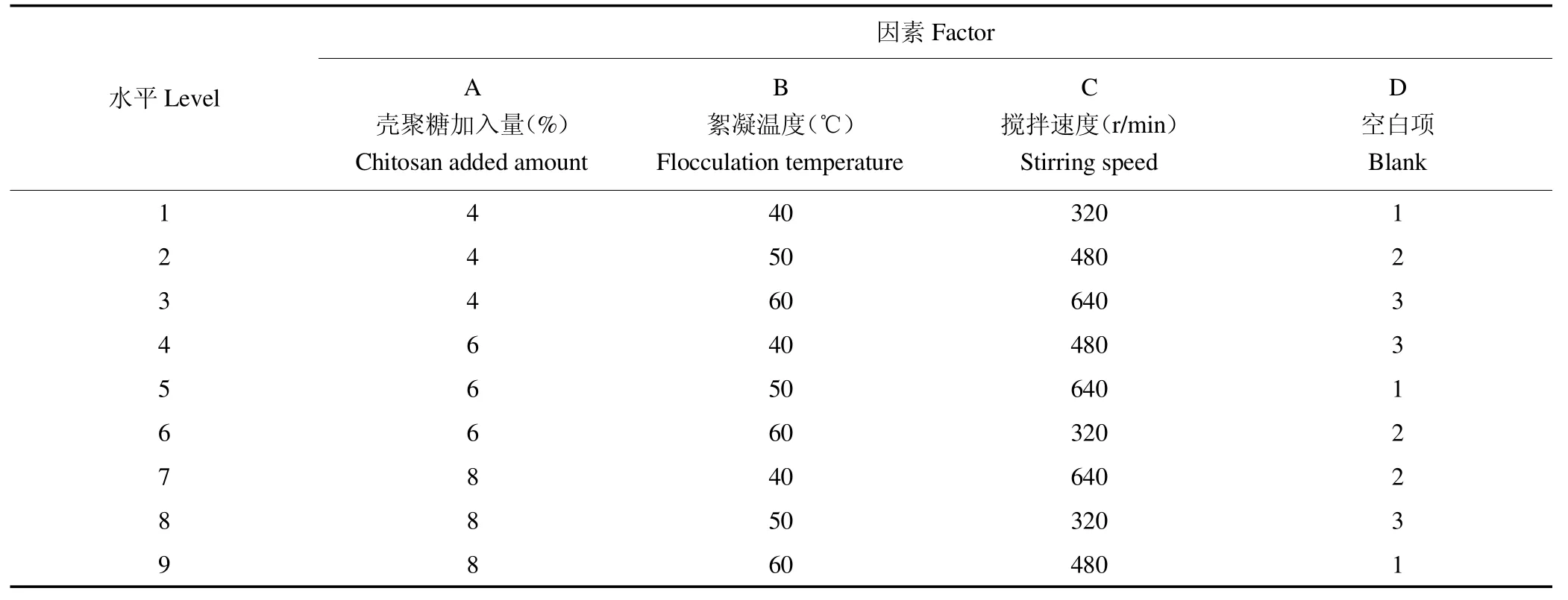
表2 正交试验设计表Table 2 Results of the orthogonal test design x
2.5 醇浓度对澄清度的影响
将猴头菌 人参双向固体发酵菌质20 g放入烧杯中,加适量蒸馏水浸泡1 h后,进行煎煮。取煎煮液静置冷却后用8层纱布滤去残渣,定容至500 mL,使25mL的提取液相当于1 g生药量。取50 mL提取液加入乙醇进行醇沉,调节醇的终浓度分别达到40%、50%、60%、70%和80%,以此对醇浓度进行考察。将搅拌均匀的醇沉液于4℃静置24 h后,6 000 r/min离心10 min,弃去下层沉淀残渣,得上清液。以加权值=人参总皂苷含量50%+多糖含量50%为评价指标,对不同醇浓度条件下的澄清工艺进行评价。
2.6 指标评价方法
2.6.1 人参总皂苷含量测定对照品溶液的制备:精密称定人参皂苷Re对照品10mg,加入甲醇,置于10mL容量瓶中,定容至刻度后摇匀,即得1 mg/mL的Re标准品溶液。
供试品溶液的制备:按GB/T 18765-2015的方法稍做改动,精确量取提取液30 mL,转入分液漏斗中,加三氯甲烷30 mL振摇萃取,弃去三氯甲烷,重复3次,继续用水饱和正丁醇30 mL振摇萃取,重复3次,合并正丁醇层液体,水浴锅蒸干,残渣用甲醇溶解后,转移至10 mL容量瓶中,用甲醇稀释至刻度,摇匀备用。
分析结果计算:以质量百分数表示的人参总皂苷含量(X)按下式计算:

公式中m1:称取对照品的量,mg;m2:称取样品的量,mg;A1:对照品溶液的吸光度;A2:样品溶液的吸光度。
2.6.2 总糖含量测定根据文献[16]稍作改动,采用苯酚硫酸法测定总糖含量。标准曲线测定:将烘干至恒重的无水葡萄糖配制成0.1 mg/mL的标准液,精确移取0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1 mL于具塞的刻度试管中,并用蒸馏水补足至1 mL,震荡混匀。依次加入5%苯酚1 mL、硫酸5 mL,混匀,沸水浴5 min,冷却至室温,取出。以蒸馏水为空白,于490 nm波长处测定吸光值,根据标准曲线计算总糖含量。待测样品如上条件进行测定。
2.6.3 还原糖含量测定参考[17]稍作修改,采用3,5-二硝基水杨酸比色法测定总还原糖(DNS)。标准曲线测定:将烘干至恒重的无水葡萄糖配制成1 mg/mL的标准液,精确移取0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1 mL于具塞的刻度试管中,以蒸馏水补足至1 mL,震荡混匀,加入DNS溶液2 mL,混匀后,沸水浴5 min,冷却至室温,加入蒸馏水9 mL,混匀,以蒸馏水为空白,于540 nm波长处测定吸光度。待测样品如上条件进行测定,并根据标准曲线计算还原糖含量。
3 结果与分析
3.1 壳聚糖对澄清度的考察
3.1.1 壳聚糖用量的考察由表3可知,当壳聚糖用量逐渐增加时,菌质提取液的澄清度逐渐增加,当壳聚糖加入量为6%时,溶液达到几乎澄清透明,综合评分也达到了最高。随着壳聚糖用量的增加,溶液的澄清度有所增加,但有效成分的含量呈下降趋势。综合工业生产成本及操作性,本实验以壳聚糖加入量为6%时为最佳条件。

表3 壳聚糖加入量考察结果Table 3 The results of the investigation of chitosan addition amount
3.1.2 温度的考察由表4可知,温度对菌质提取液的有效成分含量有较大的影响,当温度为40℃时,多糖含量和总皂苷含量的综合评分值最高,在此条件下,溶液的澄清度达到了无沉淀的要求,溶液的颜色也开始向浅颜色转变。当温度过低时,溶液中澄清度没有达到很好的清除效果,温度过高时会损失有效物质含量,所以综合影响因素,本实验以壳聚糖加入温度为40℃为最佳条件。

表4 壳聚糖加入温度考察结果Table 4 The results of the investigation of chitosan adding temperature
3.1.3 搅拌速度的考察壳聚糖加入的速度会直接影响絮凝作用,搅拌速度直接影响壳聚糖与溶液中杂质的结合程度,故本实验选取搅拌速度为澄清工艺的筛选条件之一。从表5可知,随着搅拌速度增加,菌质提取液溶液颜色由深变浅,澄清度逐渐增加,壳聚糖对溶液中的杂质清除能力越强。当搅拌速度为640 r/min时,提取液的澄清度达到要求且有效物质含量损失较小,结合实际生产效率及条件,本实验选取搅拌速度为640 r/min时为最优条件。

表5 壳聚糖加入搅拌速度考察结果Table 5 The results of the investigation of the mixing speed of chitosan
3.2 澄清工艺正交考察
为优化发酵菌质口服液的澄清工艺,以人参药材中有效成分人参皂苷和多糖为评价指标进行综合评分法,按表2实验方案进行3因素3水平的L9(34)正交试验,正交试验结果及方差分析结果见表6。

表6 澄清工艺正交试验与结果L9(34)Table 6 The orthogonal test and results of the clarification process L9(34)
在单因素试验基础上,以壳聚糖加入量(%)、絮凝温度(℃)、搅拌速度(r/min)为讨论因素,以多糖含量和总皂苷含量的加权值为评价指标,进行正交试验。由上表数据可知,3个因素对猴头菌人参双向固体发酵菌质提取液品质的影响作用大小为A>B>C,即壳聚糖用量对澄清度影响最大,其次是絮凝温度,搅拌速度的影响最小。猴头菌人参双向固体发酵菌质口服液澄清工艺最优组合为A1B3C3,即壳聚糖加量4%、絮凝温度60℃、搅拌速度640 r/min,在此条件下有效成分的含量最高。
3.3 澄清优化工艺验证
对上述澄清优化得到的猴头菌人参双向固体发酵菌质口服液最佳澄清工艺参数进行验证,结果如表7所示,正交试验所得的猴头菌人参双向固体发酵菌质口服液最佳澄清工艺条件,平行3组实验具有较好的重复性,工艺稳定,可操作性强,可作为最佳的澄清工艺条件。
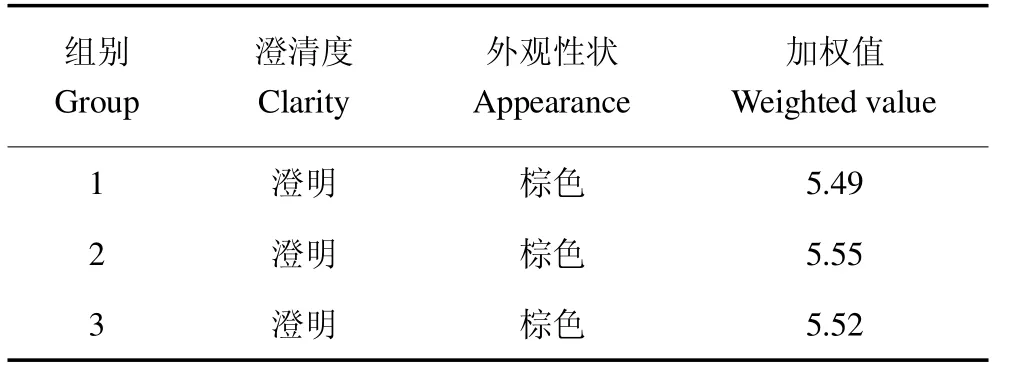
表7 验证实验结果Table 7 Results of the verification experiment
3.4 醇浓度考察
由表8的数据可知,当对醇浓度为40%、50%、60%、70%和80%进行考察时发现,当醇浓度为40%时,提取液中有效成分损失较少,有效成分的含量最高,且加权值最大,在本实验条件下以40%醇浓度为醇沉工艺中的最佳条件。
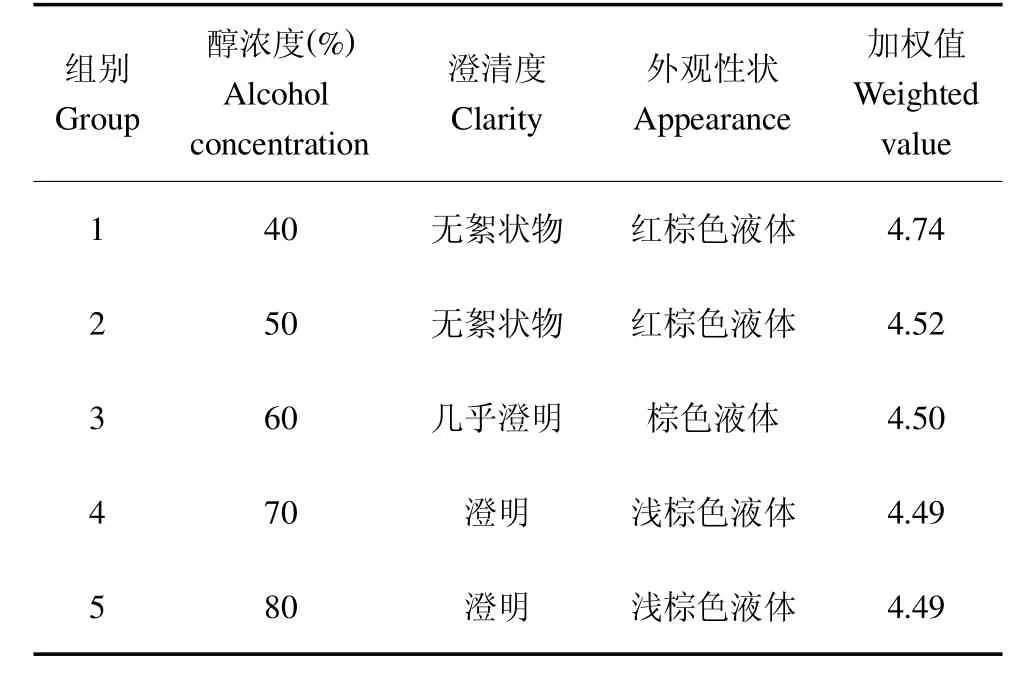
表8 醇浓度考察结果Table 8 Results of the alcohol concentration investigation
4 讨论
本研究以猴头菌人参双向固体发酵菌质为原材料,选用絮凝剂壳聚糖和醇沉两种澄清方法,以人参总皂苷及多糖含量综合加权值为评价指标,添加适量的矫味剂及防腐剂进行口服液的澄清工艺开发,筛选出生产猴头菌人参双向固体发酵口服液的最佳澄清工艺。从实验结果中可看出,相比于壳聚糖澄清法,醇沉法对提取液中有效成分的含量损失较大,且在实际生产过程中需要耗费大量的乙醇。综合考虑工厂生产的仪器设备、资金成本和安全性,口服液中有效物质含量等因素,最终选择以壳聚糖加入量4%、絮凝温度60℃、搅拌速度640 r/min为口服液最佳澄清工艺。
本研究为猴头菌人参双向固体发酵菌质口服液的批量生产提供提取工艺及澄清工艺的基础研究,确定了最佳澄清工艺。希望通过本实验,能为菌质的二次开发提供一定的理论基础,为促进人参及猴头菌产业的发展、推进猴头菌人参双向固体发酵产品的精深加工提供技术参考。
