盐碱胁迫对药用植物羊蹄三种药用成分的影响
2022-02-22李江楠尤健蒋章赵伟陈霞
李江楠,尤健,蒋章,赵伟,陈霞※
(1.吉林大学中草药育种与栽培国家地方联合工程实验室,吉林 长春 130112;2.吉林大学生命科学学院,吉林 长春 130112)
植物在受到环境胁迫时,往往通过自身产生的次生代谢产物来抵御外界环境胁迫,以保证植物的生长发育。这些次生代谢产物通常也是药用植物的主要药用成分。环境胁迫对植物次生代谢产物合成的影响主要包括生物胁迫与非生物胁迫,其中非生物胁迫,如光照、水分和土壤等都是影响植物次生代谢产物合成、积累的重要因素,也是影响药用植物药用成分含量的重要因子。土壤盐碱化是植物面临盐碱胁迫、制约植物生长的主要非生物胁迫之一[1]。有研究显示,世界上有接近20%的土地受到盐碱化的影响[2,3],到2025年,超过50%的土地会发生不同程度的盐碱化,严重威胁到作物的生产与土地利用[4]。我国的盐碱地面积超过3000万hm2,集中分布在西北、东北三省和华北等地,严重制约了种植业的可持续发展[5,6]。
我国土地资源紧缺,盐碱土地的改良与利用已经成为缓解土壤资源紧缺、扩大种植规模的重要方式。近年来,我国在盐碱地土壤改良技术方面取得了大量成果,但限于地域、资源和改良成本等因素的制约,很多盐碱地的改良仍然难以大面积实现[1],而利用成本低廉、产出较高的植物资源尤其是经济价值较高的药用植物对盐碱土地进行生物改良,是快速解决土壤盐碱化和实现盐碱土资源化利用的一种有效措施。因此,研究筛选合适于盐碱地种植的作物种质,对盐碱地的改良和种植业的可持续发展具有重要意义。
羊蹄(Rumex japonicas Houtt.)又名土大黄、牛耳大黄,为蓼科(Polygonaceae)酸模属(Rumex)多年生草本植物,主要分布于我国的东北、华北、华东、华中、华南、四川及贵州,朝鲜、日本和俄罗斯(远东)也有分布[7]。羊蹄为传统药用植物,始载于《神农本草经》,具有清热通便、凉血止血和杀虫止痒等功效,常用于鼻出血、血小板减少性紫癜、慢性肝炎及痔疮、皮癣等症[8]。羊蹄以根入药,其作为药用成分的主要次生代谢物质有大黄素、大黄素甲醚和大黄酚等[9-11]。目前国内外关于羊蹄化学成分提取、含量测定[10-13]以及药理[14-16]研究较多,也有部分学者针对不同土壤[17]、铜胁迫[18]下羊蹄药用成分的变化进行了研究。然而,关于盐碱胁迫对羊蹄主要药用成分的研究尚缺乏研究。大黄素、大黄酚和大黄素甲醚属于蒽醌类次生代谢产物[9],而蒽醌类化合物不仅具有极高的药用价值,也有助于植物抵御逆境胁迫,如紫外线辐射[19]和食草昆虫啃食等[20]。此外,一些酸模属植物在盐碱地生长良好,如杂交酸模[21]等。本研究以酸模属药用植物羊蹄为研究对象,旨在探讨盐碱胁迫下3种药用次生代谢产物的变化,为在盐碱地种植羊蹄、丰富盐碱地植物种植品种提供参考。
1 材料、试剂与仪器
1.1 材料
实验所用羊蹄种子于2015年9月采自吉林大学校园,经吉林大学生命科学学院关树文教授鉴定为蓼科酸模属植物羊蹄(Rumex japonicas Houtt.)。
1.2 主要试剂
乙醇(北京化工厂),色谱甲醇(国药集团化学试剂有限公司),乙酸(国药集团化学试剂有限公司),磷酸(国药集团化学试剂有限公司),碳酸钙(国药集团化学试剂有限公司),大黄素标准品(批号:D-029-150707)、大黄酚标准品(批号:D-017-160219)、大黄素甲醚标准品(批号:D-004-170113),均购于成都瑞芬思生物科技有限公司。
1.3 主要仪器
ME型电子分析天平[梅特勒-托利多仪器(上海)有限公司],752紫外可见分光光度计(上海光谱仪有限公司),Eppendorf移液枪(德国Eppendorf公司),HHS型电热恒温水浴锅(上海博迅实业有限公司医疗设备厂),DL6000B型低速冷冻离心机(上海沪粤明科学仪器有限公司),电热鼓风干燥箱(上海实验有限公司),超声仪KQ-250DE型(昆山市超声仪器有限公司),高效液相色谱仪(Acchrom),﹣80℃超低温冰箱(青岛海尔集团),828型台面式pH测试仪(上海理达)。
2 方法
2.1 盐碱胁迫处理
选择饱满的羊蹄种子,浸种后,以洗净并经高压灭菌的细沙(过20目筛)为培养基质,种植于直径为30cm的塑料花盆中,每隔2 d用Hoagland营养液浇灌1次,待幼苗长至2片真叶时,开始盐碱胁迫处理。
盐碱胁迫溶液均采用Hoagland营养液配制。盐胁迫采用NaCl和Na2SO4(NaCl和Na2SO4比为9:1),浓度梯度分别为20 mmol/L、40 mmol/L、80 mmol/L、160 mmol/L和200 mmol/L;碱胁迫采用Na2CO3和NaHCO3(Na2CO3和NaHCO3比为9:1),浓度梯度分别为10 mmol/L、20 mmol/L、40 mmol/L、80 mmol/L和160 mmol/L。
按照随机区组进行实验布置,共分为11个处理,其中1个不添加盐碱,作为对照。每个处理重复3次。每隔2 d按照所设计的盐碱浓度进行盐碱胁迫处理,连续进行5次。
2.2 样品处理
于第5次盐碱胁迫处理完成间隔2 d后开始采样。样品采集时茎叶和根分开保存,洗净后装袋放入烘箱,105℃杀青20 min,转80℃烘干至恒重,粉碎后过60目筛,待用。
2.3 供试品溶液的制备
精密称取羊蹄根部样品和茎叶样品粉末各50 mg,分别置于2 mL离心管中,加入2 mL色谱甲醇,称重;60℃下超声提取1 h,取出称重;加入色谱甲醇补充溶液损失质量,摇匀。吸取上清液,经0.22m滤膜过滤,即得供试品溶液。
2.4 对照品溶液的制备
精密称取用五氧化二磷干燥后的大黄素、大黄酚和大黄素甲醚标准品,以色谱甲醇为溶剂各配制成浓度为1.0 mg/mL、0.4 mg/mL和0.25 mg/mL的标准液。分别吸取大黄素、大黄酚及大黄素甲醚标准液100L、200L、200L,混合后以0.1%磷酸溶液定容至1 mL,混匀,即得到大黄素0.1 mg/mL、大黄酚0.08 mg/mL及大黄素甲醚0.05 mg/mL的混合对照品溶液。
2.5 色谱条件
色谱柱为华谱C18色谱柱(250mm 4.6mm,5m);流动相为甲醇(A)-0.1%磷酸溶液(B),梯度洗脱(0~5min,55%A;5~15 min,65%A;15~30 min,70%A;30~40 min,92%A;40~45min,92%A);流速1.0mL/min;柱温35℃;检测波长254 nm。在此条件下,羊蹄样品中大黄素、大黄酚和大黄素甲醚3种药用成分色谱峰分离良好,见图1。
2.6 方法学考察
2.6.2 精密度试验 在2.5色谱条件下,取大黄素、大黄酚及大黄素甲醚对照品溶液连续测定6次,进样量为20L,分别测定其峰面积。大黄素、大黄酚和大黄素甲醚峰面积RSD<2%,表明仪器精密度良好。
2.6.3 稳定性试验取供试品溶液适量,分别于室温下放置0 h、2 h、4 h、8 h、12 h、16 h和24 h,按2.5色谱条件进样测定,记录峰面积。大黄素、大黄酚和大黄素甲醚峰面积RSD<2%,表明供试品溶液在24 h内基本稳定。
2.6.4 重复性试验精密称取同一批样品适量,按2.3的方法制备供试品溶液,共6份,再按2.5色谱条件进样测定,记录峰面积并计算样品含量。大黄素、大黄酚和大黄素甲醚峰面积的RSD<2%,表明本方法重复性良好。
2.7 数据处理
应用Excel 2010软件计算样品3种药用成分含量,Origin 2019软件进行数据图形化处理,采用中药指纹相似度评价软件(2004A)[22]对羊蹄盐碱胁迫样品的中药指纹进行比较分析。
3 结果与分析
3.1 盐碱胁迫对羊蹄根部3种药用成分含量的影响
在不同浓度盐碱胁迫下羊蹄地下根部大黄素、大黄酚和大黄素甲醚的含量均发生了不同改变,结果见图2。图2统计结果显示,在以NaCl和Na2SO4比为9:1的不同浓度盐胁迫处理条件下,随着盐浓度的升高,大黄素在盐浓度为200 mmol/L时含量显著高于无盐胁迫的对照处理;大黄酚含量在20~200 mmol/L盐胁迫下先出现含量显著降低,随后逐渐上升,在200 mmol/L时达到最大;大黄素甲醚含量则是下降后升高,再下降,最后在200 mmol/L时含量达到最大。在以Na2CO3和NaHCO3比为9:1的不同浓度碱胁迫处理时,大黄素、大黄酚和大黄素甲醚均表现为在低浓度10 mmol/L时含量显著下降、在20 mmol/L时含量显著上升及在40 mmol/L时含量开始显著下降的特点,当碱浓度达到80 mmol/L时,羊蹄植株即出现死亡。以上结果说明盐碱胁迫均能刺激羊蹄根部大黄素、大黄酚和大黄素甲醚的产生,3种药用成分的含量也都能显著提升。盐胁迫和碱胁迫相比较,羊蹄对盐胁迫的耐受范围更宽一些,而碱胁迫刺激的耐受性相对较低。

图2 盐碱胁迫对羊蹄根部大黄素、大黄酚和大黄素甲醚含量的影响Fig.2 Effects of the saline-alkali stress on the contents of emodin,chrysophanol and rheochrysidin in the root of Rumex japonicas
3.2 盐碱胁迫下羊蹄茎叶3种药用成分含量比较
许多以根及根茎入药的植物,其茎叶里面也往往含有一定量的药用成分,本研究同时测定了盐碱胁迫下羊蹄茎叶3种药用成分的含量,结果见图3。通过图3分析可以看出,当盐胁迫为40 mmol/L时茎叶大黄素含量相对较高,但显著低于对照处理,碱胁迫浓度为10 mmol/L时茎叶大黄素含量最高,但依然显著低于对照处理。茎叶大黄酚含量在盐胁迫浓度为160 mmol/L和碱胁迫浓度为20mmol/L时分别达到最高,均显著高于对照处理。茎叶大黄素甲醚的含量在盐胁迫处理后均高于对照处理,在盐胁迫浓度160mmol/L时达到最高,在200 mmol/L时出现下降;碱胁迫处理后仅在10 mmol/L处理下显示出明显高于对照的含量,其他处理则显著低于未处理的对照组。以上结果说明盐碱处理后同样会刺激羊蹄地上茎叶大黄素、大黄酚和大黄素甲醚的产生,大黄酚和大黄素甲醚显示出与根部相似的趋势。

图3 盐碱胁迫对羊蹄茎叶大黄素、大黄酚和大黄素甲醚含量的影响Fig.3 Effects of the saline-alkali stress on the contents of emodin,chrysophanol and rheochrysidin in the stem and leaf of Rumex japonicas
3.3 盐碱胁迫下羊蹄根部和茎叶3种药用成分分布
羊蹄的根和茎叶均含有一定量的大黄素、大黄酚和大黄素甲醚,进一步分析了盐碱胁迫处理羊蹄地下根部与地上茎叶含量比例组成,结果见图4。由图4可以看出,在未施加盐碱胁迫时,即盐碱处理浓度为0 mmol/L时,大黄素在茎叶中含量比例比较高,达到了72%,大黄酚和大黄素甲醚均在根部中含量比例比较高,分别达到88%和77%。当加以盐碱胁迫处理时3种成分在根和茎叶中的分布比例发生了明显改变,大黄素以盐胁迫处理200 mmol/L和碱胁迫处理40 mmol/L时根中含量比例最大,分别为47%和57%;大黄酚与大黄素同样在盐胁迫处理200 mmol/L和碱胁迫处理40mmol/L时根中含量比例最大,均超过了90%;大黄素甲醚以盐胁迫处理200 mmol/L和碱胁迫处理20 mmol/L时最大,分别为79%和85%。这种分布比例的变化可能是由于羊蹄植株直接处于盐碱胁迫环境之中,使地上部茎叶形成的部分次生代产物转运至根部所致。
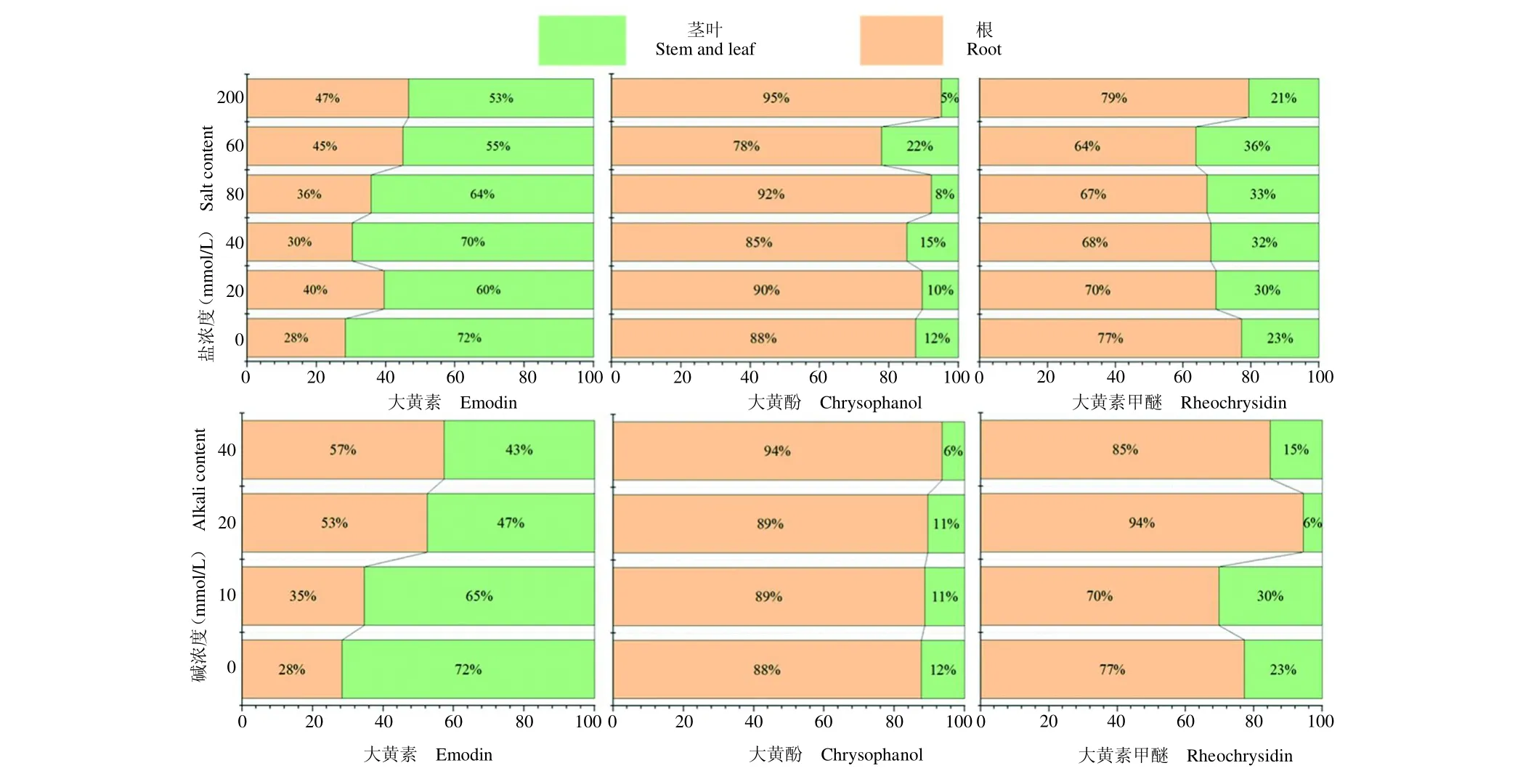
图4 盐碱胁迫下大黄素、大黄酚和大黄素甲醚在羊蹄植株地上和地下的分布Fig.4 Aboveground and underground distributions of emodin chrysophanol and rheochrysidin in Rumex japonicas under the salinealkali stress
3.4 盐胁迫和碱胁迫对羊蹄3种药用成分含量的差异比较
盐胁迫和碱胁迫处理均能够显著影响羊蹄植株3种药用成分的含量,进一步比较了两种胁迫类型最佳胁迫浓度下羊蹄3种药用成分含量的影响效果,结果见图5。由图5分析可以看出,羊蹄根部大黄素、大黄酚和大黄素甲醚在碱胁迫处理下显著高于盐胁迫处理,而茎叶则为盐胁迫处理显著高于碱胁迫处理。由此可见,羊蹄不同药用部位对盐胁迫和碱胁迫的响应是不同的,根部对碱胁迫响应更为强烈,茎叶则对盐胁迫响应较为强烈。

图5 盐胁迫和碱胁迫下羊蹄大黄素、大黄酚和大黄素甲醚含量比较Fig.5 Comparisons of the contents of emodin,chrysophanol and rheochrysidin of Rumex japonicas under the salt and alkali stress
3.5 盐碱胁迫下羊蹄次生代谢指纹变化
中药化学指纹可以较为全面地反应中药成分的组成变化,本研究进一步采用中药指纹相似度评价软件(2004A),对不同浓度盐碱胁迫下的羊蹄样品进行了中药指纹图谱比对分析,以尽可能全面地评价盐碱胁迫对药用植物羊蹄有效成分的影响。
3.5.1 相似度评价将计算的不同羊蹄样品之间相似度结果以气泡图的形式进行可视化处理,结果见图6。图6中气泡的直径大小和颜色深浅代表了样品之间相似度的高低,可以看出,无论是在盐胁迫还是碱胁迫处理下,地下根部与地上茎叶之间的相似度存在一定差异,说明不同药用部位在化学组成上存在一定的差异。盐胁迫处理与碱胁迫处理之间,无论是在根部样品还是茎叶样品也都存在一定差异。在所有样品中茎叶样品在盐胁迫处理160 mmol/L和200 mmol/L、碱胁迫处理20 mmol/L和40 mmol/L时均表现出与其他样品极为显著的相似度差异。

图6 不同盐碱胁迫处理羊蹄相似度比较Fig.6 Comparisons of the similarity of Rumex japonicas under the different saline-alkali stress
3.5.2 聚类分析基于中药指纹图谱分析软件获得的指纹峰匹配数据,采用层次聚类分析法对羊蹄不同盐碱胁迫处理样本进行聚类分析,结果见图7。聚类分析展示了羊蹄在盐碱胁迫处理下代谢成分组成变化关系,通过图7可以看出,盐胁迫处理下羊蹄各样本与未处理对照样品(R-0 mmol/L和SL-0 mmol/L)关系较近,随着盐浓度的升高关系渐远;碱胁迫处理与对照样本距离明显大于盐处理,且茎叶在20 mmol/L和40 mmol/L碱胁迫处理时独自聚为一支,明显区别于其他样品,说明碱胁迫处理对羊蹄次生代谢产物形成影响更为显著。

图7 不同盐碱胁迫处理羊蹄样本聚类分析树状图Fig.7 The dendrogram of the cluster analysis of Rumex japonicas samples under the different salt-alkali stress
4 讨论
2020年11月17日国务院办公厅发布了《国务院办公厅关于防止耕地“非粮化”稳定粮食生产的意见》,防止耕地“非粮化”是我国保护耕地、扩大粮食生产、保障粮食安全的重要举措。长期以来,中药材种植存在与粮食生产争地的矛盾,随着近年来中药材种植规模的不断扩大,这一矛盾日益凸显,而耕地“非粮化”意见的出台意味着中药材种植可利用土地资源必然减少,开发新的土地资源以保证中药材生产的稳定就成为中草药种植亟待解决的突出问题。我国是世界第三大盐碱地分布地区[23],主要分布在东北、华北、华东和西北四大区域,总面积约1亿hm2[24]。因此,充分利用盐碱地种植中草药成为解决与粮争地这一矛盾的有效途径。此外,作为中药材生产的药用植物含有丰富的次生代谢产物,而次生代谢产物是植物适应环境胁迫的重要因素,因此,中草药品种在盐碱地种植也存在很大的可能性。
本实验研究了盐碱胁迫对药用植物羊蹄3种药用成分大黄素、大黄酚和大黄素甲醚含量的影响,研究结果证实羊蹄不仅能够在一定的盐碱浓度下存活,其根部和地上茎叶药用成分的含量在合适的盐碱浓度下均显著增加,盐胁迫对地上茎叶的影响大于碱胁迫,碱胁迫对根部的影响大于盐胁迫。周子晔等[17]研究了酸性土壤和碱性土壤环境对羊蹄大黄素含量的影响,结果显示在碱性土壤条件下羊蹄根部和地上茎叶大黄素含量均低于酸性土壤条件。我们的研究结果显示在较高碱胁迫浓度下,羊蹄根部大黄素含量会有一个显著升高,茎叶大黄素含量在盐碱胁迫下含量会下降,羊蹄根部大黄素含量与前人报道有所不同,这可能与羊蹄生长的碱胁迫环境差异有关,我们同样观察到了在低浓度碱胁迫条件下根部大黄素含量的下降。对于羊蹄大黄酚、大黄素甲醚在盐碱环境下的含量变化尚未见报道。此外,本实验利用中药指纹图谱从多个次生代谢产物评价了盐碱胁迫对羊蹄根部、茎叶整个中药指纹的影响,发现盐碱胁迫下羊蹄中药指纹图谱有一定的变化,碱胁迫的影响更为明显一些,这种中药指纹上的变化是否会对其药效产生影响,尚需进一步实验验证。
综上所述,本研究通过多成分、多角度初次探索了药用植物羊蹄在盐碱地种植的可能,初步评价了盐碱环境种植羊蹄药用成分的变化,研究结果为筛选更多适合盐碱地种植的药用植物种类提供了参考,也为改变药粮争地的矛盾提出了新的解决思路。
