温度响应性水凝胶的制备及其对姜黄素的控制释放研究*
2022-02-22魏蕾焦韵苹李娜李阳
魏蕾 焦韵苹 李娜 李阳
(1.西北妇女儿童医院,陕西 西安 710061;2.陕西省第二人民医院,陕西 西安 710005)
皮肤损伤是人类生活中最常见的损伤类型。在伤口愈合过程中,炎症往往会阻碍伤口的愈合,并且伤口部位产生的过多的过氧自由基也不利于伤口的修复[1]。姜黄素是姜黄中提取的天然小分子活性物质,具有很多优良的特性,姜黄素具有极佳的抗炎、抗氧化作用,在伤口修复领域具有广泛的应用前景[2-4]。然而,姜黄素自身较差的水溶性限制了它的应用。如何有效地解决姜黄素的分散问题成为了一个亟待解决的难题。
疏水相互作用是通过疏水物的疏水基与水相互排斥而发生的一种作用,利用两亲性分子的疏水高分子链段与姜黄素发生疏水相互作用有望解决其分散的难题[5]。Pluronic F-127(PF-127)作为一种两亲性三嵌段共聚物,可在水中自组装成具有疏水空腔,亲水外壁的胶束,其疏水空腔对负载疏水类药物效率极高[6-7]。此外,其自组装特性能够为水凝胶网络的构建带来极大的贡献。PNIPAM是一种具有温度响应的高分子材料,将其引入可以实现药物的控制释放[2,8-11]。在PF-127中引入双键形成PF127-DA,通过BIS作为交联剂,在APS引发与TEMED的催化下,PF127-DA与PNIPAM共价交联形成第一重网络[6,12]。
葡聚糖是一种高分子多糖,其本身具有良好的生物相容性,可降解性,可吸收等特点,常被用来做药物载体[13]。此外葡聚糖还具有促进吸收,粘膜粘附性以及易功能化等特点,作为药物载体具有很大的优势[14]。
本文构建了PNIPAM与PF127的共价交联网络,搭配葡聚糖分子链构成半互穿双网络水凝胶,姜黄素通过疏水作用被负载于其中。实验采用红外光谱证明了水凝胶的成功制备,通过溶胀实验、扫描电镜观察等表征温度响应性能,通过不同温度下药物释放实验来表征温度响应性药物缓释性能。实验证明该水凝胶具备良好的温度响应性药物缓释功能,在载药水凝胶领域有广阔的应用前景[15]。
1 仪器与试药
1.1仪器 6700傅里叶变换红外光谱仪(Nicolet);Lambda 35紫外分光光度仪(PerkinElmer);QUTAN-feg250场发射扫描电子显微镜(FEI)。
1.2试药 葡聚糖(VETEC);Pluronic F-127(SIGMA); N-异丙基丙酰胺(TCI);NIPAM;丙烯酰氯(SIGMA)。
2 实验方法
2.1实验设计 图1为水凝胶合成示意图,首先在PF-127上引入双键,以BIS作为交联剂,通过APS引发、TEMED催化,使NIPAM聚合以及交联PF-127。凝胶中葡聚糖组分通过连缠绕的方式与PNIPAM作用,形成了最终的半互穿网络水凝胶。
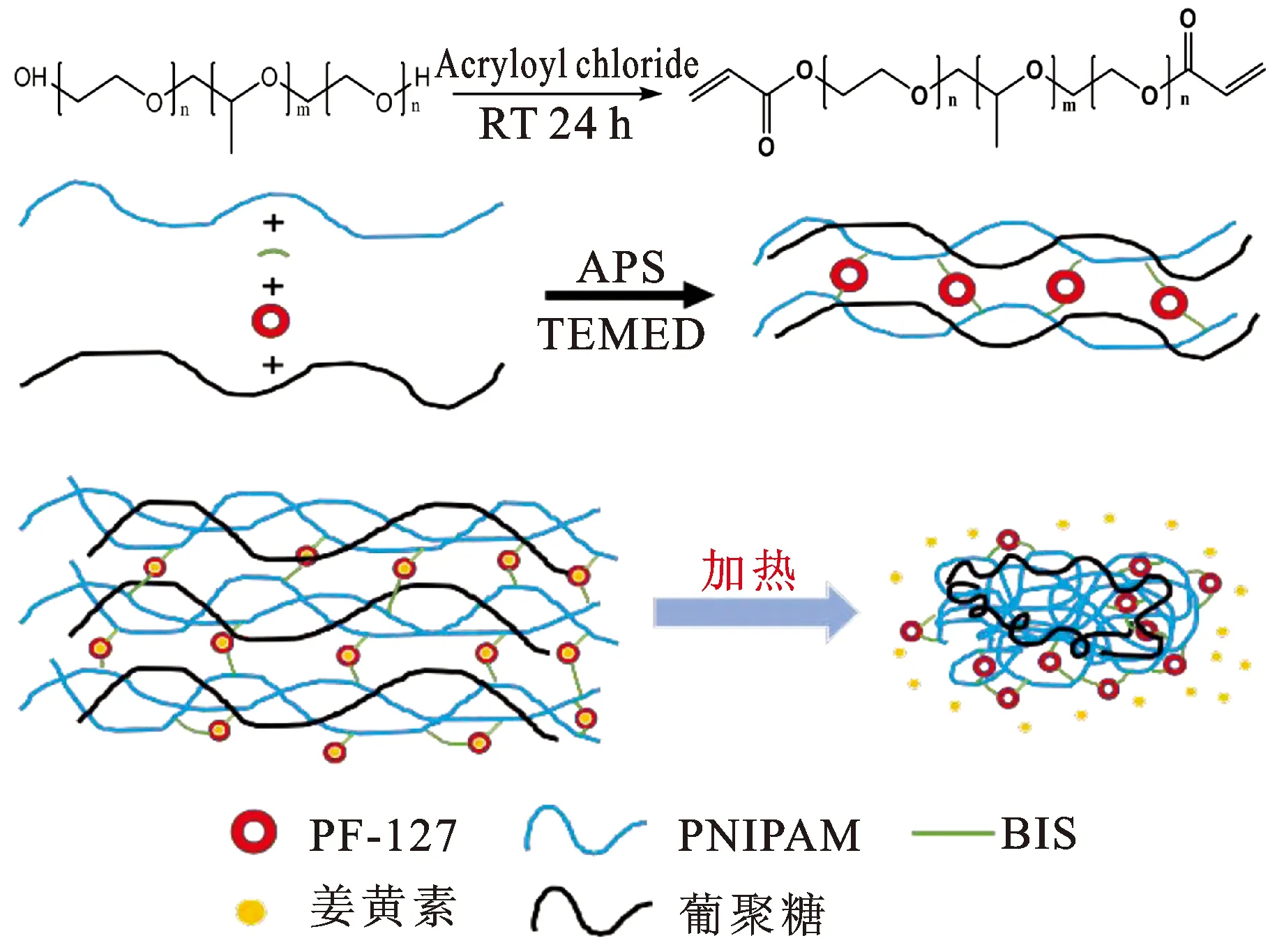
图1 水凝胶合成示意图
2.2实验步骤
2.2.1PF127-DA的合成 将2.54 g(0.2 mmoL)的PF-127与0.061 g(0.6 mmoL)的三乙胺溶解在20 mL无水二氯甲烷中冰浴鼓泡搅拌15 min。将0.05 mL的丙烯酰氯在氮气保护下缓慢加入其中,室温反应24 h。将合成的产物旋蒸、透析、冻干即得到PF127-DA[16]。
2.2.2水凝胶的制备 水凝胶以一锅法制备,将NIPAM、PF127-DA、葡聚糖及BIS分散于10 mL离心管中,加入 APS引发、TEMED催化下,室温放置5 min成胶。其中水凝胶的加料量为100 mg,BIS的加入量为NIPAM的5%,APS加入量为1.5 mg,其余加料量如表1所示。

表1 水凝胶加料比例表(%)
2.2.3载姜黄素水凝胶的制备 称量2 mg姜黄素固体至1 mL凝胶前体溶液中,使用涡旋机混匀,加入APS与TEMED静置5 min即可成胶。
2.2.4红外光谱的测定 将制备的水凝胶冻干后,研磨成粉末分散在溴化钾中,压片后进行红外光谱测定。
2.2.5溶胀的测定 将样品分别置于50 mL离心管加磷酸盐缓冲液(phosphate buffered salline,PBS)20 mL,分别放至25 ℃与37 ℃恒温箱中,每隔固定时间测定水凝胶质量,直至溶胀平衡[17]。其中溶胀率的计算公式为:
2.2.6场发射扫描电镜的拍摄 将溶胀后的水凝胶用液氮迅速冷冻后冻干,制样并喷金。置于场发射扫描电镜10 kV,400倍下进行形貌观察,分别拍摄各水凝胶形貌。
2.2.7姜黄素释放的测定 将3号载姜黄素水凝胶浸泡于5 mL PBS中,分别置于25 ℃与37 ℃恒温摇床中,每隔固定时间移取1 mL液体并补加1 mL PBS,使用紫外分光光度法测量浸出液中姜黄素的含量,直至释放完全。
3 结果分析
3.1红外光谱分析 如图2为葡聚糖、NIPAM、与3号水凝胶的红外光谱图。从图中可以看出在1680 cm-1处NIPAM有一峰为碳碳双键吸收峰,而该峰在水凝胶中消失证明了NIPAM的聚合与PF-127的连接。水凝胶1230 cm-1处与3350 cm-1的峰则证明葡聚糖的存在。通过红外谱图的分析,证明了水凝胶的成功制备。

图2 红外光谱图
3.2溶胀实验 如图3为水凝胶的溶胀结果图,由图可以看出无论是在25 ℃还是在37 ℃,随着NIPAM含量的逐渐增加,水凝胶的溶胀逐渐降低,这是因为增加NIPAM的含量会使水凝胶的结构变得更加致密,孔隙变小,从而不利于水凝胶的溶胀。并且,整体上来看37 ℃下水凝胶的溶胀率比25 ℃下更低,这是因为NIPAM具有温度响应性能,在温度高于35 ℃时会收缩排水,使得水凝胶的整体体积减小,降低了凝胶的溶胀。

图3 溶胀实验结果
3.3扫描电镜图 如图4为不同NIPAM含量的水凝胶在25 ℃与37 ℃溶胀后的电镜拍摄图片,可以看出随着NIPAM含量的增加,水凝胶的孔径逐渐减小,90%NIPAM组的孔径最小结构最致密,也验证了溶胀结果的分析结论。整体而言,37 ℃下水凝胶的孔径相较于25 ℃明显减小,这也证明了制备的水凝胶具有优异的温度响应性能。

图4 水凝胶SEM图(比例尺200 μm)
3.4药物释放 如图5为水凝胶预聚溶液中分散的姜黄素与水溶液中分散的姜黄素效果对比图。由图可以看出,相比于水,预聚液可以很好地分散姜黄素。

图5 姜黄素增容效果图
如图6为姜黄素的释放曲线,可以看出在最初的50 h内,姜黄素的释放速度较快,随着时间的增加,在120 h左右达到最大释放量,且会持续释放200 h以上。并且,水凝胶37 ℃下的姜黄素释放量为22.7%,25 ℃下为18.6%。实验结果证明了该水凝胶具有良好的药物缓释性能及温度响应释放性能。

图6 姜黄素释放曲线
4 结论
本课题针对姜黄素分散性差,生物利用度低的难题,设计了一种姜黄素负载的基于葡聚糖与PNIPAM和PF-127共价交联网络的温度响应性半互穿网络药物缓释水凝胶。水凝胶中两亲性的PF-127胶束可以利用疏水相互作用通过其疏水腔来负载药物[18],而PNIPAM作为一种热敏性分子在温度高于32 ℃时,其分子链会收缩从而将凝胶中的药物“挤出”,实现温度响应释放[19]。通过水凝胶载药的方式,不仅大大增加了姜黄素在水中分散性,而且在水凝胶的温度响应性以及缓释性使得姜黄素可以在伤口部位持续作用,从而有利于伤口的修复[20]。该方法相较于传统的方法大大增加了姜黄素的分散性与生物利用度。实验中,通过红外光谱证明了水凝胶的成功制备;在溶胀实验中,通过模拟室温(25 ℃)与体温(37 ℃)下水凝胶的溶胀行为验证了该水凝胶在人体环境下的温度响应性溶胀。此外对该水凝胶进行的场发射扫描电镜观察结果显示其具有相对均匀且规律明显的孔结构。在药物释放实验中,该水凝胶也表现出了良好的温度响应性药物释放性能。综上,我们成功的制备了一种水凝胶,该水凝胶具有良好的温度响应性能,溶胀性能,均匀的孔结构以及良好的药物缓释功能,在温度响应药物释放领域具有广阔的应用前景。
