噻虫嗪及其代谢物噻虫胺在麦叶和麦穗中的痕量检测方法及其应用
2022-02-22刘佳悦张云慧王丽川董丰收吴小虎潘兴鲁郑永权
刘佳悦, 徐 军, 张云慧, 王丽川, 董丰收,吴小虎, 潘兴鲁, 郑永权*,
(1. 中国农业科学院 植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193;2. 河北省辛集市植保植检站,河北 辛集 052360)
噻虫嗪是第二代新烟碱类高效低毒杀虫剂,对害虫具有胃毒、触杀及内吸活性,相比于吡虫啉,其对昆虫乙酰胆碱受体的亲和力更高,具有更高的杀虫活性,对刺吸式害虫具有良好的防效[1]。目前噻虫嗪在我国登记产品数量为551 个,登记作物46 种,在小麦上的登记产品共64 个,主要用于防治小麦蚜虫[2]。
噻虫嗪的风险评估残留物定义为噻虫嗪和噻虫胺[3]。噻虫胺是噻虫嗪的代谢产物,其也在小麦上登记使用[4]。噻虫嗪及噻虫胺结构式见图式1。目前已有噻虫嗪和噻虫胺在蔬菜[5-7]、水果[8]、油料作物[9]、糖料作物[10]、谷物[11]和秸秆[12]上残留的分析方法及残留行为报道,但尚未见其在新鲜麦叶、麦穗基质中残留行为的研究报道,而痕量残留分析方法是开展噻虫嗪在小麦植株中残留、代谢以及消解动态研究的基础。本文首次建立了采用固相萃取净化结合超高效液相色谱-串联质谱(UPLC-MS/MS) 检测麦叶和麦穗中噻虫嗪及其代谢物噻虫胺残留的痕量检测方法,考察了不同的净化方式对麦叶和麦穗基质中色素等杂质去除的效果,优化的洗脱剂的种类和用量,并运用该检测分析方法测定了植保无人机喷雾方式下麦叶、麦穗样品中噻虫嗪和噻虫胺的实际残留量及消解动态,旨在为开展噻虫嗪安全合理及减量施用方式提供支持。

图式 1 噻虫嗪及噻虫胺结构式Scheme 1 The structural formula of thiamethoxam and clothianidin
1 材料与方法
1.1 药剂、试剂与材料
噻虫嗪 (thiamethoxam) 标准品 (纯度≥98.5%) 、噻虫胺 (clothianidin)标准品 (纯度≥98.5%) 和同位素内标物噻虫嗪-D3(1 mL, 100 mg/L) (阿尔塔科技有限公司);25%噻虫嗪水分散粒剂 (中农立华农用化学品有限公司)。色谱纯甲酸、乙酸和乙腈(Sigma-Aldrich 公司)。 分析纯乙腈、氯化钠和无水硫酸镁 (北京精细化工有限公司) 。十八烷基硅烷 (C18, 40 ~ 63 μm)、乙二胺-N-丙基硅烷 (PSA,40 ~ 63 μm) 、石墨化碳黑 (GCB, 120 ~ 400 目) 以及氨基/石墨化碳黑固相萃取柱(NH2/Carb) (500 mg/500 mg/6 mL) (艾杰尔公司)。色谱柱EC-C18(安捷伦公司)。
麦叶、麦穗样品: 金农58 号小麦种子 (河北金诚种业有限责任公司)。添加回收试验样品为室内土培种植的空白样品;实测样品为2021 年5 月4 日在河北省辛集市王口镇郭西村开展植保无人机飞防试验的小麦田间样品,分别在每小区随机采集施药后2 h 和3、5、7 和14 d 小麦植株2 kg,将植株和麦穗切碎混匀后缩分留正副样各100 g。
1.2 仪器与设备
Agilent 1290-6470A 超高效液相色谱-串联质谱 (美国Agilent 公司);AA-160 型电子天平 (Dever仪器公司);ME204E 型电子天平 (梅特勒-托利多仪器有限公司);高通量组织研磨仪 (托摩根生物科技公司);XW-80A 型涡旋混合器 (美国Scientific industries 公司);MS-200 多管涡旋混匀仪 (杭州瑞诚仪器有限公司);SHZ-D (Ⅲ) 旋转蒸发仪 (邦西仪器科技);KQ-500B 型超声仪 (昆山市超声波仪器有限公司);Milli-Q Direct 8 超纯水仪 (美国Millipore 公司);Sigma 1-15 离心机 (德国Sigma公司);医用无菌注射器 (上海治宇医疗器械有限公司);TG16-WS 台式离心机(长沙湘仪离心机有限公司);t20 植保无人机 (UAV,深圳市大疆创新科技有限公司) 。
1.3 试验方法
1.3.1 麦叶、麦穗样品前处理
提取:分别称取经液氮研磨的麦叶、麦穗5 g(精确至 ± 0.01g) 置于50 mL 离心管中,加入100 μL 0.25 mg/L 的噻虫嗪-D3内标溶液,静置40 min。依次加入5 mL 超纯水和10 mL 乙腈,振荡提取10 min;加入3 g 氯化钠盐析,继续振荡5 min,于4000 r/min 离心5 min;取6 mL 上清液,待过SPE 柱净化。
净化:称取2 g 无水硫酸钠于NH2/Carb 固相萃取柱上,用5 mL 乙腈溶液淋洗活化小柱,当淋洗液全部自然流下时,将6 mL 上清液分两次加入NH2/Carb 柱中,待上样液全部自然流下时,用5 mLV(乙腈) :V(甲苯) =3 : 1 分2 次洗脱。收集洗脱液,旋转蒸发至近干,用色谱纯乙腈定容至1.5 mL,过0.22 μm 有机滤膜,待UPLC-MS/MS检测。
1.3.2 UPLC-MS/MS 检测条件
1.3.2.1 UPLC 条件 Agilent Poroshell 120 ECC18色谱柱 (2.1 mm × 50 mm,1.9 μm) ,进样量4 μL,流速0.3 mL/min;柱温40 ℃;流动相A 为体积分数为0.2 %的甲酸水溶液,流动相B 为乙腈。梯度洗脱程序见表1。

表1 超高效液相色谱梯度洗脱程序Table 1 Program of UPLC gradient elution
1.3.2.2 MS/MS 分析条件 电喷雾离子源,正离子扫描模式;干燥气温度300 ℃,干燥器流速5 L/min。雾化器压力310 kPa, 鞘气温度350 ℃,鞘气流速11 L/min,毛细管电压3500 V,喷嘴电压500 V;数据采集采用多反应监测模式,质谱参数见表2。

表2 目标农药的质谱参数Table 2 MS/MS parameters used to analyze the pesticides
1.3.3 标准溶液配制及标准曲线的制作 以色谱纯乙腈为溶剂,分别配制10 mL 质量浓度为1000 mg/L 的噻虫嗪和噻虫胺标准品母液。分别移取1 mL 噻虫胺、噻虫胺标准品母液,用色谱纯乙腈定容至10 mL,得到100 mg/L 混合标准母液。移取1 mL 混合标准母液于100 mL 容量瓶,用乙腈定容,得到1 mg/L 的噻虫嗪和噻虫胺混合标准溶液。此混合标准溶液分别用乙腈及空白基质提取液逐级稀释,依次得到质量浓度为0.5、0.2、0.1、0.05、0.02、0.01、0.005、0.002 和0.001 mg/L 的溶剂标准溶液及基质匹配标准溶液。移取100 μL质量浓度为100 mg/L 的噻虫嗪-D3标准母液,用乙腈定容至10 mL,得到1 mg/L 的噻虫嗪-D3标准溶液,此内标溶液用于进一步的定量分析。将以上配制的各溶液密封且避光保存于 −20 ℃冰箱内,待用。
应用同位素内标定量法做溶剂标准曲线和基质标准曲线时,应向每个浓度梯度的噻虫嗪、噻虫胺混合标准溶液中均加入相同体积、相同质量浓度的噻虫嗪-D3。按照1.3.2 节的条件测定,以分析物与内标物质量浓度的比值为横坐标,以化合物/内标物峰面积的比值为纵坐标绘制标准曲线。
1.3.4 溶剂标淋洗曲线 用分析纯乙腈配制质量浓度为0.05 mg/L 的噻虫嗪、噻虫胺及噻虫嗪-D3混合标准溶液,用NH2/Carb 固相萃取柱上样,上样体积6 mL,用V(乙腈) :V(甲苯) = 3 : 1洗脱,分别接收体积为1、3、5、7、9、11 和13 mL的洗脱液。分别旋转蒸发至近干后,用色谱乙腈定容至1.5 mL,过0.22 μm 有机滤膜至进样小瓶中。
1.3.5 添加回收试验 在麦叶、麦穗空白样品中分别添加0.001、0.01、0.1 和1 mg/kg 的噻虫嗪和噻虫胺混合标准溶液,噻虫嗪-D3的添加水平为0.01 mg/kg。每个添加水平重复5 次,按照1.3.1节的方法进行前处理,按照1.3.2 节的色谱-质谱条件测定,利用同位素内标法定量,计算各添加水平下的平均回收率及相对标准偏差 (RSD) ;再分别按照公式 (1) 和 (2) 计算目标化合物的绝对回收率 (RE) 和相对回收率 (RI) 。

1.3.7 残留消解动态试验及实际样品检测
2021 年5 月4 日在河北省辛集市王口镇郭西村开展植保无人机飞防试验。在供试的小麦田中,设3 个重复,每小区面积2400 m2,小区间设立保护行。在小麦孕穗期采用无人机兑水喷施 25%噻虫嗪水分散粒剂1 次,用药量为150 g/hm2(有效成分37.5 g/hm2) 。分别于施药后2 h 和3、5、7和14 d 在每小区随机采集小麦植株2 kg,将植株和麦穗切碎混匀后缩分留正副样各100 g,于−20 ℃ 保存。按照本研究所建立的分析方法测定,采用噻虫嗪-D3进行校正,检测实际样品中噻虫嗪和噻虫胺的含量,并根据实际样品检测结果制作无人机喷雾噻虫嗪14 d 内在麦叶、麦穗上的降解曲线,计算残留降解动态。
2 结果与讨论
2.1 不同净化方式的比较
本文比较了两种不同的净化方式——分散固相萃取 (dSPE) 与固相萃取 (SPE) 对麦叶和麦穗基质净化效果的差异及回收率、定量限的区别。用dSPE 方法净化,试验了5 种不同的净化剂组合:(①50 mg PSA;②50 mg C18;③10 mg GCB;④50 mg PSA + 10 mg GCB;⑤50 mg C18+ 10 mg GCB) ,噻虫嗪及噻虫胺的添加水平为0.01 mg/kg,如图1 所示,5 种净化剂在麦叶和麦穗基质中回收率均满足要求,回收率范围在70% ~ 110%之间。但比较不同净化条件下的上清液颜色,从图2 (A)和图2 (B)中可以清晰地看出,分散固相萃取净化的效果远不如NH2/Carb 固相萃取柱,其中净化剂50 mg C18+ 10 mg GCB 的上清液在5 种净化剂中颜色最浅,但仍呈现明显的黄绿色,存在叶绿素等杂质干扰,这样不仅会危害分析仪器,还存在色素造成的基质抑制效应,影响方法的灵敏度。分散固相萃取净化方法在麦叶、麦穗中的定量限为0.01 mg/kg。相比之下,NH2/Carb 柱不仅净化效果好,回收率满足要求,且方法检测灵敏度高,最低检测水平达到0.001 mg/kg。

图1 麦叶、麦穗基质中分散固相萃取净化下的回收率 (添加水平0.01 mg/kg)Fig. 1 Recoveries of wheat leaves and wheat ears under dispersive solid phase extraction purification (the spiked level of 0.01 mg/kg)

图2 麦穗(A)及麦叶(B)基质中分散固相萃取及固相萃取柱净化效果比较Fig. 2 Comparison of the purification effect of dispersive solid phase extraction and solid phase extraction column in wheat ears (A) and wheat leaves (B)
针对固相萃取柱 (SPE) 净化方法,不同的固相萃取柱具有不同的作用基团及保留机理,应根据净化基质自身的特点选择合适的固相萃取柱。C18固相萃取柱多用于水中有机污染物的萃取,可吸附弱极性干扰物——多环芳烃、邻苯二甲酸酯和多氯联苯等,从而得到纯净的离子溶液[13-14]。弗罗里硅土固相萃取柱可用于从非极性溶液中萃取极性化合物,目前常用于贝类、禽蛋类有机氯类农药的前处理方法中[15-16]。NH2/Carb 固相萃取柱中的Carb 层为具有片层结构的石墨化炭黑,对叶绿素、叶黄素等色素净化效果良好,同时NH2层除可以吸附部分色素外,还能去除一些脂肪酸及糖类物质,进一步提高净化效果[17]。目前NH2/Carb柱已广泛用于蔬菜[18]、水果[19]、茶叶[20]及植物产品[21]农药残留分析中的样品净化。
本文研究基质为生长期的麦叶、麦穗,其含有的主要杂质为叶绿素,其次为少量的淀粉和糖类。综合各固相萃取柱对杂质的保留机理及净化特点,最终选用NH2/Carb 固相萃取柱用于去除麦叶、麦穗中的叶绿素、淀粉等杂质,效果良好。
2.2 固相色谱柱洗脱溶剂体积优化
从图3 中可以看出,随着洗脱溶剂的增加(V=1 ~ 5 mL),回收率逐步上升,说明V(乙腈) :V(甲苯) =3 : 1 能将噻虫嗪、噻虫胺及噻虫嗪-D3从NH2/Carb 柱上洗脱;其中洗脱溶剂为5 mL时,噻虫嗪和噻虫胺回收率达到峰值,分别为85.8%和76.2%,用内标噻虫嗪-D3校正后回收率满足要求。
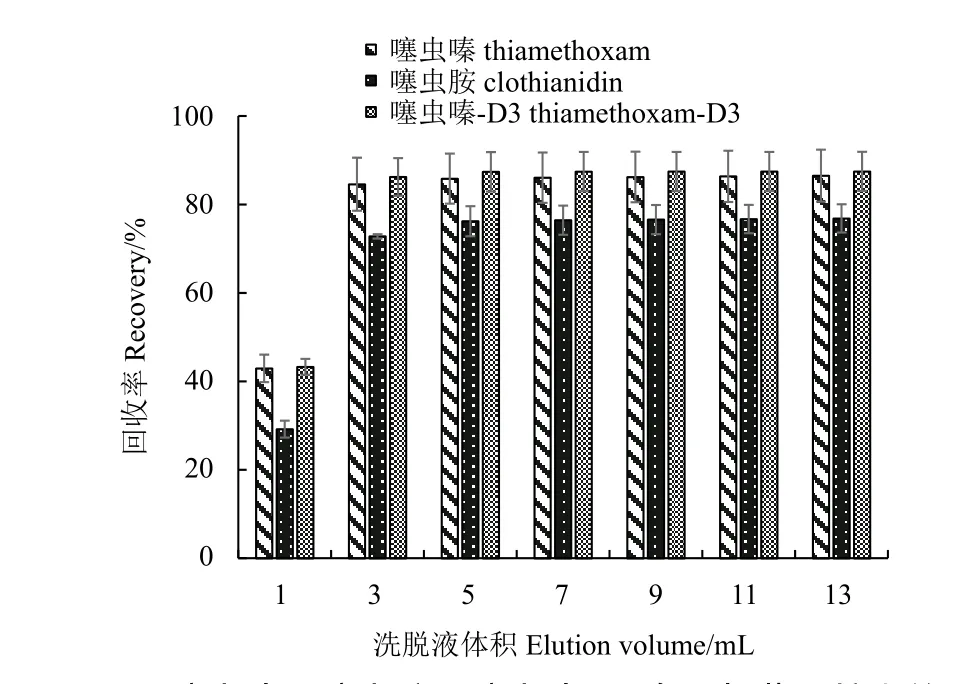
图3 噻虫嗪、噻虫胺及噻虫嗪-D3 在固相萃取柱上的溶剂标淋洗曲线 (V(乙腈) : V(甲苯) =3 : 1)Fig. 3 Solvent standard elution curve of thiamethoxam and clothianidin on solid phase extraction column(V(acetonitrile) : V (toluene)=3 : 1)
进一步增加洗脱体积,回收率基本保持不变,分析可能有以下几种原因:1) 噻虫嗪和噻虫胺化学结构中均含有亚氨基,而NH2/Carb 固相萃取柱填料中的氨基能与亚氨基形成氢键,导致其与噻虫嗪和噻虫胺结合紧密,难以被洗脱;2) NH2/Carb 固相萃取柱的填料Carb 在吸附色素的同时也易吸附环状结构,从而吸附了部分噻虫嗪和噻虫胺。
针对上述推测的第1 条原因,尝试向洗脱溶剂中加入H+,即V(1 %甲酸乙腈) :V(甲苯) =3 : 1,以便洗脱溶剂中的H+可与固相萃取柱填料中的氨基结合形成氢键,从而减少噻虫嗪、噻虫胺与填料中NH2的结合。结果发现回收率并未提高,当洗脱溶剂为5 mL 时,噻虫嗪、噻虫胺回收率达到峰值。此外又尝试了以石墨化碳黑 (Carb) 作为唯一填料的固相萃取柱并制作溶剂标淋洗曲线,结果与NH2/Carb 相似。通过以上两个验证试验,基本排除了猜测原因1 即噻虫嗪、噻虫胺与NH2/Carb固相萃取柱中填料的氨基形成氢键,而极有可能是NH2/Carb 固相萃取柱中的填料Carb 在吸附色素的同时,也吸附了部分带有环状结构的噻虫嗪、噻虫胺。
综合考虑,仍选择NH2/Carb 固相萃取柱,选择5 mLV(乙腈) :V(甲苯) = 3 : 1 作为最终的洗脱体积。
2.3 方法的线性方程、检出限、定量限及基质效应
从表3 中数据可以看出,噻虫嗪、噻虫胺无论是否经内标噻虫嗪-D3校正,其在0.001 ~ 0.5 mg/L范围内,进样质量浓度与其对应峰面积均呈现良好的线性关系,相关系数r均大于 0.99。以最低添加水平确定该分析方法对于噻虫嗪及噻虫胺的定量限 (LOQ) 均为0.001 mg/kg。

表3 噻虫嗪、噻虫胺在麦叶、麦穗及溶剂中的标准曲线回归方程参数Table 3 Linear regression parameters of calibration curve of thiamethoxam and clothianidin in acetonitrile, wheat leaves and ears
由表3 可以看出,麦叶、麦穗基质中噻虫嗪和噻虫胺的信号强度受到显著抑制,基质效应(Me) 为4.6% ~ 6.7 %,加入内标后,噻虫嗪和噻虫胺在麦穗中的Me分别为97.6 %和81.0 %,在麦叶中的分别为96.9 %和107.6 %。一般当Me值在90% ~ 110 %范围内通常认为不存在基质效应[22],即加入同位素内标后,麦叶中基质抑制效应得以消除,噻虫胺在麦穗中的基质抑制效应虽未完全消除,但基质效应得到有效补偿。因为目标分析物与其同位素标记物在麦叶、麦穗基质或纯溶剂中具有一致的信号响应强度,其比值基本保持恒定。
在0.001 ~ 0.5 mg/L 范围内,同位素内标法定量下的溶剂标准曲线及基质标准曲线线性良好。已有研究表明,待分析物峰面积与其同位素内标峰面积的比值在任何基质中均保持不变[23],因此我们利用同位素内标法作为定量方法,来进行麦叶和麦穗中噻虫嗪及噻虫胺浓度的准确定量。
2.4 方法的准确度、精确度和灵敏度
结果 (表4)表明,噻虫嗪及噻虫胺在0.001、0.01、0.1 和1 mg/kg 4 个添加水平下,麦叶中的平均回收率在83% ~ 113%之间, RSD 在2.8% ~10.3% 之间,麦穗中的平均回收率分别为87% ~118%,RSD 在1.6% ~ 13.0%之间,均符合农药残留分析要求[24]。

表4 噻虫嗪及噻虫胺在麦叶和麦穗中的添加回收率及相对标准偏差Table 4 Recoveries and RSDs of thiamethoxam and clothianidin in wheat leaves and ears
2.5 实际样品检测结果
对2021 年5 月从河北辛集采集的喷施25 %噻虫嗪水分散粒剂2 h 和3、5、7 和14 d 的麦叶和麦穗进行检测,结果见表5。

表5 无人机施药后14 d 内麦叶和麦穗中噻虫嗪及噻虫胺的残留量Table 5 Residues of thiamethoxam and thiamethoxam in wheat leaves and wheat ears within 14 days after UAV application
从检测结果可以看出,施药后2 h 麦叶和麦穗中噻虫嗪初始沉积量最高,且已有部分噻虫嗪代谢为噻虫胺,随着施药后时间的延长,噻虫嗪、噻虫胺均发生降解,同时噻虫嗪会继续代谢产生噻虫胺,施药后14 d 麦叶及麦穗中噻虫嗪的残留量分别为0.097 和0.031mg/kg,噻虫胺残留量分别为0.079 和0.046 mg/kg。麦叶中的噻虫嗪残留量普遍高于麦穗中的,主要是由于无人机喷雾方式下着药部位主要为小麦叶片。如图4 所示,噻虫嗪在麦叶和麦穗中的残留消解动态符合一级动力学方程,麦叶中降解曲线为y= 4.78e−0.27x(R2=0.938),麦穗中降解曲线为y= 1.55e−0.26x(R2=0.851),其降解半衰期分别为3.4 和4.7 d。

图4 无人机喷雾14 d 内噻虫嗪在麦叶和麦穗中的降解曲线Fig. 4 Degradation curve of thiamethoxam in wheat leaves and wheat ears within 14 days after application with plant protection UAV
吴绪金等[25]开展了25% 噻虫嗪水分散粒剂叶面喷雾于小麦的2 年3 地试验。结果发现:2011和2012 年,噻虫嗪在河南、黑龙江和江苏小麦植株上的消解半衰期在0.85 ~ 2.24 d 之间;施药后7和14 d,噻虫嗪在3 地小麦植株上的残留量分别在0.079 ~ 1.233 mg/kg 之间和0.032 ~ 0.365 mg/kg之间;残留量由高到低分别为小麦植株>土壤>麦粒,作者认为是由于噻虫嗪具有内吸性,茎叶喷雾施药后主要吸收和传导农药的部位是小麦植株,而且小麦还未到灌浆期,因此植株中残留量最高。
3 结论
本研究建立了超高效液相色谱-串联质谱(UPLC-MS/MS) 检测麦叶和麦穗中噻虫嗪及其代谢物噻虫胺痕量残留的快速分析方法。供试样品经乙腈提取、NH2/Carb 固相萃取柱净化,UPLCMS/MS 检测,内标法定量。方法的准确度、灵敏度和精密度均满足农药残留分析的要求[24]。该方法定量限可达到0.001 mg/kg,满足小麦全生育期残留检测的要求。运用该方法对植保无人机喷施噻虫嗪后的麦叶和麦穗样品进行检测,发现施药后2 h 麦叶和麦穗中噻虫嗪浓度最高,且已有代谢物噻虫胺产生,随着施药后天数的增加,噻虫嗪浓度逐渐下降,施药后14 d 噻虫胺在麦叶和麦穗中浓度均高于7 d,可能是噻虫嗪在降解的同时也不断产生代谢物噻虫胺。
