靶向蜕皮激素受体的新型4,5,6,7-四氢-2H-吲唑酰肼类衍生物的设计、合成及杀虫活性
2022-02-22郭兵博蒋标标董雅雯金小宇杨新玲
郭兵博, 蒋标标, 董雅雯, 金小宇,崔 丽, 张 莉*,, 杨新玲*,
(1. 中国农业大学 理学院 应用化学系 农药创新研究中心,北京 100193;2. 中国农业科学院 植物保护研究所,北京 100193)
昆虫生长调节剂 (insect growth regulators, 简称IGRs) 是一类高效、低毒、具有高选择性且对环境安全的特异性杀虫剂,被誉为21 世纪的理想农药。根据IGRs 的作用机制和化学结构不同,主要分为蜕皮激素及其类似物、几丁质及其抑制剂、保幼激素及其类似物[1-2]。其中蜕皮激素类似物通过与蜕皮激素受体 (EcR) 和超气门蛋白 (USP)形成异质二聚体导致昆虫过早蜕皮而死亡[3-4]。含有双酰肼 (DBHs) 结构的化合物如虫酰肼 (tebufenozide) 、甲氧虫酰肼 (methoxyfenozide) 和氯虫酰肼 (halofenozide) (图式1) 等是一类重要的非甾类蜕皮激素类似物,其发挥活性的重要基团为双酰肼结构,它们以EcR 为作用靶标,对鳞翅目昆虫具有良好的杀虫活性,能够诱导幼虫快速拒食和过早蜕皮,干扰正常的角质层并导致死亡,并且对哺乳动物和环境友好[5-7]。非甾类蜕皮激素激动剂具有优异的特性,但由于化学结构骨架单一,长期使用后昆虫对其已经产生抗性[8-10]。因此,对蜕皮激素激动剂进行结构改造是获得新型高活性蜕皮激素化合物的一条成功途径[11]。
吡唑并环结构类化合物具有杀虫、抑菌等生物活性[12-13]。Okada 等报道了一系列含吡唑并环结构的化合物,如A (图式1) 对小菜蛾Plutella xylostella具有较好的杀虫活性[12]。本课题组对吡唑并环类化合物也进行了一定的研究,首先基于EcR 亚基活性位点的构象相似性,发现了一种含叔丁基取代的吡唑环化合物B (3-(叔丁基)-N-( 4- (叔丁基)苯基-1-苯基-1H-吡唑-5-甲酰胺) (图式1) ,其对小菜蛾表现出良好的活性,在EcR 活性位点的结合口袋中和虫酰肼有相似的结合模式,表明B 可能是蜕皮激素类似物[14];随后将B 吡唑环上的叔丁基改为七元环以增强其疏水性,发现了化合物C (N-(4-(叔丁基)苯基)-2-苯基-2,4,5,6,7,8-六氢环庚基[C]吡唑-3-甲酰胺) (图式1) ,其在200 mg/L 下对小菜蛾的致死率为94%,蛋白结合试验和分子对接表明,C 能作用于EcR,与虫酰肼具有相似的结合模式,并且由于吡唑并环具有较强的疏水作用,占据了EcR 重要的疏水位置,对化合物活性的保持具有重要意义,是一类值得研究的新型IGRs 先导分子[15]。
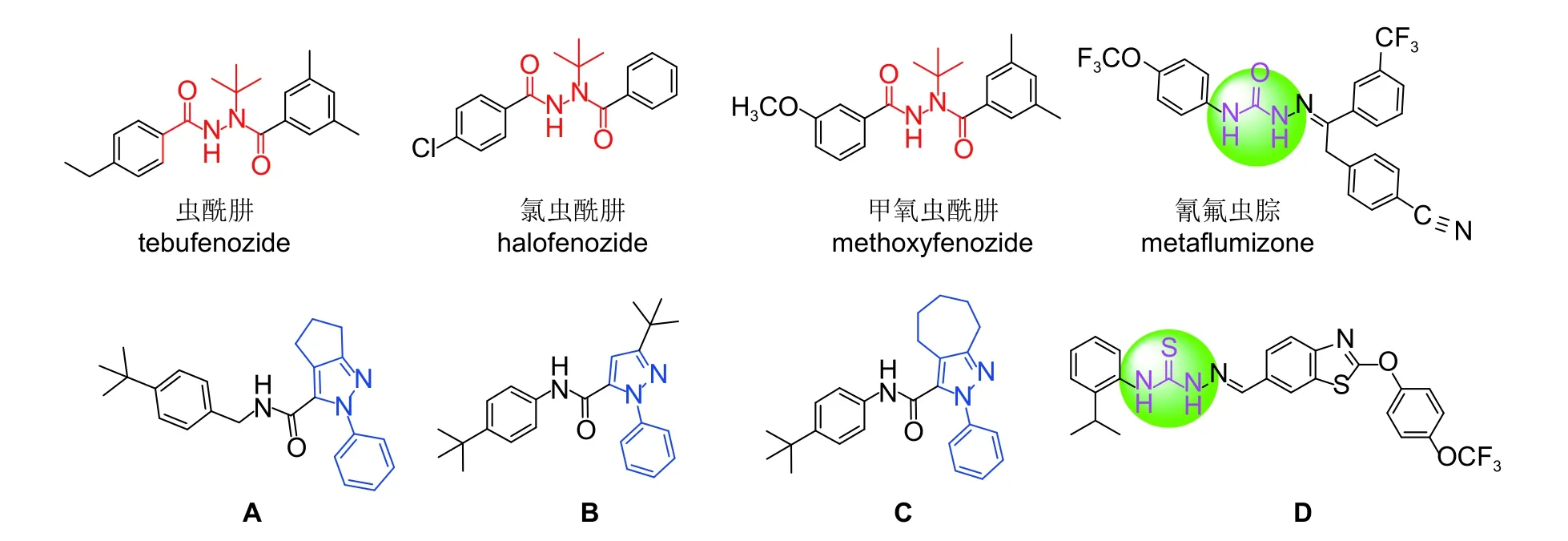
图式 1 虫酰肼、甲氧虫酰肼、氯虫酰肼、氰氟虫腙、A、B、C 和D 的结构式Scheme 1 Chemical structures of tebufenozide, methoxyfenozide, halofenozide, metaflumizone, A, B, C and D
此外,各大农药公司近年来开发出许多新型含氨基脲和氨基硫脲类化合物,如德国巴斯夫公司和日本农药公司联合开发的桥链含有氨基脲结构的氰氟虫腙 (metaflumizone,图式1) ,可以有效防治各种鳞翅目害虫 (如小菜蛾等) 及某些鞘翅目害虫的幼虫和成虫[16];先正达公司开发的桥链含有氨基硫脲结构的化合物D,对鳞翅目昆虫小菜蛾、海灰翅夜蛾幼虫等均具有较好的杀虫活性[17]。为了寻求高活性的蜕皮激素类似物,本文以化合物C 为先导化合物,通过活性亚结构拼接的方法,在其桥链部分引入氨基脲和氨基硫脲,以探讨其结构改变对杀虫活性的影响。目标化合物I 的设计思路如图式2 所示。

图式 2 目标化合物I 的分子设计思路Scheme 2 Design strategies of the target compounds I
本工作以环己酮为起始原料,通过克莱森酯缩合反应、Knorr 吡唑合成反应和亲核加成反应等合成方法得到一系列未见文献报道的目标化合物,其结构均经过核磁共振氢谱(1H NMR)、碳谱(13C NMR)和高分辨质谱(HRMS)确证,从分子对接和蛋白结合实验角度揭示目标化合物与EcR 的结合能力,并对其杀虫活性和构效关系进行了初步研究。目标化合物的合成路线如图式3所示。
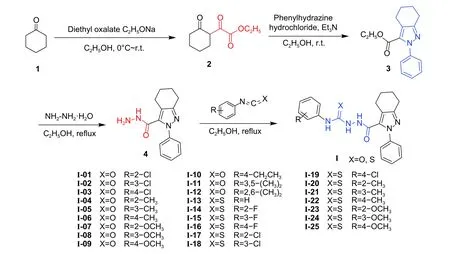
图式 3 目标化合物 I-01 ~ I-25 的合成路线Scheme 3 Synthetic routes of the target compounds I-01-I-25
1 实验部分
1.1 仪器与供试材料
FTICR-MS 7.0 质谱仪(美国瓦里安公司);Bruker Avance 300 型和Bruker Avance 600 型核磁共振仪(德国B r u k e r 公司),以四甲基硅烷(TMS)为内标;X-5 型数字显示显微熔点测试仪(北京富凯有限公司);闪烁计数器 (Hidex-300SL, 2 min/filter, 芬兰Hidex 公司)。柱层析硅胶,青岛海洋化工厂;[3H] PonA(tritiated PonA, 95 Ci/mmol,美国PerkinElmer 公司。Ci (居里)为放射性活度原用单位,国际单位为贝克Bq,1 Ci = 3.7 × 1010Bq);硝酸纤维素膜(NC45,德国Merck Millipore公司);Aquasol-2 玻璃小瓶(美国PerkinElmer 公司);其他试剂均为市售化学纯和分析纯。虫酰肼原药(纯度≥99%,上海阿拉丁生化科技股份有限公司)。
小菜蛾Plutella xylostella,由中国农业科学院植物保护研究所崔丽课题组提供。
1.2 化合物合成
1.2.1 中间体化合物的合成 中间体2、3 和4 参照文献方法合成[18-21]。
1.2.2 目标化合物I-01~I-25 的合成 以目标化合物I-25 的合成为例:参照文献方法[22], 向中间体4(0.50 g, 1.95 mmol)和对甲氧基苯基异硫氰酸酯(0.64 g, 3.90 mmol)中加入20 mL 无水乙醇,加热回流,薄层层析[TLC,V(石油醚)∶V(乙酸乙酯)=4∶1] 监测至化合物4 反应完全后,停止反应。抽滤,用少量无水乙醇洗涤,滤饼干燥,得到白色固体I-25 (0.74 g, 90%)。同法制备其余目标化合物。
1.3 分子对接
从PDB 蛋白数据库获取EcR 的晶体结构复合物 (PDB ID:3IXP),使用MMFF94 力场和电荷对化合物均进行构建和优化 (未去掉配体小分子) ,选择每种化合物的低能构象作为初始对接构象。每个配体分子保留30 个对接构象,保留得分最低的构象以进一步探究配体与蛋白质的相互作用。采用Molecular Operating Environment (MOE 2018.01)[23]建模软件进行分子对接,获得相应的打分值(Score) 。
1.4 EcR/USP 蛋白结合实验
参照文献方法[24-25],根据试剂盒 (Sigma-Aldrich,上海) 提取质量浓度超过500 ng/μL 的质粒,针对体外翻译的小菜蛾蜕皮激素受体 (EcR/USP) (PxEc 和PxUSP) 进行 [3H] PonA 放射性配体结合实验,具体方法如下:用于配体结合的反应测试体系共16 μL 混合物,包含3.2 μL 测试化合物的二甲基亚砜(DMSO) 溶液和4.8 μL[3H]PonA 乙醇溶液,其余均为低盐缓冲液(buffer),包含:5 mg/L 重组抑肽酶(aprotinin)、5 mg/L 抑肽素A(pepstatin)、5 mg/L 亮肽素(Leupepton)和100 mg/L 标准蛋白溶液(BSA) ,在25 °C 下孵育90 min。孵育结束后,立即将反应混合物通过硝酸纤维素膜过滤,并用3 mL 冰冷的洗涤缓冲液洗涤3 次。将该膜转移到装有2 mL Aquasol-2 的玻璃小瓶中,置于振荡器中进行溶剂化。使用液体闪烁计数器测量放射性。每组同时进行3 个平行实验。
1.5 杀虫活性测定
采用杀虫剂抗性行动委员会(IRAC)提出的浸叶法测定[26]。首先,将化合物I-01~I-25 (10 mg)和虫酰肼 (10 mg) 用1 mL 二甲基亚砜溶解,用含质量浓度0.05% 曲拉通(X-100)的水溶液连续稀释,配制成500 mg/L 的待测药液。将甘蓝叶片在药液中浸泡3s 后取出。对照组用含质量浓度为0.05%的曲拉通溶液处理。每组试验重复3 次(每次重复用10 只幼虫)。置于铺有滤纸的培养皿 (直径为10 cm) 中, 室温下干燥。在每个培养皿中接入2 龄小菜蛾幼虫10 头,于 (25 ± 2) °C、相对湿度为70% ± 20%、光/暗周期为14 h/10 h 的条件下培养, 96 h 后记录幼虫死亡率。以用刷子接触幼虫不能正常移动者视为死亡。
分别按公式 (1)和(2) 计算死亡率(P1)和校正死亡率(P2)。
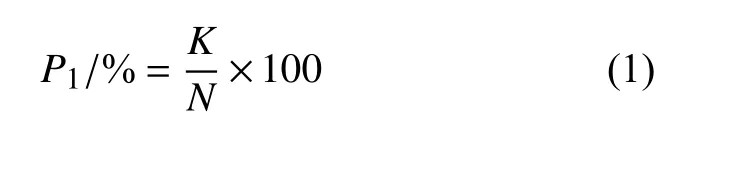

式中:K为死亡虫数;N为处理总虫数;P0为空白对照组的死亡率,%。
1.6 目标化合物I-01 ~ I-25 的脂水分配系数
通过ChemDraw Professional 16.0计算得到脂水分配系数 (ClogP)[27]。
2 结果与分析
2.1 化合物合成
以环己酮和草酸二乙酯为起始原料,在乙醇钠的作用下发生克莱森酯缩合反应得到六元-β酮酸酯(2)粗品,经柱层析分离、减压蒸馏得到酮酸酯(2)。采用Knorr 吡唑合成法将化合物2 制备成4,5,6,7-四氢-2H-吲唑-3-甲酸酯(3),再经过肼解,得到4,5,6,7-四氢-2H-吲唑-3-甲酰肼(4),将中间体4 与相应取代的异氰酸酯或异硫氰酸酯通过亲核加成反应,得到目标化合物I-01 ~ I-25。其结构表征数据如下。
N-(2-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基) 肼-1-甲酰胺(I-01):白色固体, 产率90%, m.p. 242-243 ℃.1H NMR (600 MHz, DMSO-d6),δ: 9.87 (s, 1H), 9.00(s, 1H), 8.27 (s, 1H), 7.71 (s, 1H), 7.66 (d,J= 7.6 Hz, 2H),7.56 (t,J= 7.9 Hz, 2H), 7.44 (t,J= 7.4 Hz, 1H), 7.37 (s, 1H),7.27 (t,J= 8.1 Hz, 1H), 7.01 – 6.97 (m, 1H), 2.79 – 2.69 (m,4H), 1.78 – 1.69 (m, 4H).13C NMR (151 MHz, DMSO-d6),δ:162.8, 142.1, 141.9, 140.6, 139.5, 133.5, 130.7, 129.8, 128.1,123.8, 121.8, 119.6, 118.3, 117.3, 56.5, 23.3, 22.7, 22.5, 21.7,19.0. HRMS(ESI): C21H20ClN5O2[M + H]+, 测量值410.1378, 计算值410.1380.
N-(3-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-02): 白色固体,产率87%, m.p. 228-229 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.23 (s, 1H), 9.14(s, 1H), 8.55 (s, 1H), 7.72 (t,J= 1.9 Hz, 1H), 7.59 – 7.52 (m,2H), 7.45 – 7.28 (m, 5H), 7.07 – 7.00 (m, 1H), 2.76 (t,J=5.4 Hz, 2H), 2.69 (t,J= 5.4 Hz, 2H), 1.86 – 1.67 (m, 4H).13C NMR (75 MHz, DMSO-d6),δ: 161.0, 155.1, 149.3, 141.4,139.9, 133.3, 132.1, 130.5, 128.9, 126.8, 122.9, 121.7, 119.2,117.8, 116.9, 60.6, 22.9, 22.8, 22.7, 20.5, 14.6. HRMS(ESI):C21H20ClN5O2[M + H]+, 测量值410.1378, 计算值410.1371.
N-(4-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-03):白色固体,产率93%, m.p. 225-226 ℃.1H NMR (300 MHz, DMSO-d6),δ:10.22 (s, 1H), 9.05(s, 1H), 8.47 (s, 1H), 7.55 (t,J= 7.8 Hz, 4H), 7.41 (t,J=7.7 Hz, 2H), 7.37 – 7.27 (m, 3H), 2.72 (dt, J = 11.1, 6.0 Hz,4H), 1.89 – 1.66 (m, 4H).13C NMR (75 MHz, DMSO-d6),δ:161.0, 155.2, 149.3, 139.9, 138.8, 132.1, 128.9, 128.7, 126.8,125.6, 122.9, 120.0, 119.2, 22.9, 22.8, 22.7, 20.5. HRMS(ESI):C21H20ClN5O2[M + H]+, 测量值410.1378, 计算值410.1372.
N-(2-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-04):白色固体,产率85%, m.p. 241-242 ℃.1H NMR (600 MHz, DMSO-d6),δ: 10.19 (s, 1H), 8.76(s, 1H), 8.33 (s, 1H), 7.56 – 7.52 (m, 2H), 7.40 (t,J= 7.8 Hz,2H), 7.34 – 7.22 (m, 3H), 7.18 – 7.10 (m, 1H), 6.79 (d,J=7.5 Hz, 1H), 2.74 (t,J= 6.0 Hz, 2H), 2.67 (t,J= 6.0 Hz,2H), 2.27 (s, 3H), 1.83 – 1.76 (m, 2H), 1.75 – 1.68 (m, 2H).13C NMR (151 MHz, DMSO-d6),δ: 161.4, 155.6, 149.7, 140.2,140.0, 138.4, 132.5, 129.3, 129.1, 127.2, 123.8, 123.2, 123.1,119.5, 119.3, 116.0, 23.3, 23.2, 23.0, 21.7, 20.8. HRMS(ESI): C22H23N5O2[M + H]+, 测量值390.1925, 计算值390.1926.
N-(3-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺(I-05):白色固体,产率93%, m.p. 215-216 ℃.1H NMR (600 MHz, DMSO-d6),δ: 9.81 (s, 1H), 8.68(s, 1H), 8.06 (s, 1H), 7.66 (d,J= 7.8 Hz, 2H), 7.55 (t,J=7.8 Hz, 2H), 7.44 (t,J= 7.4 Hz, 1H), 7.36 (d,J= 8.2 Hz, 2H),7.06 (d,J= 8.2 Hz, 2H), 2.79 – 2.68 (m, 4H), 2.23 (s, 3H),1.78 – 1.66 (m, 4H).13C NMR (151 MHz, DMSO-d6),δ:162.8, 142.1, 140.5, 139.5, 137.7, 131.0, 129.8, 129.6, 129.5,128.1, 123.7, 119.6, 118.9, 60.5, 23.4, 22.7, 22.5, 21.7, 20.8,15.0. HRMS(ESI): C22H23N5O2[M + H]+, 测量值390.1925,计算值390.1919.
N-(4-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺(I-06):白色固体,产率90%, m.p. 235-236 ℃.1H NMR (600 MHz, DMSO-d6),δ: 10.33 (s, 1H), 8.90(s, 1H), 8.17 (s, 1H), 8.09 (dd,J= 7.9, 1.2 Hz, 1H), 7.51 (d,J= 7.8 Hz, 2H), 7.41 (t,J= 7.9 Hz, 2H), 7.30 (t,J= 7.4 Hz,1H), 7.03 – 7.00 (m, 1H), 6.95 (td,J= 7.8, 1.5 Hz, 1H), 6.90(td,J= 7.9, 1.0 Hz, 1H), 3.85 (s, 3H), 2.74 (t,J= 5.8 Hz, 2H),2.67 (t,J= 5.8 Hz, 2H), 1.83 – 1.70 (m, 4H).13C NMR (151 MHz, DMSO-d6),δ: 161.5, 155.4, 149.7, 148.0, 140.2, 132.3,129.3, 128.8, 127.3, 123.2, 122.5, 121.1, 119.5, 118.7, 111.2,56.2, 23.3, 23.2, 23.0, 20.8. HRMS(ESI): C22H23N5O2[M +H]+, 测量值390.1925, 计算值: 390.1917.
N-(2-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-07):白色固体,产率86%, m.p. 233-234 ℃.1H NMR (600 MHz, DMSO-d6),δ: 10.20 (s, 1H), 8.89(s, 1H), 8.38 (s, 1H), 7.55 (dd,J= 8.4, 0.9 Hz, 2H), 7.39 (t,J=7.8 Hz, 2H), 7.30 (t,J= 7.4 Hz, 1H), 7.17 (dd,J= 9.4, 6.9 Hz,2H), 7.03 – 6.98 (m, 1H), 6.55 (dd,J= 8.0, 2.2 Hz, 1H), 3.73(s, 3H), 2.74 (t,J= 6.1 Hz, 2H), 2.67 (t,J= 6.1 Hz, 2H), 1.83 –1.69 (m, 4H).13C NMR (151 MHz, DMSO-d6),δ: 161.4,160.1, 155.5, 149.6, 141.3, 140.2, 132.4, 130.0, 129.2, 127.2,123.2, 119.5, 111.1, 107.7, 104.6, 55.4, 23.3, 23.2, 23.0, 20.9.HRMS(ESI): C22H23N5O3[M + H]+, 测量值406.1874, 计算值406.1865.
N-(3-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-08):白色固体,产率87%, m.p. 218-219 ℃.1H NMR (600 MHz, DMSO-d6),δ: 9.79 (d,J= 1.1 Hz,1H), 8.58 (s, 1H), 8.02 (s, 1H), 7.66 (d,J= 7.5 Hz, 2H), 7.55(t,J= 7.9 Hz, 2H), 7.44 (t,J= 7.4 Hz, 1H), 7.37 (d,J= 9.0 Hz, 2H), 6.87 – 6.81 (m, 2H), 3.70 (s, 3H), 2.78 – 2.68 (m,4H), 1.77 – 1.68 (m, 4H).13C NMR (151 MHz, DMSO-d6),δ:162.8, 156.2, 154.9, 142.2, 140.5, 139.5, 133.3, 129.8, 128.1,123.7, 120.6, 119.58, 114.38, 114.3, 55.6, 23.4, 22.8, 22.5,21.7, 19.0. HRMS(ESI): C22H23N5O3[M + H]+, 测量值406.1874, 计算值406.1866.
N-(4-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺(I-09):白色固体,产率82%, m.p. 233-234 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.18 (s, 1H), 8.66(s, 1H), 8.27 (s, 1H), 7.60 – 7.53 (m, 2H), 7.45 – 7.36 (m, 4H),7.31 (t,J= 7.3 Hz, 1H), 6.92 – 6.85 (m, 2H), 3.73 (s, 3H), 2.75(t,J= 5.7 Hz, 2H), 2.68 (t,J= 5.7 Hz, 2H), 1.86 – 1.68 (m,4H).13C NMR (75 MHz, DMSO-d6),δ: 161.1, 155.5, 154.7,149.3, 139.9, 132.8, 132.2, 128.9, 126.8, 122.9, 120.3, 119.1,114.1, 55.3, 22.9, 22.8, 22.7, 20.5. HRMS(ESI): C22H23N5O3[M + H]+, 测量值406.1874, 计算值406.1866.
N-(4-乙基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺(I-10):白色固体,产率85%, m.p. 234-235 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.18 (s, 1H), 8.90(s, 1H), 8.45 (s, 1H), 7.61 – 7.53 (m, 2H), 7.43 – 7.37 (m, 4H),7.32 (d,J= 7.4 Hz, 1H), 7.13 (d,J= 8.4 Hz, 2H), 2.76 (t,J=5.6 Hz, 2H), 2.69 (t,J= 5.6 Hz, 2H), 2.57 (dd,J= 9.7, 5.4 Hz,2H), 1.88 – 1.67 (m, 4H), 1.17 (t,J= 7.6 Hz, 3H).13C NMR(75 MHz, DMSO-d6),δ: 161.1, 156.3, 155.3, 149.3, 139.9,137.4, 137.2, 128.9, 128.0, 126.8, 122.9, 119.1, 118.6, 27.7,22.9, 22.7, 20.5, 15.9. HRMS(ESI): C23H25N5O2[M + H]+, 测量值404.2081, 计算值404.2074.
N-(3,5-二甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺 (I-11):白色固体,产率78%, m.p. 250-251 ℃.1H NMR (600 MHz, DMSO-d6),δ: 9.81 (s, 1H), 8.07(s, 1H), 7.88 (s, 1H), 7.66 (dd,J= 8.5, 1.0 Hz, 2H), 7.54 (t,J=7.9 Hz, 2H), 7.42 (t,J= 7.4 Hz, 1H), 7.05 – 6.99 (m, 3H), 2.77– 2.70 (m, 4H), 2.20 (s, 6H), 1.78 – 1.67 (m, 4H).13C NMR(151 MHz, DMSO-d6),δ: 162.8, 156.9, 142.3, 140.4, 139.6,136.4, 135.9, 129.8, 128.0, 128.0, 126.3, 123.7, 119.55, 23.4,22.8, 22.5, 21.7, 18.7. HRMS(ESI): C23H25N5O2[M + H]+, 测量值404.2081, 计算值404.2073.
N-(2,6-二甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-甲酰胺(I-12):白色固体,产率72%, m.p. 247-248 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.14 (s, 1H), 8.33(s, 1H), 7.91 (s, 1H), 7.62 – 7.50 (m, 2H), 7.47 – 7.24 (m, 3H),7.08 (s, 3H), 2.74 (t,J= 5.6 Hz, 2H), 2.68 (t,J= 5.8 Hz, 2H),2.20 (s, 6H), 1.86 – 1.64 (m, 4H).13C NMR (75 MHz, DMSOd6),δ: 161.1, 156.2, 149.2, 139.9, 136.1, 135.4, 132.2, 128.8,127.8, 126.7, 126.2, 122.9, 119.2, 22.9, 22.8, 22.7, 20.5, 18.3.HRMS(ESI): C23H25N5O2[M + H]+, 测量值404.2081,计算值404.2074.
N-苯基-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-13):白色固体,产率92%, m.p. 191-192 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.37 (s, 1H), 9.83 (s, 2H),7.59 (d,J= 7.2 Hz, 2H), 7.51 (d,J= 7.2 Hz, 2H), 7.45 – 7.24(m, 5H), 7.18 (t,J= 7.1 Hz, 1H), 2.83 (t,J= 4.9 Hz, 2H), 2.68(t,J= 5.3 Hz, 2H), 1.91 – 1.58 (m, 4H).13C NMR (75 MHz,DMSO-d6),δ: 181.3, 161.9, 141.8, 140.2, 139.5, 139.3, 139.1,129.5, 128.3, 128.1, 127.8, 124.8, 123.4, 119.5, 23.1, 22.4,22.2, 21.4. HRMS(ESI): C21H21N5OS [M + H]+, 测量值量值392.1540, 计算值392.1534.
N-(2-氟苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-14):白色固体,产率70%, m.p.152-153 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.81 – 9.18(m, 3H), 7.57 (m, 3H), 7.46 – 7.13 (m, 6H), 2.93 – 2.60 (m,4H), 1.90 – 1.61 (m, 4H).13C NMR (75 MHz, DMSO-d6),δ:183.0, 160.0, 149.3, 140.0, 131.7, 128.8, 127.8, 126.9, 124.2,123.5, 119.5, 116.0, 115.7, 23.0, 22.8, 22.7, 20.7.19F NMR(282 MHz, DMSO-d6),δ: −126.4. HRMS(ESI): C21H20FN5OS[M + H]+, 测量值432.1265, 计算值432.1263.
N-(3-氟苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-15):白色固体,产率72%, m.p.183-184 ℃.1H NMR (300 MHz, DMSO-d6),δ: 11.26 (s, 1H),9.99 (s, 2H), 7.59 (d,J= 6.9 Hz, 3H), 7.47 – 7.24 (m, 5H),7.00 (t,J= 7.6 Hz, 1H), 2.83 (t,J= 5.1 Hz, 2H), 2.68 (t,J=5.2 Hz, 2H), 1.89 – 1.61 (m, 4H).13C NMR (75 MHz, DMSOd6),δ: 181.9, 161.8 (d,JCF= 241.8 Hz), 159.9, 149.3, 141.1 (d,JCF=10.8 Hz), 141.0, 131.8, 130.0 (d,JCF= 8.8 Hz), 128.7, 127.0,123.5, 119.5, 111.27 (d,JCF= 19.7 Hz), 23.0, 22.8, 22.7, 20.7.HRMS(ESI): C21H20FN5OS [M + H]+, 测量值432.1265, 计算值432.1268.
N-(4-氟苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺 (I-16):白色固体,产率76%, m.p.193-194 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.17 (s, 1H),9.85 (s, 2H), 7.59 (d, J = 7.4 Hz, 2H), 7.53 – 7.44 (m ,2H),7.43 – 7.28 (m, 3H), 7.26 – 7.16 (m, 2H), 2.82 (t, J = 5.7 Hz,2H), 2.68 (t, J = 5.7 Hz, 2H), 1.87 – 1.66 (m, 4H).13C NMR(75 MHz, DMSO-d6),δ: 182.2, 159.9, 159.50 (d,JCF= 241.8 Hz), 149.3, 140.1, 135.50(d,JCF=2.4 Hz), 131.8, 128.7, 126.9,126.8, 123.6, 119.5, 115.1 (d,JCF=22.3 Hz), 22.9, 22.8, 22.7,20.7. HRMS(ESI): C21H20FN5OS [M + H]+, 测量值432.1265,计算值432.1262.
N-(2-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺 (I-17):白色固体,产率85%, m.p.187-188 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.31 (s, 1H),9.88 (s, 1H), 9.47 (s, 1H), 7.75 – 7.52 (m, 5H), 7.51 – 7.18 (m,4H), 2.86 – 2.65 (m, 4H), 1.85 – 1.65 (m, 4H).13C NMR(75 MHz, DMSO-d6),δ: 181.9, 162.2, 141.6, 140.3, 139.1,136.7, 129.4, 129.4, 127.8, 127.5, 127.1, 123.4, 119.5, 23.0,22.4, 22.1, 21.3. HRMS(ESI): C21H20ClN5OS [M + H]+, 测量值448.0969, 计算值448.0966.
N-(3-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-18):白色固体,产率89%, m.p.196-197 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.31 (s, 1H),9.89 (s, 1H), 9.47 (s, 1H), 7.74 – 7.39 (m, 7H), 7.38 – 7.12 (m,2H), 2.85 – 2.69 (m, 4H), 1.84 – 1.66 (m, 4H).13C NMR (75 MHz, DMSO-d6),δ: 181.9, 162.2, 141.6, 140.3, 139.1, 136.7,129.4, 129.4, 127.8, 127.4, 127.1, 123.4, 119.5, 23.0, 22.4,22.1, 21.3. HRMS(ESI): C21H20ClN5OS [M + H]+, 测量值448.0969,计算值448.0971.
N-(4-氯苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-19):白色固体,产率83%, m.p.191-192 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.84 – 9.54(m, 3H),7.66 – 7.51 (m, 4H), 7.47 – 7.27 (m, 5H), 2.92 – 2.60(m, 4H), 1.88 – 1.65 (m, 4H).13C NMR (75 MHz, DMSO-d6),δ: 181.9, 159.9, 149.3, 140.1, 138.2, 131.8, 128.7, 128.4,127.0, 126.0, 123.6, 119.5, 23.0, 22.8, 22.7, 20.7. HRMS(ESI): C21H20ClN5OS [M + H]+, 测量值448.0969, 计算值448.0969.
N-(2-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-20):白色固体,产率88%, m.p.175-176 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.20 (s, 1H),9.73 (s, 1H), 9.42 (s, 1H), 7.60 (d,J= 7.0 Hz, 2H), 7.43 – 7.30(m, 3H), 7.30 – 7.13 (m, 4H), 2.83 (t,J= 5.2 Hz, 2H), 2.67 (t,J= 5.5 Hz, 2H), 2.21 (s, 3H), 1.87 – 1.64 (m, 4H).13C NMR(75 MHz, DMSO-d6),δ: 182.5, 160.0, 149.2, 140.1, 137.7,135.6, 131.8, 130.4, 128.7, 126.9, 126.2, 123.6, 119.5, 23.0,22.8, 22.7, 20.7, 17.8. HRMS(ESI): C22H23N5OS [M + H]+, 测量值406.1696, 计算值406.1689.
N-(3-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-21):白色固体,产率83%, m.p.167-168 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.69 – 9.34(m, 3H), 7.60 (d,J= 7.4 Hz, 2H), 7.46-7.18 (m, 6H), 7.00 (d,J= 7.3 Hz, 1H), 2.82 (t,J= 5.3 Hz, 2H), 2.68 (t,J= 5.5 Hz,2H), 2.32 (s, 3H), 1.87 – 1.63 (m, 4H).13C NMR (75 MHz,DMSO-d6),δ: 181.9, 160.0, 149.3, 140.1, 139.0, 137.8, 131.8,128.7, 128.4, 126.9, 125.7, 124.9, 123.5, 121.6, 119.5, 23.0,22.8, 22.7, 21.2, 20.7. HRMS(ESI): C22H23N5OS [M + H]+, 测量值406.1696, 计算值406.1689.
N-(4-甲基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-22):白色固体,产率85%, m.p.173-174 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.32 (s, 1H),9.75 (s, 2H), 7.60 (d,J= 6.5 Hz, 2H), 7.47 – 7.26 (m, 5H),7.17 (d,J= 7.7 Hz, 2H), 2.82 – 2.58 (m, 4H), 2.31 (s, 3H),1.90 – 1.62(m, 4H).13C NMR (75 MHz, DMSO-d6),δ: 181.93,159.95, 149.25, 140.06, 136.55, 134.27, 131.84, 128.97,128.74, 126.92, 124.51, 123.53, 119.47, 22.96, 22.82, 22.71,20.67. HRMS(ESI): C22H23N5OS [M + H]+, 测量值406.1696, 计算值406.1689.
N-(2-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺 (I-23):白色固体,产率70%, m.p.151-152 ℃.1H NMR (300 MHz, DMSO-d6),δ10.62 (s, 1H),10.07 (s, 1H), 9.45 – 8.60 (m, 1H), 8.12 (s, 1H), 7.55 (s, 2H),7.45 – 7.25 (m, 3H), 7.23 – 6.89 (m, 3H), 3.83 (s, 3H), 2.92 –2.60 (m, 4H), 1.80 – 1.65 (m, 4H).13C NMR (75 MHz,DMSO-d6),δ: 180.0, 160.2, 151.0, 149.4, 139.9, 131.7, 128.9,127.6, 127.0, 125.7, 123.3, 120.0, 119.5, 111.5, 55.9, 22.9,22.8, 22.7, 20.7. HRMS(ESI): C22H23N5O2S [M + H]+, 测量值444.1465, 计算值444.1469.
N-(3-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺(I-24):白色固体,产率68%, m.p.183-184 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.36 (s, 1H),9.81 (s, 2H), 7.59 (d,J= 7.4 Hz, 2H), 7.45 – 7.20 (m, 5H), 7.07(d,J= 7.9 Hz, 1H), 6.75 (dd,J= 8.2, 1.9 Hz, 1H), 3.76 (s, 3H),2.83 (t,J= 5.4 Hz, 2H), 2.68 (t,J= 5.5 Hz, 2H), 1.87 – 1.67 (m,4H).13C NMR (75 MHz, DMSO-d6),δ: 159.9, 159.4, 149.3,140.3, 140.0, 131.8, 129.3, 128.8, 126.9, 123.5, 119.5, 110.4,55.2, 23.0, 22.8, 22.7, 20.7. HRMS(ESI): C22H23N5O2S [M + H]+,测量值444.1465, 计算值444.1465.
N-(4-甲氧基苯基)-2-(2-苯基-4,5,6,7-四氢-2H-吲唑-3-羰基)肼-1-硫代甲酰胺 (I-25):黄色固体,产率71%, m.p.139-140 ℃.1H NMR (300 MHz, DMSO-d6),δ: 10.30 (s, 1H),9.69 (s, 2H), 7.60 (d,J= 7.6 Hz, 2H), , 7.44 – 7.29 (m, 5H),7.04 – 6.89 (m, 3H), 3.77 (s, 3H), 2.82 (t,J= 5.6 Hz, 2H), 2.68(t,J= 5.6 Hz, 2H), 1.88 – 1.66 (m, 4H).13C NMR (75 MHz,DMSO-d6),δ: 160.0, 158.7, 156.9, 149.3, 140.1, 131.9, 131.8,128.7, 127.5, 126.9, 123.6, 119.5, 115.3, 113.7, 55.4, 23.0,22.8, 22.7, 20.7. HRMS(ESI): C22H23N5O2S [M + H]+, 测量值444.1465, 计算值444.1464.
2.2 分子对接结果及蛋白结合活性分析
首先,从理论角度研究目标化合物与靶标结合的可能性。采用Molecular Operating Environment(MOE 2018.01) 软件,选择EcR 靶标蛋白晶体结构(PDB ID: 3IXP)对所有目标化合物进行分子对接。基于对接打分值 (表1) 推测,所有化合物与EcR 均具有不同程度的结合。其中I-7、I-9、I-13 和I-15 的分子对接打分值与先导化合物C (−8.32)和对照药剂虫酰肼 (−9.01) 的打分值相近,推测它们与靶标蛋白之间可能有较好的结合力。

表1 目标化合物I-01 ~ I-25 的ClogP 值、分子对接打分值和杀虫活性Table 1 ClogP, score and insecticidal activities of the target compounds I-01-I-25
其次,为了研究化合物和受体蛋白的结合模式,随机选择化合物I-15 和虫酰肼分别对接到EcR 活性口袋中。结果 (图1) 显示,I-15 酰胺键羰基氧原子可以和Tyr408 形成氢键,I-15 和虫酰肼有相似的结合模式。

图1 I-15 (蓝色) 和虫酰肼 (绿色) 在EcR活性位点的结合模式Fig. 1 Predicted binding modes of compounds I-15 (blue)and tebufenozide (green) in the active site of EcR
进一步靶标蛋白实验结果(图2) 表明,在质量浓度为40 mg/L 时,I-15 与EcR 有较好的结合活性 (75.8%±7.2%) , 但不及虫酰肼 (93.7%±2.6%) 。
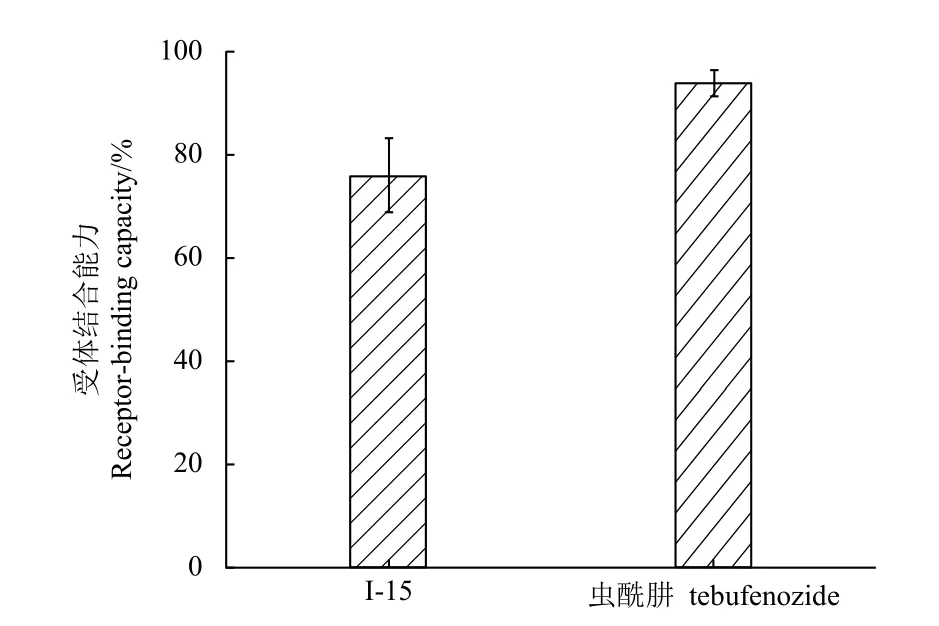
图2 I-15 和虫酰肼与PxEcR-PxUSP 的结合活性Fig. 2 Binding activity of compounds I-15 and tebufenozide against PxEcR-PxUSP
2.3 杀虫活性
测定结果(表1)表明:在500 mg/L 下,部分化合物 (如I-01 和I-23)对小菜蛾具有一定的杀虫活性,但活性均不如先导化合物C 及对照药剂虫酰肼。初步构效关系分析可知,取代基的位置对活性有影响,当取代基处于邻位时对活性有利,例如:当X 为氧,R 为氯时,邻位取代化合物对小菜蛾的致死率由高到低顺序为:I-01 (R=2-Cl) >I-02 (R=3-Cl) > I-03 (R=4-Cl) ,当X 为硫,R 为甲氧基时,邻位取代化合物对小菜蛾的致死率由高到低顺序为:I-23 (R=2-OCH3) > I-24 (R=3-OCH3) >I-25 (R=4-OCH3) 。此外,邻位取代基相同时,X 的类别对活性也有一定影响。当R 为2-Cl 时,化合物对小菜蛾的致死率由高到低顺序为:I-01(X=O) > I-17 (X=S) ;当R 为2-OCH3时,化合物对小菜蛾的致死率由高到低顺序为: I-23 (X=S) >I-07 (X=O) 。因此,当先导化合物C 的苯环邻位为吸电子取代基时,在酰胺桥链引入氨基脲可能对活性有利;当先导化合物C 的苯环邻位为给电子取代基时,在酰胺桥链引入氨基硫脲可能对活性有利。
从表1 数据可以看出,目标化合物的分子对接打分值与活体杀虫活性之间无规律可循,例如,化合物I-15 虽然与EcR 的分子对接打分值较高,且有较好的蛋白结合活性,但对小菜蛾则完全没有活体活性。进一步分析原因发现,目标化合物的ClogP在2.738 ~ 4.319 之间,普遍低于先导化合物C (ClogP= 6.626) 和对照药剂虫酰肼(ClogP= 4.509) ,新合成化合物的亲脂性较弱,不易穿透昆虫表皮的细胞膜,这可能是导致杀虫活性较弱的原因。因此,在下一步的结构优化工作中,如何提高化合物的脂溶性是需要重点考虑的因素。
3 结论
本文以前期发现的吡唑并环酰胺类化合物C 为先导,以蜕皮激素受体(EcR)为靶标,通过活性亚结构拼接设计并合成了一系列4,5,6,7-四氢-2H-吲唑酰肼类化合物,其结构均经过1H NMR、13C NMR 和HRMS 确证。分子对接研究发现化合物I-15 可以很好地结合EcR 的活性位点,与虫酰肼有相似的结合模式;进一步靶标蛋白结合实验证明,化合物I-15 与EcR 具有较高的结合活性。初步杀虫活性测定结果表明,目标化合物对2 龄小菜蛾有一定的致死率,但总体活性较差。进一步分析发现,化合物的亲脂性较低,可能是导致其杀虫活性较差的原因。本文研究结果表明,在先导化合物C 桥链酰胺上引入氨基脲或氨基硫脲对杀虫活性不利,这为后续化合物的结构优化提供了重要参考价值,即如何提高化合物的亲脂性是结构优化时需要重点考虑的因素。
