TIPE2通过抑制Akt磷酸化促进LPS活化的巨噬细胞凋亡①
2022-02-21丛丽谢小林刘素娟向丽萍符晓华
丛丽 谢小林 刘素娟 向丽萍 符晓华
(湖南师范大学小分子靶向药物研究与创制实验室,长沙 410013)
心血管疾病是全球死亡最常见原因之一,其病死人数约占全球总死亡人数的31%,且在全球医疗保健支出中占比较高[1-2]。动脉粥样硬化是心血管疾病重要的病理生理基础,是不稳定型心绞痛、心源性猝死、卒中的根本原因[3]。巨噬细胞在动脉粥样硬化病变过程中扮演重要角色,是主要的炎症细胞,也是不稳定型斑块的重要特征[4]。活化的巨噬细胞可产生炎症细胞因子、蛋白酶、活性氧、氮自由基分子等,促使巨噬细胞向炎症性巨噬细胞转化,并降低其清除死亡细胞的能力,促进动脉粥样硬化发展[5]。活化的巨噬细胞凋亡在动脉粥样硬化各阶段均发挥重要调节作用,既可抑制早期病变进展,又可促进晚期坏死核形成,增加斑块脆性及促进血栓形成[6-7]。因此,探索促进活化巨噬细胞凋亡的分子机制对心血管疾病防治具有重要临床意义。
肿瘤坏死因子α诱导蛋白8样分子2(tumor necrosis factor-α-induced protein 8-like 2,TIPE2)是一种先天免疫负调控因子,在巨噬细胞、B淋巴细胞和T淋巴细胞中持续表达[8-9]。TIPE2主要通过抑制T细胞受体和Toll样受体调控下游信号通路,维持免疫稳态[10];此外,TIPE2也可与Caspase-8结合,抑制激活蛋白-1和核转录因子-κB活化,促进Fas介导的细胞凋亡[11]。蛋白激酶B(protein kinase B,PKB)/Akt是一种丝氨酸/苏氨酸蛋白激酶,在调控细胞存活和凋亡中具有重要作用,PI3K/Akt是调控细胞凋亡的主要信号通路[12]。研究表明TIPE2可靶向RGL-PDK1和PI3K-rac抑制Akt信号转导,且能通过下调Akt和ERK1/2信号通路激活内源性凋亡途径抑制胃癌生长[13-15]。据此,课题组推测TIPE2/Akt信号通路可能在调控活化巨噬细胞凋亡中发挥重要作用。
本研究以内毒素的重要特异性抗原——脂多糖(lipopolysaccharides,LPS)活化的RAW264.7细胞为研究对象,采用慢病毒载体和Akt磷酸化激动剂深入探讨TIPE2对活化巨噬细胞凋亡的作用及机制,以期为动脉粥样硬化防治策略提供实验依据。
1 材料与方法
1.1 材料LPS(L8880)购自Solarbio;高糖DMEM培养基(010521ACS)、胎牛血清(040011ACS)、链霉素/青霉素、PBS缓冲液(020231ACS)购自以色列Bioind公 司;TRIzol(R401-01)、HiScript®ⅡQ RT SuperMix for qPCR(+gDNA wiper)(R223-01)、AceQ®qPCR SYBR Green Master Mix(Q111-02)、CCK-8试剂盒(A311-01)、Annexin V-FITC/PI细胞凋亡检测试剂盒(A211-01)、Tunel凋亡试剂盒(A112-01)购自南京Vazyme公司;RIPA细胞裂解液、BCA蛋白定量试剂盒(P0012S)购自上海Beyotime公司;慢病毒颗粒购自上海Genechem公司;cleaved Caspase-8(AF5267)、cleaved Caspase-3(AF7022)、TIPE2(DF3326)抗体购自美国Affinity公司;Bax(YM3619)、Bcl-2(YM3041)、Akt(YM3618)、p-AktSer473(YP0006)抗 体 购 自美国ImmunoWay公司;CHOP(2895T)抗体购自美国Cell Signaling Technology公司;β-actin(CW0096)抗体和GAPDH(CW0100)抗体购自江苏CWBIO公司;兔IgG(CW0156S)和鼠IgG(CW0102S)购自北京Com‑Win Biotech公司。
1.2 方法
1.2.1 细胞培养与处理RAW264.7细胞株来源于中国科学院典型培养物保藏委员会细胞库(上海),由本实验室保存。细胞复苏后,常规培养于DMEM培养基(含10%胎牛血清、1 000 U/ml青霉素、100 U/ml链霉素),置于37℃、5%CO2、饱和湿度中继续培养,每天观察细胞。将处于对数生长期的细胞接种于6孔板(1×106个/ml),采用LPS(1.0 mg/L)刺激24 h,抽提细胞总RNA和总蛋白分别检测有关基因、蛋白表达。
将生长状态良好的RAW264.7细胞接种于12孔板(1×105个/ml),待细胞贴壁后,按照说明书采用过表达或敲降TIPE2的慢病毒颗粒感染细胞,培养48 h,更换含嘌呤霉素(2.5 mg/L)的完全培养基持续筛选7 d,RT-qPCR和Western blot验证稳定细胞系是否构建成功。
1.2.2 RT-qPCR检测mRNA表 达采 用TRIzol直接裂解法提取细胞总RNA,多功能酶标仪检测RNA纯度和浓度,按照HiScript®ⅡQ RT SuperMix for qPCR(+gDNA wiper)逆转录试剂说明书合成cDNA,采用AceQ®qPCR SYBR Green Master Mix试剂盒,以18 S为内参,进行相对荧光定量检测,2-ΔΔCt法分析基因表达。引物序列见表1。

表1 引物序列Tab.1 Primers sequences
1.2.3 Western blot检测蛋白表达采用RIPA裂解液抽提细胞总蛋白,BCA试剂盒检测蛋白浓度。取40 µg样品于10%SDS-PAGE凝胶中电泳,转至PVDF膜,5%脱脂牛奶室温封闭1 h,TBST(PBS包含0.05%Tween-20)洗3遍;分别滴加一抗TIPE2(1∶2 000)、cleaved Caspase-8(1∶2 000)、Bcl-2(1∶2 000)、Bax(1∶2 000)、CHOP(1∶2 000)、cleaved Caspase-3(1∶2 000)、Akt(1∶2 000)、p-AktSer473(1∶2 000)、β-actin(1∶10 000)或GAPDH(1∶10 000)4℃孵育过夜,TBST洗3遍;滴加羊抗兔(1∶10 000)或羊抗鼠(1∶10 000)二抗室温孵育1 h,TBST洗3遍;ECL化学发光液显影,凝胶成像系统检测蛋白灰度值并分析相对表达。
1.2.4 CCK-8法检测细胞活力将单细胞悬液(5×104个/ml)接种于96孔板(100 µl/孔),待细胞贴壁后更换培养基,滴加LPS(1.0 mg/L)处理24 h。弃培养基,PBS浸洗2次,依次加入90 µl完全培基和10µl CCK-8试剂轻摇混匀,培养箱中孵育2 h。分别设置空白孔和对照孔,每组设3个复孔,多功能酶标仪检测450 nm处吸光度(OD)值。细胞相对活力(%)=(OD处理孔-OD空白孔)/(OD对照孔-OD空白孔)×100%。
1.2.5 Annexin V-FITC/PI双染法检测细胞凋亡率将单细胞悬液(5×107个/ml)接种于12孔板,细胞贴壁后LPS(1.0 mg/L)处理24 h。滴加胰蛋白酶(不含EDTA)消化、收集细胞,800 r/min室温离心7 min,预冷PBS洗涤2次;100µl结合缓冲液重悬细胞,调整细胞密度至3×105个/ml,加入5 µl Annexin V-FITC混匀,室温避光孵育15 min;加入5 µl碘化丙啶溶液避光孵育5 min,混匀,流式细胞仪检测各组细胞凋亡率。细胞总凋亡率(%)=Q2象限细胞凋亡率+Q4象限细胞凋亡率。
1.2.6 Tunel法检测细胞凋亡指数取细胞爬片置于12孔板,将单细胞悬液(5×104个/ml)接种于爬片,待细胞贴壁后采用LPS(1.0 mg/L)处理24 h。弃培养基,PBS洗2次,滴加0.2%Triton室温孵育5 min;100µl 1×Equilibration Buffer室温平衡30 min;50µl TdT标记液(34µl ddH2O、10µl 5×Equilibration Buffer、5 µl BrightRed Labeling Mix、1 µl Recombinant TdT Enzyme)37℃湿盒内避光孵育60 min,PBS浸洗2次,5 min/次;DAPI室温避光 孵育5 min,PBS洗3次,5 min/次;荧光显微镜下分析样本,620 nm处观察红色荧光,460 nm处观察蓝色荧光。细胞凋亡指数=Tunel染色细胞数/总细胞数。
1.3 统计学处理采用SPSS20.0软件和Graph‑Pad Prism 5软件进行统计学分析,数据以±s表示,数据间比较采用t检验和方差分析(ANOVA)。P<0.05表示差异具有统计学意义。
2 结果
2.1 LPS活化巨噬细胞,并下调TIPE2表达LPS(1.0 mg/L)处理RAW264.7细胞24 h,RT-qPCR检测 结 果 显 示,细 胞IL-6和TNF-α表 达 增 多(P<0.001),表明LPS可有效活化巨噬细胞;此外,LPS也可明显下调细胞TIPE2 mRNA和蛋白表达(P<0.001,P<0.01,图1)。推测免疫负调控因子TIPE2可能参与活化巨噬细胞的凋亡过程。

图1 LPS对巨噬细胞炎症因子及TIPE2表达的影响Fig.1 Effects of LPS on expressions of inflammatory fac⁃tors and TIPE2 in macrophages
2.2 过表达TIPE2促进活化巨噬细胞凋亡采用慢病毒载体构建TIPE2过表达稳定细胞系,荧光显微镜下观察表达绿色荧光GFP蛋白的细胞比例达95%以上;RT-qPCR和Western blot检测结果显示,与空载体组相比,过表达组细胞TIPE2 mRNA表达上调约200倍(P<0.001),TIPE2蛋白表达上调约2倍(P<0.001,图2A)。表明TIPE2过表达稳定细胞系构建成功,可用于后续实验。LPS刺激稳定过表达TIPE2的细胞24 h,结果显示,TIPE2过表达可明显减弱活化巨噬细胞活力(P<0.001),促使其凋亡率和凋亡指数升高,并增加促凋亡蛋白cleaved Caspase-8、Bax、CHOP、cleaved Caspase-3表达,减少抗凋亡蛋白Bcl-2表达(P<0.01,P<0.001,图2B~E)。提示TIPE2可通过多种途径有效促进活化巨噬细胞凋亡。

图2 过表达TIPE2对LPS活化巨噬细胞凋亡的影响(×200)Fig.2 Effects of TIPE2-overexpression on apoptosis of LPS-activated macrophages(×200)
2.3 敲降TIPE2抑制活化巨噬细胞凋亡构建TIPE2敲降稳定细胞系,荧光显微镜下观察表达绿色荧光GFP蛋白的细胞比例达95%以上;与空载体组相比,敲降组细胞TIPE2 mRNA和蛋白表达下调约70%(P<0.001,图3A),说明TIPE2敲降稳定细胞系构建成功。LPS处理稳定敲降TIPE2的细胞24 h,结果显示,敲降TIPE2可增强活化巨噬细胞活力(P<0.05),降低细胞凋亡率和凋亡指数,减少cleaved Caspase-8、Bax、CHOP、cleaved Caspase-3蛋白表达,并促进Bcl-2蛋白表达(P<0.05,P<0.01,P<0.001,图3B~E)。表明敲降TIPE2可通过内源性、外源性和内质网应激途径抑制活化巨噬细胞凋亡。

图3 敲降TIPE2对LPS活化巨噬细胞凋亡的影响(×200)Fig.3 Effects of TIPE2-knockdown on apoptosis of LPSactivated macrophages(×200)
2.4 TIPE2调控活化巨噬细胞Akt磷酸化水平为进一步明确TIPE2是否通过调控Akt磷酸化影响活化巨噬细胞凋亡,采用LPS处理稳定过表达或敲降TIPE2的细胞24 h,Western blot结果显示,过表达TIPE2可明显下调活化巨噬细胞p-AktSer473蛋白表达(P<0.05),而对Akt蛋白表达无影响;敲降TIPE2作用与之相反(P<0.001,图4)。表明TIPE2可抑制活化巨噬细胞磷酸化Akt表达,推测TIPE2可能通过该途径激活多种凋亡信号通路。

图4 TIPE2对活化巨噬细胞Akt磷酸化水平的影响Fig.4 Effects of TIPE2 on Akt phosphorylation of activated macrophages
2.5 Akt磷酸化激动剂抑制TIPE2对活化巨噬细胞凋亡的促进作用为验证TIPE2/Akt对活化巨噬细胞凋亡的影响,采用胰岛素样生长因子1(insulinlike growth factors,IGF-1)预处理稳定过表达TIPE2的细胞2 h后再与LPS共处理24 h,CCK-8检测结果显示,IGF-1不仅增强活化巨噬细胞活力,还明显减弱TIPE2过表达对细胞活力的抑制作用(P<0.05);Western blot结果显示,IGF-1可下调活化巨噬细胞cleaved Caspase-8、Bax、CHOP、cleaved Caspase-3蛋白表达,上调Bcl-2蛋白表达,并抑制TIPE2过表达对活化巨噬细胞凋亡的促进作用(P<0.05,P<0.01,图5)。提示提高Akt磷酸化水平可有效逆转TIPE2对活化巨噬细胞凋亡的促进作用。
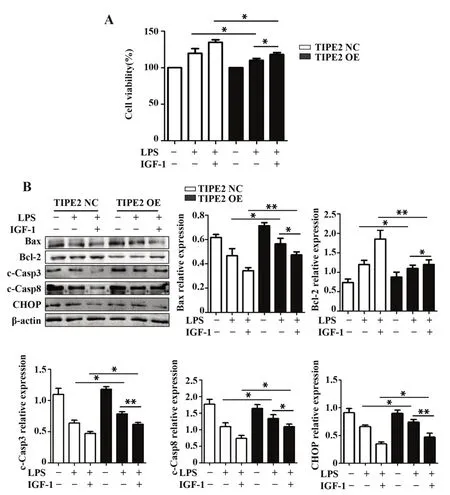
图5 IGF-1对TIPE2促进活化巨噬细胞凋亡的影响Fig.5 Effects of IGF-1 on TIPE2 promoting activated macrophages apoptosis
3 讨论
《中国心血管健康与疾病报告2019》指出,中国心血管病患病率和病死率仍处于持续上升阶段,目前心血管病患者约3.30亿,动脉粥样硬化性心血管病高危和极高危人群降脂治疗率与达标率现状堪忧,中国心血管病负担日益加重,已成为重大公共卫生问题[16]。动脉粥样硬化是一个血管慢性炎症反应过程,树突状细胞、巨噬细胞、中性粒细胞等炎症细胞均影响其发生和进展。巨噬细胞凋亡是动脉粥样硬化病变发展的关键因素,可减少炎症细胞在血管壁中的沉积,有效抑制炎症反应发生,影响早期斑块形成,也是清除体内病原微生物的重要途径[6]。巨噬细胞凋亡是动脉粥样硬化、急性心肌梗死等心血管病发生发展的细胞学基础,可作为临床诊断信号,探究其凋亡机制可为有关疾病防治提供参考,具有重要的临床价值。
细胞凋亡是细胞程序性死亡的一种形式,发生于多细胞生物体,主要通过外源性、内源性、内质网应激3种途径诱导凋亡维持体内平衡[17]。外源性凋亡途径由死亡配体与受体结合,引起半胱-天冬氨酸蛋白酶(Caspase)级联反应。Caspase-8是级联瀑布上游始动因子,Caspase-3是最主要的凋亡执行蛋白,可作为多种调节途径的效应物,引起细胞不可逆死亡[18-19]。Bcl-2家族在内源性凋亡通路中发挥重要作用,分为促凋亡蛋白和抗凋亡蛋白,当两者比值升高时,线粒体膜电位发生变化,细胞色素C释放至胞浆并激活Caspase-9和Caspase-3诱导凋亡[20]。此外,内质网凋亡通路中,CHOP是重要的促凋亡信号分子[21]。文献报道,LPS与TLR4结合可促进NF-κB核转位,诱导巨噬细胞活化,释放多种炎症因子,加速动脉粥样硬化进程[22]。本研究采用LPS刺激小鼠巨噬细胞模拟动脉粥样硬化发生微环境,研究影响活化巨噬细胞凋亡的基因,为深入探讨动脉粥样硬化病理生理机制,开发心血管病防治药物提供实验数据。
炎症负调控因子TIPE2最初由宾夕法尼亚大学的SUN等[9]在实验性自身免疫性脑脊髓炎模型中发现。后续研究显示TIPE2的高分辨率晶体结构不是典型的DED折叠,而是位于中心位置的一个能结合辅因子的巨大疏水腔,这一结构为其免疫稳态奠定了基础,可作为炎症性疾病的药物作用靶点[23]。TIPE2异常表达与多种人类感染性疾病和自身免疫性疾病有关,如系统性红斑狼疮、哮喘、乙型肝炎和类风湿关节炎等[24-26]。文献报道,TIPE2可能通过调控细胞凋亡或细胞自噬促进巨噬细胞凋亡,但分子机制尚未阐明[27]。本研究表明,LPS处理巨噬细胞后,炎症因子表达上调而TIPE2表达下调,与在系统性红斑狼疮和肝炎等慢性炎症性疾病患者中的研究结果一致。随后,通过基因干扰技术发现,过表达TIPE2能影响多种凋亡相关蛋白表达,促进活化巨噬细胞凋亡,而敲降TIPE2则抑制其凋亡,提示TIPE2与活化巨噬细胞凋亡关系密切,可能通过外源性、内源性、内质网应激途径调控巨噬细胞凋亡。
Akt信号通路是调控细胞凋亡的重要通路,巨噬细胞主要表达Akt1、Akt2和Akt3 3种亚型,虽然是不同基因产物,但具有相似结构[28]。Akt1和Akt3普遍表达于多种组织,Akt2在棕色脂肪、骨骼肌和肝脏等胰岛素反应组织中表达[29]。MANNING等[30]研究发现,Akt Ser/Thr位点磷酸化水平提高与抑制细胞凋亡有关,Akt可通过下游多个途径对靶蛋白进行磷酸化修饰进而发挥抗凋亡作用,该信号通路激活需要启动疏水基序列中S473磷酸化。本研究显示,过表达TIPE2可明显抑制活化巨噬细胞Akt磷酸化水平,而敲降TIPE2可产生相反生物学效应,表明TIPE2可能通过抑制Akt磷酸化促进活化巨噬细胞凋亡发挥免疫调控功能。
胰岛素样生长因子IGF-1属于多肽类生长因子,是Akt特异性激活剂,可介导PI3K/Akt信号通路活化,上调Akt磷酸化水平[31]。IGF-1的生物学功能主要由IGF-1受体(IGF-1R)介导,IGF-1R可激活PI3K/Akt通路促进有丝分裂和肿瘤发生,而Akt是IGF-1R的直接下游效应因子[32]。本研究采用IGF-1处理稳定过表达TIPE2的细胞,探讨Akt磷酸化激动剂对TIPE2促凋亡作用的影响,发现IGF-1不仅可抑制活化巨噬细胞凋亡,且能够明显减弱TIPE2对活化巨噬细胞凋亡的促进作用。进一步证实TIPE2可能通过抑制Akt磷酸化,诱导LPS活化的巨噬细胞凋亡,进而减少血管壁中炎症细胞沉积,延缓早期斑块形成,降低心血管病发生风险。
综上所述,本研究表明TIPE2可能通过抑制Akt磷酸化,激活外源性、内源性和内质网凋亡通路,促使LPS活化的巨噬细胞凋亡,从而发挥抗动脉粥样硬化作用。但TIPE2在动物体内是否具有同样作用及机制尚未明确。后续研究将深入探讨TIPE2调控Akt磷酸化影响活化巨噬细胞凋亡的分子机制,为动脉粥样硬化防治提供更多参考。