苦杏仁苷对新生大鼠坏死性小肠结肠炎的保护作用
2022-02-21曾信豪谢东可郑皓徐沛王小勇
曾信豪谢东可郑 皓徐 沛王小勇
(1.西南医科大学附属医院儿外科,四川泸州 646000;2.四川省出生缺陷临床医学研究中心,四川 泸州 646000)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种肠道炎症性疾病,在新生儿群体中发病率、病死率均较高[1]。 NEC 极易引发新生儿肠穿孔、多器官衰竭、败血症等,甚至导致患儿死亡[2]。目前,临床可以采取外科手术的方式治疗NEC,但由于创伤大,术后并发症多,术后死亡率仍较高,且较高的手术费会增加患者经济压力。 如何利用其他治疗方式避免NEC 病情进展是新生儿外科医生和内科医生所需要共同面对的难题。 抗炎药物、控制肠道菌群等药物进行保守治疗[3-4],可以规避临床手术风险,但此类药物耐药性较强,不良反应多,且部分患者疗效不佳。 苦杏仁苷(amygdalin)是苦杏仁的有效成分之一,又称维生素B17,临床上常用于治疗祛痰止咳以及抗肿瘤的辅助治疗,可有效改善咳喘、肺纤维化、抗高氧诱导肺损伤等呼吸疾病[5]。 相关研究表明,苦杏仁苷可用于治疗缓解胃肠道疾病,提高机体免疫功能、抑制肠道炎症、缓解肠组织损伤等[6]。 因此,本研究探讨了苦杏仁苷对新生大鼠NEC 的保护作用,以期为临床提供更多治疗NEC 的方法。
1 材料和方法
1.1 实验动物
选择7 日龄的健康 SD 大鼠共 60 只,SPF 级,雌雄不限,体重约15 g,购自西南医科大学[SCXK(川)2018-17],饲养于西南医科大学[SYXK(川)2018-065]。 经本院西南医科大学附属医院伦理委员会批准(IACUC20201207);实验研究过程中符合3R 原则。 饲养条件:采用清洁层流架小环境控制饲养。 每 3 d 换 1 次垫料,每天 09:00 和 20:00 各饲喂1 次,自由饮水。 温度控制在18℃~22℃,湿度50%~60%。
1.2 主要试剂与仪器
强化配方乳、组织及细胞裂解液(北京伊塔生物科 技 有 限 公 司, 批 号: 20200608、 20200512、20200416);苦杏仁苷(上海韵泰信息科技有限公司,批号:20200226);PMSF 蛋白酶抑制剂混合物(伊塔生物有限公司,批号:20200614);细胞凋亡试剂盒(武汉益普生物科技有限公司, 批号:20200816)。 肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)检测试剂盒(北京索莱宝科 技 有 限 公 司, 批 号: 20201012、 20200924、20200916);超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)检测试剂盒(天津本生健康科技有限公司,批号:20200706、20200815、20200724);辣根过氧化物酶标记的羊抗兔IgG 抗体(北京百奥莱博,批号:BL0899);β-actin 鼠单克隆抗体(北京百奥莱博,批号:WK347-XHA)。
Bio-Rad 多功能酶标检测仪( 型号iMark680); OLYMPUS 光 学 显 微 镜 ( 型 号BX60);Bio-Rad SDS-PAGE 电泳仪和转膜仪(型号Mini Protean 3 Cell)。
1.3 方法
1.3.1 动物模型建立和分组
将60 只出生7 d 的健康新生SD 大鼠按随机数字表法分为对照组、模型组、苦杏仁苷低剂量组、苦杏仁苷中剂量组、苦杏仁苷高剂量组和柳氮磺嘧啶组,每组10 只。 利用配制代乳品(脂肪120 g/L、蛋白质75 g/L、乳糖28 g/L、热量5.9 mJ/L)喂养,每5 h 喂养1 次。 除对照组外,将其他组大鼠放入缺氧箱内,向箱内注入浓度100%的氮气,当测氧仪每min 测得箱内氧气浓度降为0 时开始计时,1 min 后关闭阀门,取出大鼠;5 min 后立即将其置于4℃冰箱中10 min 进行冷刺激,每天3 次;脂多糖10 mg/kg 灌胃,每天1 次,连续3 d 重复上述操作。 末次干预后第 2 天,低、中、高剂量组分别给予 20、40、80 mg/kg 苦杏仁苷,阳性对照组给予300 mg/kg 柳氮磺嘧啶,连续给药5 d;模型组给予等体积的氯化钠注射液;对照组则不予任何处理。 若造模后大鼠出现吐奶、腹胀、腹泻、血便等症状,且HE 染色显示肠组织病理损伤评分≥2 分为NEC 建模成功。
1.3.2 评估回盲部肠组织病理组织损伤及大鼠体重变化
末次人工喂养12 h 后,处死大鼠,记录体重。取各组回盲部肠组织,利用4%的多聚甲醛固定,进行石蜡包埋切片处理,并将回盲部肠组织进行苏木精-伊红染色,观察其病理学变化,根据参考文献[7]对各组大鼠进行回盲部肠组织损伤评分:回盲部肠组织结构正常、绒毛及上皮均完整为0 分,回盲部肠组织黏膜固有层有轻微肿胀或分离为1 分;回盲部肠组织黏膜固有层中度肿胀分离为2 分;回盲部肠组织黏膜固有层重度肿胀分离,且黏膜下肌层水肿并伴局部绒毛脱落为3 分;肠坏死且回盲部肠组织绒毛消失为4 分。
1.3.3 TUNEL 法检测肠组织细胞凋亡情况
将肠组织细胞处理为5 μm 切片,烤片30 min后,进行脱蜡水化处理,利用苏木素染色1 min 后,蒸馏水冲洗,再用盐酸乙醇分化10 s,冲洗,氨水返蓝30 s 后,冲洗,伊红染色20 s,乙醇脱水,利用二甲苯透明,最后封片。 用显微镜下观察细胞染色情况。
将各组大鼠回盲部肠组织进行石蜡包埋切片处理,脱蜡至水,利用原位末端标记(TUNEL)法检测大鼠肠组织细胞的凋亡情况,严格按照细胞凋亡试剂盒说明书步骤操作,最后用抗荧光淬灭剂封片液封片并镜检。
1.3.4 酶联免疫法检测炎症因子
取回盲部肠组织,按照20 mg 加入100 μL 组织裂解液的比例加入组织裂解液和蛋白酶抑制剂(苯甲基磺酰氟),在4℃下,14000 r/min 离心10 min,取上层清液,采用酶联免疫吸附试验测定TNF-α、IL-6、IL-1β 水平,严格按照试剂盒说明书操作。
1.3.5 酶联免疫法检测氧化应激水平
采用玻璃匀浆器,将各组盲部肠组织制成组织匀浆液,利用酶联免疫吸附法检测匀浆液中的GSHPx、SOD、MDA 含量,严格按照试剂盒说明书操作。
1.3.6 Western blot 检测 NLRP3/ASC/Caspase-1 信号通路
利用 Western blot 检测 NOD 样受体蛋白 3(NOD-like receptor protein 3,NLRP3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)、活化半胱氨酸天冬氨酸蛋白酶(Caspase-1,ASC)蛋白表达水平。 采用细胞裂解液裂解,组织匀浆,4℃下14000 r/min 离心5 min,取上清提取各组回盲部肠组织总蛋白,严格按照操作说明进行。 采用BCA 法进行蛋白定量,取20 μg 蛋白进行SDS-PAGE 凝胶电泳,电转至PVDF膜上,采用洗膜缓冲液洗膜并加一抗(NLRP3、ASC、cleaved cas1/cas1),4℃,孵育过夜,洗膜加羊抗兔IgG 二抗(1 ∶3000),摇床震荡,于室温下孵育 2 h。电化学发光显影,用β-actin 作为内参,用凝胶图象处理系统分析对比条带强弱。
1.4 统计学方法
采用SPSS 17.0 软件进行数据分析,满足正态性的计量资料均以平均数±标准差()表示,采用单因素方差分析比较组间差异,SNK-q比较多组两两组间差异,以P<0.05 表示差异有统计学意义。
2 结果
2.1 苦杏仁苷剂量依赖性减轻肠组织病理组织损伤、增加大鼠体重
与对照组相比,模型组大鼠体重显著下降,肠组织损伤评分显著增加(P<0.05);与模型组相比,苦杏仁苷中、高剂量组、柳氮磺嘧啶组大鼠体重显著上升,肠组织损伤评分显著下降(P<0.05),提示苦杏仁苷有抑制组织损伤的作用,并且剂量越高这种抑制作用越显著。 见表1。
表1 苦杏仁苷剂量依赖性减轻肠组织病理组织损伤、增加大鼠体重()Table 1 Amygdalin dose-dependently reduces pathological tissue damage and increased body weight in rats

表1 苦杏仁苷剂量依赖性减轻肠组织病理组织损伤、增加大鼠体重()Table 1 Amygdalin dose-dependently reduces pathological tissue damage and increased body weight in rats
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。Note. Compared with control group,*P<0.05. Compared with model group,#P<0.05.
分组Groups剂量(mg/kg)Dose体重变化(g)Weight change肠组织损伤评分(分)Intestinal tissue injury score对照组Control group - 2.16±1.47 0.17±0.07模型组Model group - -14.99±6.66*3.32±0.55*苦杏仁苷低剂量组Amygdalin low-dose group 20 -14.80±6.86 3.22±0.70苦杏仁苷中剂量组Amygdalin middle-dose group 40 -4.55±4.21#2.41±0.57#苦杏仁苷高剂量组Amygdalin high-dose group 80 -1.59±1.25#1.24±0.36#柳氮磺嘧啶组Sulfasalazine group 300 0.59±1.37#0.92±0.31#
2.2 苦杏仁苷剂量依赖性抗细胞凋亡
HE 染色显示肠组织细胞被染成紫红色,肠组织细胞核被染成紫蓝色。 对照组大鼠肠组织细胞横纹清晰、结构完整、大小正常、排列整齐、灰白质分界清晰且核仁清晰可见;空白对照组和阴性对照组大鼠肠组织细胞显著增大、组织内存在较多空腔、排列紊乱,间质增多,灰白质分界不清晰,有明显成纤维细胞增生;阳性对照组大鼠肠组织细胞排列稍紊乱,间质稍增多,有少量成纤维细胞增生,见图1。

图1 肠组织HE 染色情况比较Figure 1 Comparison of HE staining of intestinal tissue
TUNEL 法检测大鼠肠组织细胞显示,与对照组(2.02%)相比,模型组的细胞凋亡率(45.45%)显著升高(P<0.05),与模型组相比,苦杏仁苷中剂量组(20.20%)、苦杏仁苷高剂量组(10.39%)、柳氮磺嘧啶组(7.58%)细胞凋亡率显著下降(P<0.05),见图 2、表 2。
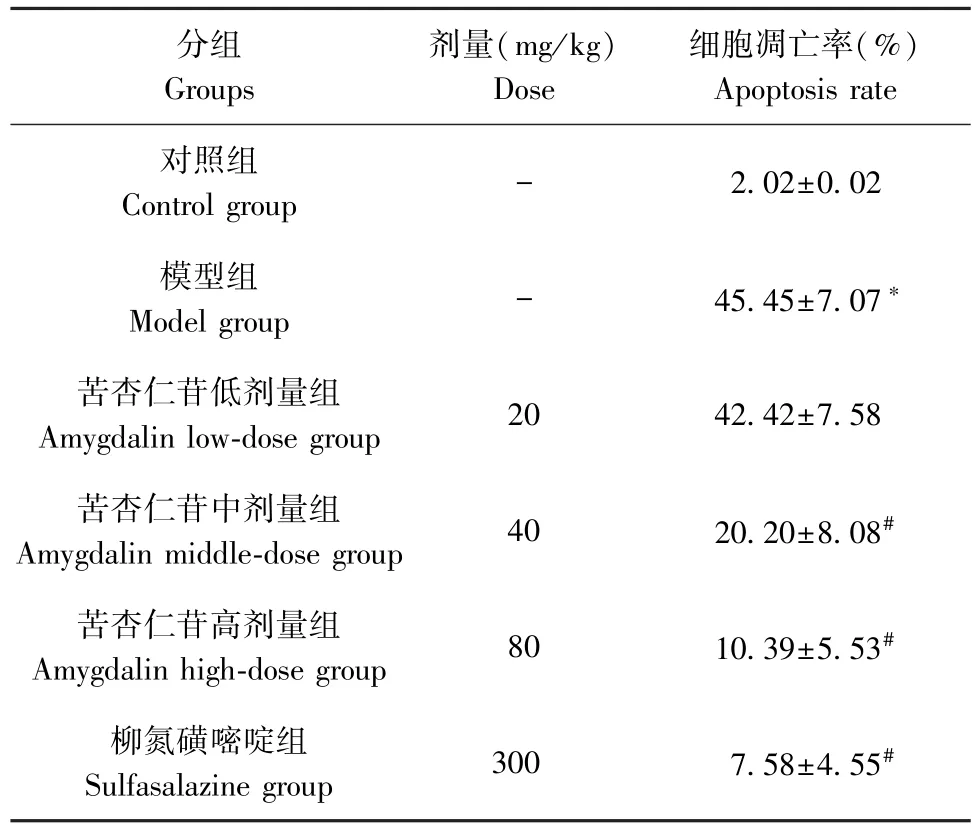
表2 苦杏仁苷剂量依赖性抗细胞凋亡(ˉx±s)Table 2 Amygdalin dose-dependently anti-apoptosis
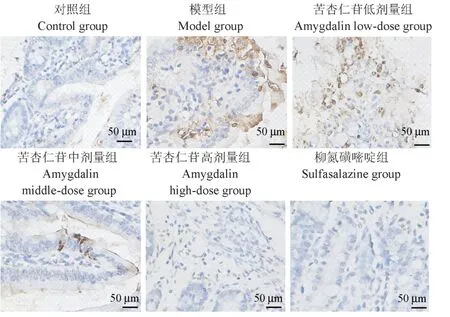
图2 肠组织细胞凋亡情况比较Figure 2 Comparison of cell apoptosis in intestinal tissue
2.3 苦杏仁苷剂量依赖性降低炎症因子水平
与对照组相比,模型组的 TNF-α、IL-6、IL-1β 水平显著升高(P<0.05),与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组TNF-α、IL-6、IL-1β 显著下降(P<0.05),提示苦杏仁苷有抑制炎症的作用,并呈现剂量依赖性。 见表3。
表3 苦杏仁苷剂量依赖性降低炎症因子水平()Table 3 Amygdalin dose-dependently reduces the level of inflammatory factors
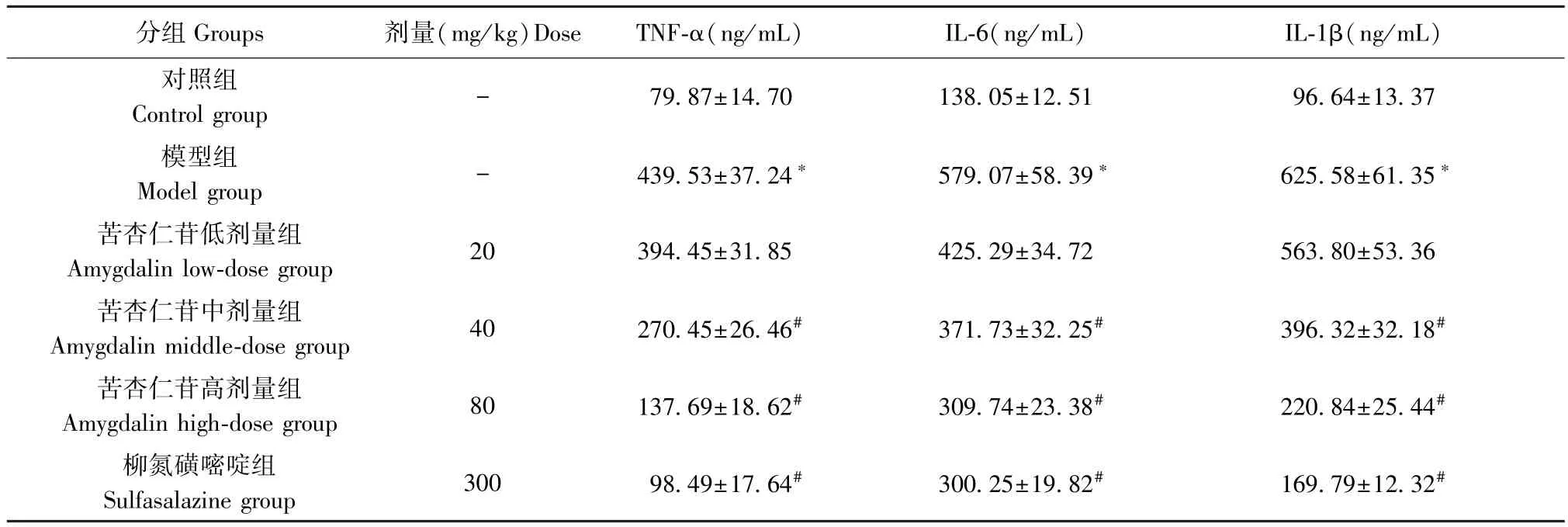
表3 苦杏仁苷剂量依赖性降低炎症因子水平()Table 3 Amygdalin dose-dependently reduces the level of inflammatory factors
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。Note. Compared with control group,*P<0.05. Compared with model group,#P<0.05.
分组 Groups 剂量(mg/kg)Dose TNF-α(ng/mL) IL-6(ng/mL) IL-1β(ng/mL)对照组Control group - 79.87±14.70 138.05±12.51 96.64±13.37模型组Model group - 439.53±37.24* 579.07±58.39* 625.58±61.35*苦杏仁苷低剂量组Amygdalin low-dose group 20 394.45±31.85 425.29±34.72 563.80±53.36苦杏仁苷中剂量组Amygdalin middle-dose group 40 270.45±26.46# 371.73±32.25# 396.32±32.18#苦杏仁苷高剂量组Amygdalin high-dose group 80 137.69±18.62# 309.74±23.38# 220.84±25.44#柳氮磺嘧啶组Sulfasalazine group 300 98.49±17.64# 300.25±19.82# 169.79±12.32#
2.4 苦杏仁苷剂量依赖性降低氧化应激水平
与对照组相比,模型组的 SOD、MDA、GSH-Px水平显著升高(P<0.05),与模型组相比,苦杏仁苷中、高剂量组和柳氮磺嘧啶组SOD、MDA、GSH-Px水平显著下降(P<0.05),提示苦杏仁苷有减缓氧化应激水平的作用,随着剂量增加,减轻氧化应激水平的效果越显著。 见表4。
表4 苦杏仁苷剂量依赖性降低氧化应激水平()Table 4 Amygdalin dose-dependently reduces oxidative stress levels
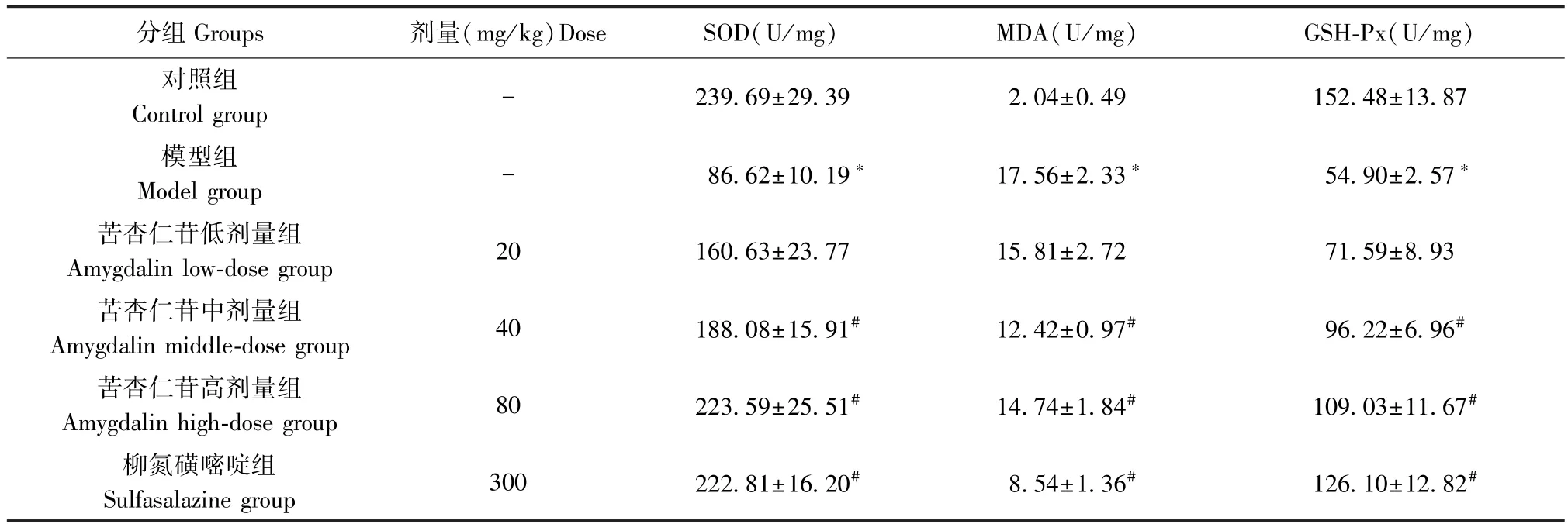
表4 苦杏仁苷剂量依赖性降低氧化应激水平()Table 4 Amygdalin dose-dependently reduces oxidative stress levels
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。Note. Compared with control group,*P<0.05. Compared with model group,#P<0.05.
分组Groups 剂量(mg/kg)Dose SOD(U/mg) MDA(U/mg) GSH-Px(U/mg)对照组Control group - 239.69±29.39 2.04±0.49 152.48±13.87模型组Model group - 86.62±10.19* 17.56±2.33* 54.90±2.57*苦杏仁苷低剂量组Amygdalin low-dose group 20 160.63±23.77 15.81±2.72 71.59±8.93苦杏仁苷中剂量组Amygdalin middle-dose group 40 188.08±15.91# 12.42±0.97# 96.22±6.96#苦杏仁苷高剂量组Amygdalin high-dose group 80 223.59±25.51# 14.74±1.84# 109.03±11.67#柳氮磺嘧啶组Sulfasalazine group 300 222.81±16.20# 8.54±1.36# 126.10±12.82#
2.5 苦杏仁苷剂量依赖性降低 NLRP3、ASC、Caspase-1 蛋白表达
与对照组比,模型组的 NLRP3、ASC、Caspase-1表达水平显著升高(P<0.05),与模型组相比,苦杏仁苷中、高剂量组和柳氮磺嘧啶组 NLRP3、ASC、Caspase-1水平显著下降(P<0.05),说明苦杏仁苷可以通过调控 NLRP3、ASC、Caspase-1 等蛋白表达水平保护大鼠肠组织。 见图3、表5。
表5 苦杏仁苷剂量依赖性降低NLRP3、ASC、Caspase-1 蛋白表达()Table 5 Amygdalin dose-dependently decreased NLRP3, ASC and Caspase-1 protein expression

表5 苦杏仁苷剂量依赖性降低NLRP3、ASC、Caspase-1 蛋白表达()Table 5 Amygdalin dose-dependently decreased NLRP3, ASC and Caspase-1 protein expression
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。Note. Compared with control group,*P<0.05. Compared with model group,#P<0.05.
分组Groups 剂量(mg/kg)Dose NLRP3 ASC Caspase-1对照组Control group - 0.02±0.01 0.01±0.01 0.01±0.01模型组Model group - 0.28±0.04* 0.26±0.06* 0.37±0.04*苦杏仁苷低剂量组Amygdalin low-dose group 20 0.25±0.04 0.25±0.05 0.33±0.05苦杏仁苷中剂量组Amygdalin middle-dose group 40 0.07±0.03# 0.11±0.04# 0.07±0.03#苦杏仁苷高剂量组Amygdalin high-dose group 80 0.03±0.01# 0.04±0.02# 0.03±0.02#柳氮磺嘧啶组Sulfasalazine group 300 0.02±0.01# 0.02±0.01# 0.02±0.02#

图3 肠组织细胞NLRP3、ASC、Caspase-1 蛋白表达图谱Figure 3 Intestinal tissue cell NLRP3, ASC,Caspase-1 protein expression profile
3 讨论
NEC 是新生儿期常见的严重消化道疾病,极低出生体重儿的 NEC 发病率为 7%,病死率可达30%[8]。 新生儿缺氧缺血、异常细菌定植、胎龄不足、配方奶喂养等被认为是NEC 发生的主要影响因素[9]。 苦杏仁苷取自于杏仁,在蔷薇科植物的成熟干燥种子广泛存在。 有研究显示,苦杏仁苷有抗肿瘤、抑制炎症、抑制组织损伤的作用[10-11]。 本研究结果显示,与对照组相比,模型组大鼠体重显著下降,肠组织损伤评分显著增加;与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组大鼠体重显著上升,肠组织损伤评分显著下降,与上述研究结论相符,说明苦杏仁苷与柳氮磺嘧啶作用相近,可以抑制肠组织损伤恢复大鼠体重,且与苦杏仁苷浓度呈正相关。
苦杏仁苷在机体内通过白糖昔酶作用分解,从而释放出氰化物,氰化物本身具有很强的细胞毒性,可抑制线粒体的功能,拮抗炎症因子延缓细胞凋亡[10]。 有研究显示,苦杏仁苷可以通过JAK2-STAT3 通路促进T 淋巴细胞增殖,进而缩短细胞分裂周期,增强细胞干扰和杀伤性细胞因子的分泌。 苦杏仁苷经抗 CEA-单抗-葡萄糖苷酶偶联物特异激活后,可以促进癌细胞凋亡,对癌细胞具有靶向细胞毒作用[12]。 TUNEL 法检测结果显示,与对照组相比,模型组的细胞凋亡率显著升高,与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组细胞凋亡率显著下降。本研究说明苦杏仁苷可以改善细胞凋亡,且与苦杏仁苷浓度呈正相关。
本研究结果显示,与对照组相比,模型组的TNF-α、IL-6、IL-1β 显著升高;与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组TNF-α、IL-6、IL-1β 显著下降。 TNF-α、IL-6、IL-1β常被作为临床炎症反应指标,对炎症的发展有预示作用[13]。 既往研究显示,脑组织损伤严重的大鼠伴随血清中 IL-6、IL-1β、TNF-α 等炎症因子水平升高,提示组织损伤可能与血清炎症水平较高有关,当炎症水平降低后,组织病理损伤和细胞凋亡发生好转[14]。 有研究显示,苦杏仁苷可以拮抗炎症因子诱导、促进细胞的凋亡,苦杏仁苷对多种炎性疾病有缓解作用,可明显降低炎性因子[15]。 结合本研究说明苦杏仁苷降低了肠组织细胞中的炎症反应,促进肠道细胞恢复。
本研究结果显示,与对照组相比,模型组的SOD、MDA、GSH-Px 水平显著升高;与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组 SOD、MDA、GSH-Px 水平显著下降。 既往研究显示,苦杏仁苷可以通过抑制氧化应激及炎症反应减轻肝纤维化[16]、抑制肿瘤的作用。 SOD、GSH-Px作为自由基解毒酶可以清除机体氧自由基,自由基清除与产生之间的平衡对机体正常运转、抗衰老、抗病理变化起到重要作用,测定氧化应激反应的代谢产物MDA 可以进一步了解机体过氧化损伤的情况[17]。 本研究中 SOD、MDA、GSH-Px 水平显著下降提示了,苦杏仁苷中可能通过抑制组织细胞的氧化应激反应缓解炎症反应,保护肠组织。
本研究结果显示,与对照组相比,模型组的NLRP3、ASC、Caspase-1 表达水平显著升高;与模型组相比,苦杏仁苷中剂量组、苦杏仁苷高剂量组、柳氮磺嘧啶组NLRP3、ASC、Caspase-1 水平显著下降。有研究显示,ASC、Caspase-1 可导致NLRP3 的激活,参与组织损伤的发生、发展。 受体蛋白NLRP3、凋亡相关点样蛋白 ASC、Caspase-1 均是 NLRP3 炎性小体的组成部分,收到外来刺激时,ASC 使 pro-Caspase-1 转化为有活性的Caspase-1,进而促进pro-IL-1 和 pro-IL-18 向白细胞介素1(IL-1)、白细胞介素18(IL-18)转化,增加了 IL-1、IL-18 含量,介导炎症反应的发生[18-19]。 结合本研究结果说明苦杏仁苷可以通过调控 NLRP3、ASC、Caspase-1 来缓解炎症反应,改善肠组织损伤。
综上所述,苦杏仁苷对新生大鼠坏死性小肠结肠炎有一定保护作用,可以有效减少肠组织损伤、降低机体炎症反应、氧化应激反应,减少肠组织细胞凋亡率,但具体的反应机制尚不够明确,有待临床进一步探究。
