利用SpyTag/SpyCatcher体系提高毕赤酵母重组蛋白生产能力
2022-02-21韩双艳李静文王媛媛
韩双艳 李静文 王媛媛
(华南理工大学 生物科学与工程学院,广东 广州 510006)
巴斯德毕赤酵母(Pichiapastoris)(简称毕赤酵母)是一种典型的甲基营养型酵母,可以利用甲醇作为唯一的碳源和能源。毕赤酵母具有强醇氧化酶基因AOX1启动子[1],其遗传背景清晰、分泌效率高、可整合型表达、高密度发酵,因而被广泛地应用于多种蛋白质的制备、表征以及结构解析等方面,是应用最为广泛的真核外源蛋白表达系统之一[2- 7]。甲醇作为一种极具吸引力的一碳化合物,价格低廉,来源丰富,全球年产量约为5 300万吨[8]。与糖蜜等发酵原料不同,甲醇是一种纯底物,在发酵过程中可以被完全利用,是一种极有潜力的工业生物原料。目前,利用合成生物学技术构建甲醇营养型微生物细胞以实现从甲醇到化学品的生物转化已成为国内外研究热点[9]。因此,研究毕赤酵母甲醇代谢关键节点,提高甲醇利用效率,增强菌体的重组蛋白生产能力,构建高效利用甲醇的毕赤酵母人工细胞具有重要意义。
毕赤酵母甲醇代谢途径(MUT)主要发生在过氧化酶体中[10- 11]。甲醇进入过氧化酶体后在甲醇氧化酶(AOX)的催化下与氧结合生成两种具有细胞毒性的化合物—过氧化氢与甲醛。过氧化氢可由过氧化氢酶(CAT)催化分解为H2O和O2。甲醛进入同化途径或者异化途径被继续分解利用。同化途径中,甲醛在二羟丙酮合酶(DAS)的催化作用下与5-磷酸-木酮糖(Xu5P)反应生成二羟丙酮(DHA)和三磷酸甘油醛(GAP)。GAP和DHA进入细胞质,被一系列酶催化最终生成6-磷酸果糖(F6P),然后用于Xu5P的再生[12]和细胞成分的生物合成。异化途径中甲醛被释放至细胞质,在一系列酶的作用下生成CO2和NADH[13]。异化途径主要的作用为解除甲醛毒性和提供能量(NADH)[13]。
毕赤酵母的甲醇利用率和同化效率都较低。高甲醇浓度对菌体具有毒性,中间代谢产物甲醛的积累会严重抑制细胞生长,减小甲醇利用通量,严重制约蛋白及化学品的合成[14]。进入代谢途径的甲醇50%~80%通过异化途径生成CO2排出,导致大量碳原子损失[15- 16]。当甲醇作碳源时,毕赤细胞中过氧化物酶体几乎占整个细胞体积的80%,AOX增至细胞总蛋白的35%~40%[17]。AOX与二羟丙酮合酶(DAS)随机分散于内部[17],AOX与DAS的相对分散会导致甲醛的分散积累更加严重。Guo等[18]发现,对异化途径进行下调或缺失会导致NADH和ATP供量减少,影响细胞代谢的平衡,无法提高细胞利用甲醇合成目的产物的通量。Krainer等[19]通过过表达甲醇代谢关键酶DAS使细胞利用底物甲醇转化目的蛋白的效率提高2~3倍,其转化速率较慢。因而提高同化途径效率,增加目的蛋白产量的重要方法之一是直接增强甲醇同化途径代谢,提高途径通量。
基于多酶组装技术构建高效催化的超分子复合体系是酶催化领域的研究热点。通过多酶组装可实现底物通道作用,即反应中间产物不经主体溶剂扩散,直接从一个酶的活性位点传递至下一个酶的活性位点,有效防止中间体在扩散或竞争途径中损失,提高酶级联反应转化效率[20- 24]。源于Streptcoccuspyogenes纤粘蛋白FbaB的CnaB2结构域的SpyTag/SpyCatcher体系包含两个部分:SpyTag(13个氨基酸残基)和SpyCatcher(113个氨基酸残基),SpyTag的Asp117和SpyCatcher的Lys31 能自发形成异肽共价键实现分子黏合[25- 26],主要用于生物耦联、生物膜制备以及多酶自组装等[27]。Yin等[28]构建了SpyTag/SpyCatcher介导的合成靛蓝的双酶(单加氧酶和葡萄糖脱氢酶)自组装复合体,在大肠杆菌中表达后,靛蓝产量达258 mg/L,是未组装多酶系统的1.9倍,这为SpyTag/SpyCatcher在合成生物学中的应用奠定了基础。但迄今为止SpyTag/SpyCatcher体系在毕赤酵母中的异源表达及自组装鲜见报道。
本研究针对毕赤酵母甲醇代谢关键酶AOX和DAS分子构象设计双酶复合体系的组装结构,利用SpyTag/SpyCatcher体系对AOX和DAS进行组装,构建底物通道,以减少甲醛扩散和积累,增大同化途径通量,缓解毕赤酵母甲醇利用低效问题。研究先采用双分子荧光互补(BiFC)技术[29]的黄色荧光蛋白YFP验证了SpyTag和SpyCatcher是否能在毕赤酵母内自识别和组装,随后构建了SpyTag-DAS1与SpyCatcher-AOX1超分子双酶复合物,利用双分子荧光互补标记观察超分子双酶复合物是否形成。然后,通过在胞内表达超分子双酶复合物的重组毕赤酵母中分泌表达绿色荧光蛋白EGFP为报告蛋白,分析了细胞利用甲醇合成目的蛋白的产量,结果显示自组装双酶体系能够有效地提高毕赤酵母甲醇利用效率。本研究为构建高效利用甲醇的毕赤酵母人工细胞提供了一种新思路。
1 材料与方法
1.1 材料
1.1.1 基因
DAS1基因(GenBank:FJ752551.1)、SpyTag/ SpyCatcher(PDB:4MLI)基因以及黄色荧光蛋白YFP(GenBank:BAF90852.1)基因由上海捷瑞生物工程有限公司合成。
1.1.2 质粒、菌种和引物
本研究使用的质粒和菌株见表1,使用的引物见表2。

表1 本研究使用的菌株及质粒Table 1 Strains and plasmids used in this study

表2 本研究使用的引物Table 2 Primers used in this study
1.1.3 工具酶与试剂
限制性内切核酸酶均购自TaKaRa公司,酵母基因组DNA提取试剂盒购自宝生物工程(大连)有限公司,质粒小量提取试剂盒、DNA胶回收试剂盒和NEBuilder HiFi DNA Assembly Master Mix同源重组试剂盒购自Magen公司,博来霉素购自Invitrogen公司。
1.1.4 培养基
低盐细菌LB(LBL)液体培养基:0.5%酵母提取物,1%胰蛋白胨,0.5%氯化钠。添加2%的琼脂为LBL固体培养基。添加25 μg/mL博来霉素和2%的琼脂为博来霉素抗性LBL(LBLZ)固体培养基。
酵母提取物蛋白胨葡萄糖(YPD)液体培养基:1%酵母提取物,2%蛋白胨,2%葡萄糖。添加2%的琼脂为YPD固体培养基。添加100 μg/mL 博来霉素和2%的琼脂为博来霉素抗性YPD(YPDZ)固体培养基。
最小葡萄糖(MD)培养基:1.34%无氨基酸酵母氮源YNB,2%葡萄糖,2%琼脂。
含缓冲液的最小甘油复合培养基(BMGY)液体培养基:1%酵母提取物,2%蛋白胨,1.34%无氨基酵母氮源(不含氨基酸),1%(体积分数,下同)甘油。
含缓冲液的最小甲醇复合培养基(BMMY)液体培养基:1%酵母提取物,2%蛋白胨,1.34%无氨基酵母氮源(不含氨基酸),1%~2%(体积分数,下同)甲醇。
酵母提取物甲醇蛋白胨(YPM)固体培养基:1%酵母提取物,2%蛋白胨,3%(4%、5%)甲醇,2%琼脂粉。
1.1.5 仪器设备
基因扩增(PCR)仪Mastercycler gradient购自德国Eppendorf公司,酶标仪Multiskan Ascent和微型紫外分光光度计NanoDrop 1000购自美国赛默飞公司,电穿孔仪MicroPluser购自美国Bio-rad公司,摇床ZWYR-D2402购自上海智诚分析仪器制造有限公司,激光共聚焦扫描显微镜LSM710购自ZEISS公司。
1.2 实验方法
1.2.1 SpyTag/SpyCatcher胞内组装验证毕赤酵母细胞的构建
将质粒pPICZαA-YN-SpyTag经MssI 酶线性化后,电转GS115感受态,利用YPDZ平板筛选。挑选菌落进行反复冻融法破壁,用引物P1和P2鉴定整合情况,获得GS115-YN-SpyTag。将pPICZαA-YN、pPIC9K-YC-SpyCatcher经MssI 酶线性化后,电转GS115-YN-SpyTag感受态,利用最小葡萄糖培养基MD平板筛选。挑选菌落用反复冻融法破壁,用引物P1和P3鉴定整合情况,获得GS115-YN-SpyTag-YC-SpyCatcher,命名为NTCC。
1.2.2 SpyTag/SpyCatcher胞内组装验证-BiFC分析
将菌株NTCC接种至YPD液体培养基中,温度30 ℃,转速250 r/min,培养过夜,转接至含1%甲醇的BMMY液体培养基中,控制起始D(600)=1,进行诱导表达24 h后,取250 μL菌液作为样品,以7 000 r/min离心处理5 min,弃掉上清,用磷酸缓冲盐溶液PBS(pH7.4)洗涤菌体3次,用500 μL PBS(pH7.4)重悬菌体,30 ℃暗置1 h。使用激光共聚焦显微镜,激发波长为515 nm[30],检测样品荧光。
1.2.3 基于SpyTag/SpyCatcher的双酶胞内组装验证载体的构建
以pPICZαA为模板,用引物P4和P5扩增出pPICZαA片段;以pPICZαA-YN-SpyTag为模板,用引物P6和P7扩增出YN-SpyTag基因;以pPIC9K-DAS1为模板,用引物P8和P9扩增出DAS1基因。通过设计引物的序列,使获得的片段之间存在20 bp重叠,用以通过同源重组进行片段融合成重组质粒。将同源重组的产物pPICZαA-YN-SpyTag-DAS1转化到感受态TOP10,用LBL平板筛选和菌落PCR鉴定,并送至苏州金唯智生物科技有限公司测序,将正确的菌株保存。以pPIC9K-YC-SpyCatcher为模板,用引物P10和P11扩增出YC-SpyCatcher基因;以GS115基因组为模板,用引物P12和P13扩增出AOX1基因。将pPIC9K质粒用BamHI和NotI双酶切,获得pPIC9K片段。通过设计引物的序列,使得获得的片段之间以及片段与pPIC9K双酶切的两端存在20 bp重叠,用以通过同源重组进行片段融合成重组质粒pPIC9K-YC-SpyCatcher-AOX1。将片段同源重组后转化感受态TOP10,用含有KanR的LB平板筛选菌落PCR鉴定,并送至苏州金唯智生物科技有限公司测序,将正确的菌株保存。
1.2.4 基于SpyTag/SpyCatcher的双酶胞内组装验证细胞的构建
将重组质粒pPICZαA-YN-SpyTag-DAS1用MssI 酶线性化后,电转GS115感受态,利用YPDZ平板筛选。挑选菌落进行反复冻融法破壁,进行菌落PCR鉴定整合情况,获得GS115-YN-SpyTag-DAS1菌株。将重组质粒pPIC9K-YC-SpyCatcher-AOX1用MssI 酶线性化后,电转GS115-YN-SpyTag-DAS1感受态,利用MD平板筛选。挑选菌落进行反复冻融法破壁,进行菌落PCR鉴定整合情况,获得GS115-YN-SpyTag-DAS1-YC-SpyCatcher-AOX1菌株,命名为YNDCA。
1.2.5 基于SpyTag/SpyCatcher的双酶胞内组装验证
将菌株YNDCA按第1.2.2节的方法进行组装验证。
1.3 SpyTag/SpyCatcher自组装菌株的构建
1.3.1 SpyTag-DAS1/Spycathe-AOX1表达载体的构建
以pPICZαA-YN-SpyTag-DAS1为模板,用引物P14和P15扩增出SpyTag-DAS1片段。将质粒pPIC9K和SpyTag-DAS1片段分别用PmlI和NotI双酶切,对表达载体pPIC9K和SpyTag-DAS1片段进行酶切产物回收。用T4连接酶连接片段和质粒,得到重组质粒pPIC9K-SpyTag-DAS1,转化到感受态TOP10,用LBL平板筛选和菌落PCR鉴定,并送至苏州金唯智生物科技有限公司测序,将正确的菌株保存。以pPIC9K-YC-SpyCatcher-AOX1为模板,用引物P16和P17扩增出SpyCatcher-AOX1基因。将质粒pPICZA-loxp/Cre和SpyCatcher-AOX1片段分别用PmlI和NotI双酶切,对表达载体pPICZA-loxp/Cre和SpyCatcher-AOX1片段进行酶切产物回收。用T4连接酶连接片段和质粒,得到重组质粒pPICZA-loxp/Cre-SpyCatcher-AOX1,转化到感受态TOP10,用LBL平板筛选和菌落PCR鉴定,并送至苏州金唯智生物科技有限公司测序,将正确的菌株保存。
1.3.2 共表达SpyTag-DAS1和Spycathe-AOX1毕赤酵母细胞的构建
将重组质粒pPIC9K-SpyTag-DAS1用BglII 酶线性化后,电转GS115感受态,利用MD平板筛选。挑选菌落进行反复冻融法破壁,进行菌落PCR鉴定整合情况,获得GS115/△AOX1-SpyTag-DAS1菌株。将重组质粒pPICZA-loxp/Cre-SpyCatcher-AOX1用限制性内切酶MssI进行单酶切线性化后,电转GS115/△AOX1-SpyTag-DAS1感受态,利用YPDZ平板筛选。挑选菌落进行反复冻融法破壁,进行菌落PCR鉴定整合情况,将正确的菌株接种至含1%甲醇的酵母提取物甲醇蛋白胨YPM液体培养基中,对菌株中的Cre重组酶进行诱导表达48 h后,取50 μL菌液分别涂布于YPDZ平板和YPD平板中,30 ℃培养72 h观察结果。若菌株只在YPD的平板上生长,同时在YPDZ平板上不生长,说明目的菌株的博来霉素抗性基因被Cre重组酶成功切除。将敲除博来霉素抗性的菌株GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1保存。
1.3.3 EGFP表达载体转化重组毕赤酵母宿主
将重组质粒pPICZαA-EGFP用限制性内切酶KpnII进行单酶切线性化,将线性化质粒电转入GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1感受态,利用YPDZ平板筛选,在平板上挑取阳性转化,进行破壁,提取菌株的基因组用引物EGFP- 1和EFGP- 2进行菌落PCR鉴定,筛选得到菌株GS115/ △AOX1-SpyTag-DAS1-SpyCatcher-AOX1- EGFP,命名为TDCA-EGFP。
1.4 重组酵母的摇瓶培养、EGFP产量测定及甲醇耐受分析
菌株接种于YPD液体培养基中,培养约18 h达到对数生长期。控制起始细胞D(600)=1,分别接种至以2%甲醇为碳源的BMMY培养基,在250 mL的三角瓶中,装液量为25 mL,培养温度30 ℃,转速250 r/min的条件下培养。每隔24 h测定细胞D(600)值,并补充相应体积的甲醇。绘制测定的生长曲线,分析菌株的生长情况;每隔24 h发酵液取样,样品于8 000 r/min离心5 min,取上清,使用酶标仪检测EGFP荧光强度(激发波长488 nm,发射波长505 nm)。取发酵上清液进行聚丙烯酰胺凝胶电泳SDS-PAGE分析,并测定上清蛋白浓度。将重组菌株接种于YPD液体培养基中,于30 ℃、250 r/min培养约48 h。测定D(600),用YPM液体培养基将菌体分别稀释至D(600)值为1.00、0.50、0.10和0.01的4组样品,将样品菌液在甲醇体积分数分别为3%、4%、5%的YPM固体培养基平板上进行点样,30 ℃培养40 h。
2 结果与分析
2.1 YN-SpyTag/YC-SpyCatcher在毕赤酵母细胞中的构建
将质粒pPICZαA-YN-SpyTag经MssI 酶线性化后,电转GS115感受态,利用YPDZ平板筛选,提取阳性转化子基因组进行PCR鉴定整合情况,获得重组菌株GS115-YN-SpyTag(见图1(a))。将质粒pPIC9K-YC-SpyCatcher经MssI酶线性化后,电转GS115-YN-SpyTag感受态,利用MD平板筛选,挑取单菌落进行PCR鉴定转化子整合情况,获得菌株GS115-YN-SpyTag-YC-SpyCatcher(NTCC)(见图1(b))。

(a)重组菌株GS115-YN-SpyTag
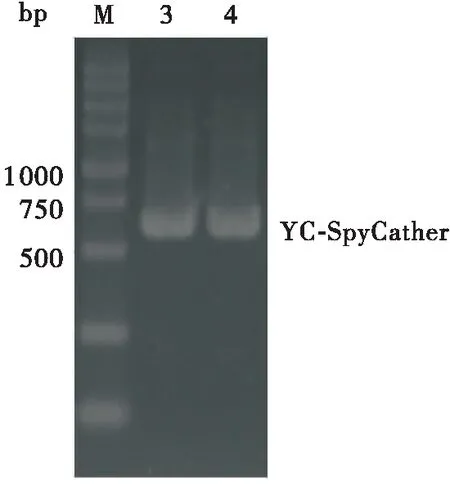
(b)重组菌株NTCC泳道M—DNA marker DL5000;泳道1—GS115-YN-SpyTag;泳道2—pPICZαA-YN-SpyTag;泳道3—GS115-YN-SpyTag-YC-SpyCatcher;泳道4—pPIC9K-YC-SpyCatcher图1 重组酵母的菌落PCR鉴定结果Fig.1 Colony PCR results of recombinant strains
2.2 SpyTag和SpyCatcher胞内自组装验证-BiFC
BiFC是通过将荧光蛋白分割成为不发光的两个片段,分别与目的蛋白融合表达,当目的蛋白发生相互作用时,荧光互补蛋白片段相互靠近从而恢复荧光活性,实现细胞内蛋白相互作用的可视化[29- 31]。本研究将黄色荧光蛋白YFP从Ala154位拆分为YFP的C端(YC)和N端(YN)[32- 33],分别与SpyCatcher(SC)和SpyTag(ST)融合表达用于组装验证。为保证蛋白的正确折叠和功能发挥,使用柔性连接肽(GGGGS)2连接蛋白以实现融合表达。结果发现,单表达YC-SpyCatcher、YN-SpyTag的菌株与共表达YN和YC的菌株都未表现出荧光,表明单独的YFP的C端VN和YFP的C端VC以及共表达的VN都不产生荧光信号(图2(a)和2(b))。在重组菌株NTCC中检测到黄色荧光(图2(c)),表明SpyCatcher和SpyTag在细胞质中相互作用,使得YC和YN相互靠近而产生荧光信号,证明SpyTag/SpyCatcher体系在毕赤酵母胞内可以实现自组装。
2.3 SpyTag-DAS1与SpyCatcher-AOX1胞内组装验证细胞的构建
AOX是相对分子质量为600 ku的同源八聚体[34],毕赤酵母中编码甲醇氧化酶的基因有两个,AOX1与AOX2。AOX1是毕赤酵母的主要醇氧化酶,AOX2的酶活很弱且表达量低,AOX1含量占AOX蛋白总含量的90%[35]。毕赤酵母的AOX单体靶向过氧化酶体中完成寡聚化[15]。DAS为同源二聚体,相对分子质量约为155 ku,在细胞质中进行寡聚化,再靶向过氧化酶体[11]。本研究以AOX1天然同源八聚体结构作为组装骨架,采用SpyTag/SpyCatcher体系对AOX1和DAS1进行组装,构建超分子酶复合物(见图3(a))。

(a)GS115-YC-SpyCatcher-SpyTag

(b)GS115-YN-SpyTag-SpyCatcher

(c)GS115-YN-SpyTag-YC-SpyCatcher图2 共表达SpyTag/SpyCatcher重组Pichia pastoris的BiFC分析Fig.2 BiFC analysis of recombinant Pichia pastoris expressing SpyTag/SpyCatcher

(a)AOX和DAS自组装体系示意图

(b)重组菌株GS115-YN-SpyTag的菌落PCR鉴定 (c)重组菌株YNDCA的菌落PCR鉴定泳道1—pPICZαA-YN-SpyTag-DAS1;泳道2—GS115-YN-SpyTag-DAS1;泳道3—pPIC9K-YC-SpyCatcher-AOX1;泳道4:YNDCA图3 Pichia pastoris中SpyTag-DAS1与SpyCatcher-AOX1胞内组装验证细胞的构建Fig.3 Construction of the self-assembly of SpyCatcher-AOX and SpyTag-DAS1 in Pichia pastoris
将重组质粒pPICZαA-YN-SpyTag-DAS1线性化后电转入GS115感受态,利用YPDZ平板筛选,提取阳性转化子基因组进行PCR鉴定整合情况获得GS115-YN-SpyTag-DAS1菌株(见图3(b))。将构建成功的重组质粒pPIC9K-YC-SpyCatcher-AOX1线性化后电转GS115-YN-SpyTag-DAS1感受态,利用MD平板筛选和PCR鉴定整合情况获得GS115-YN-SpyTag-DAS1-YC-SpyCatcher-AOX1(YNDCA)菌株(见图3(c))。
2.4 SpyTag-DAS1与SpyCatcher-AOX1在胞内组装的验证
本研究将YC和YN分别与SpyCatcher-AOX1与SpyTag-DAS1进行融合表达,采用BiFC验证毕赤酵母中SpyCatcher-AOX1与SpyTag-DAS1的自组装。在重组菌株GS115-YN-SpyTag-DAS1-YC-SpyCatcher-AOX1(YNDCA)中检测到黄色荧光信号(见图4),表明SpyTag-DAS1/SpyCatcher-AOX1体系在YTDCA酵母胞内可以实现自组装形成AOX1和DAS1双酶复合体,进而使互补荧光分子能够恢复黄色荧光活性,且荧光在菌体内主要显示为团状聚集形态,胞质内分散少量荧光。AOX和DAS具有特殊的定位信号肽(PTS)序列[16],靶向过氧化酶体,推测荧光定位显示为双酶复合物,主要位于过氧化酶体,胞质存在的少量荧光可能为未靶向过氧化酶体的AOX1单体和DAS1复合物,但AOX必须进入过氧化酶体才能组装成为活性蛋白,推测利用SpyTag/SpyCatcher体系的双酶组装可能对AOX单体的靶向作用产生一定影响。
2.5 表达EGFP的SpyTag-DAS1与SpyCatcher-AOX1胞内自组装细胞的构建
将构建成功的重组质粒pPIC9K-SpyTag-DAS1线性化后电转入GS115感受态,在MD板上筛选,提取阳性转化子菌落的基因组进行PCR鉴定,获得GS115/△AOX1-SpyTag-DAS1菌株(见图5(a))。将重组质粒pPICZA-loxp/Cre-SpyCatcher-AOX1用限制性内切酶MssⅠ进行单酶切线性化后,电转GS115/△AOX1-SpyTag-DAS1感受态,利用YPDZ平板筛选提取阳性转化子基因组进行PCR鉴定(见图5(b)),将正确的菌株接种至YPM液体培养基中进行Zeocin抗性切除,获得敲除Zeocin抗性的GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1(TDCA)菌株。将重组质粒pPICZαA-EGFP在限制性内切酶作用下进行单酶切线性化,再电转入GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1感受态,利用YPDZ平板筛选,提取阳性转化子基因组进行PCR鉴定整合情况,最终得到菌株GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1-EGFP(TDCA-EGFP)(见图5(c))。
2.6 双酶组装重组菌株在摇瓶中的生长情况和EGFP产量分析
为在AOX与DAS之间构建底物通道,减少甲醛的扩散和积累,本研究将毕赤酵母基因组中的AOX1基因敲除,替换为SpyCatcher-AOX1的基因,再在该菌株中引入SpyTag-DAS1获得表达双酶组装的重组菌株TDCA,引入绿色荧光蛋白EGFP作为报告蛋白,以分析细胞利用甲醇进行生长和蛋白合成的情况。在2%甲醇培养基中摇瓶发酵72 h后,对分泌表达EGFP蛋白的重组菌株发酵上清液进行SDS-PAGE分析,TDCA-EGFP菌株(支架组装菌株)的发酵上清液的EFGP(28.8 ku)条带清晰,且无其他杂条带,EGFP产量为1.52 mg/mL。而GS115-EGFP和未组装菌株GS115-pPIC9K-DAS1-pPICZα-EGFP(无支架组装菌株)的发酵上清液中存在杂条带,表明存在其他杂蛋白(见图6)。

(a)荧光场
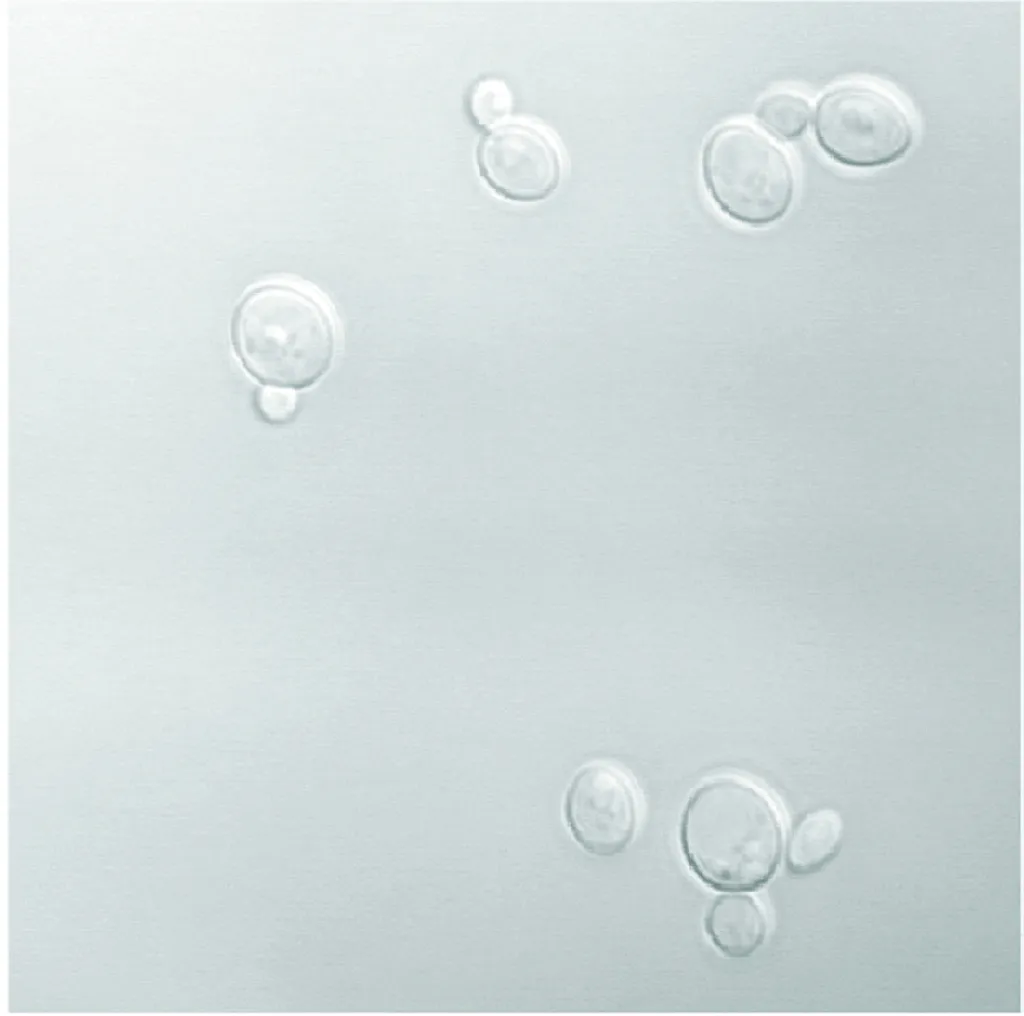
(b)明场

(c)荧光场与明场叠加图4 重组菌株胞内YN-SpyTag-DAS1与YC-SpyCatcher-AOX1自组装的BiFC分析Fig.4 BiFC analysis of the self-assembly of YN-SpyTag-DAS1 and YC-SpyCatcher-AOX1 in the recombinant strain

(a)GS115/△AOX1-SpyTag-DAS1

(b)GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1

(c)GS115/AOX1-SpyTag-DAS1-SpyCatcher-AOX1-EGFP泳道1—GS115/△AOX1-SpyTag-DAS1;泳道3—GS115/△AOX1-SpyTag-DAS1-loxp/Cre-SpyCatcher-AOX1;泳道4—pPICZA-loxp/Cre-SpyCatcher-AOX1;泳道5-6—GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1-EGFP图5 重组菌株的菌落PCR鉴定结果Fig.5 Colony PCR identification results of recombinant strains
在2%甲醇培养基中发酵72 h后,相比菌株GS115-EGFP,表达双酶组装的重组菌株TDCA-EGFP生物量提高了2.3倍。重组菌株TDCA-EGFP的EFGP产量是原始菌株的18.2倍,相比未组装菌株提高了31.5%。单位D(600)细胞表达的EGFP荧光强度相比原始菌株提高了4.51倍,是未组装菌株的2.76倍(见图7)。当甲醇体积分数为2%时,表达外源蛋白EGFP的毕赤酵母的生长几乎停滞,EGFP表达量较低,可能是因为细胞受甲醇毒性影响,生长受到抑制,导致细胞甲醇利用率降低。而表达SpyCatcher-AOX1与SpyTag-DAS1双酶组装体系的重组毕赤酵母菌株的菌体生长虽然减缓,但其利用甲醇生产重组蛋白的能力明显增强,显示双酶复合体能够有效地促进细胞利用甲醇进行生物转化最终合成重组蛋白。

泳道1—GS115-EGFP;泳道2—GS115-pPIC9K-DAS1-pPICZα-EGFP;泳道3—TDCA-EGFP图6 TDCA-EGFP菌株分泌表达EGFP的SDS-PAGE分析Fig.6 SDS-PAGE analysis of recombinant strains TDCA-EGFP
将表达双酶组装的重组菌株TDCA-EGFP在甲醇浓度为3%、4%、5%的YPM固体培养基平板上进行点样以分析菌株甲醇耐受性。相比原始菌株GS115-pPICZα-EGFP,在3%~5%的甲醇培养基中,表达双酶组装和未组装的重组菌株耐受性明显提高,可以在含5%甲醇的YPM固体培养基上生长(见图8(c))。毕赤酵母在高浓度甲醇培养基(>5 %)上表现出生长受损[36],因为细胞代谢甲醇产生的甲醛会迅速积累,甲醛的细胞毒性会导致细胞生长受到抑制。过表达DAS1有利于增强毕赤酵母甲醇耐受性。根据菌株甲醇耐受性分析结果,表达双酶组装的重组毕赤酵母中的过表达SpyTag-DAS1是对DAS1进行过表达,提高了细胞代谢甲醛的能力,减小了甲醛积累的毒性,从而提高了甲醇耐受性,使得细胞能够在含5%甲醇的YPM固体培养基上生长,推测AOX与DAS的组装对细胞甲醇耐受没有明显的影响。
相比原始菌株和未组装菌株,TDCA-EGFP菌株的生长和蛋白合成状态良好,利用甲醇生物转化合成外源蛋白的能力增强,证明同化利用甲醇合成目的蛋白的通量提高。结合耐受实验结果分析可知,相比未组装菌株,TDCA-EGFP菌株在以甲醇为碳源的摇瓶培养过程中的生物量偏低;原因并非是菌株甲醇耐受性差,推测可能原因有两种:一为融合表达支架蛋白SpyTag和SpyCatcher的DAS1和AOX1的表达量和酶活有所下降,导致细胞甲醇代谢受限;二为双酶组装引起的同化途径的增强,可能会导致异化途径的减弱,NADH和ATP供量减少,影响细胞能量平衡[14],进而影响细胞的菌体生长。
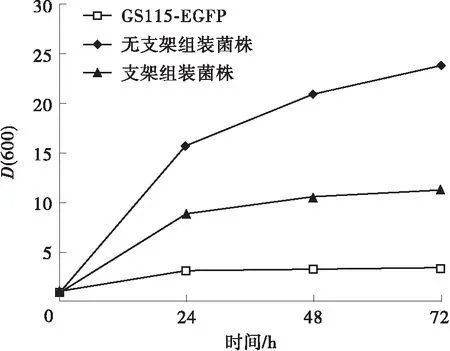
(a)生长曲线

(b)EGFP产量
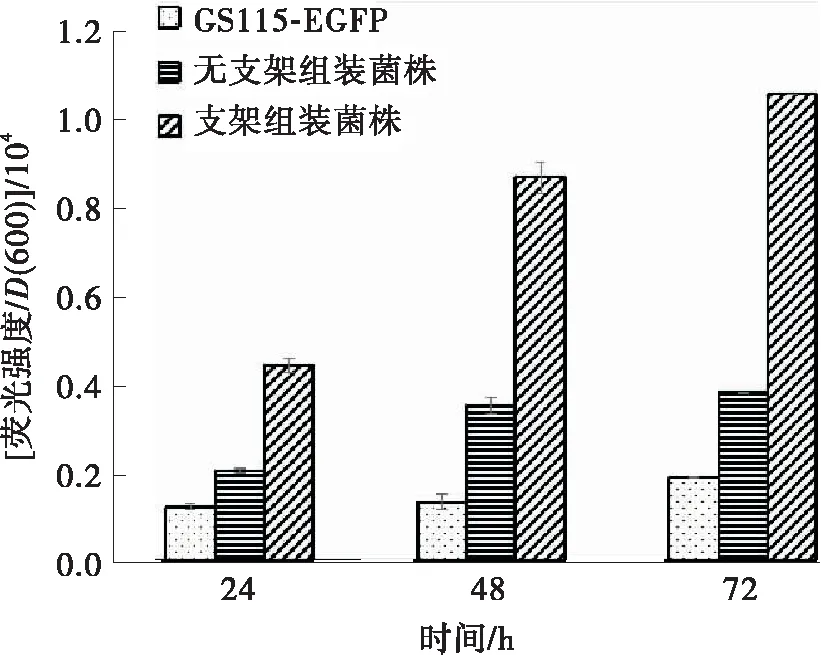
(c)单位D(600)细胞表达的EGFP的荧光强度无支架组装菌株:GS115-pPIC9K-DAS1-pPICZα-EGFP;支架组装菌株:GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1-pPICZα-EGFP图7 TDCA-EGFP菌株在2%甲醇浓度培养基中EGFP产量及生长曲线Fig.7 EGFP production and growth curves of TDCA-EGFP in 2% methanol concentration medium
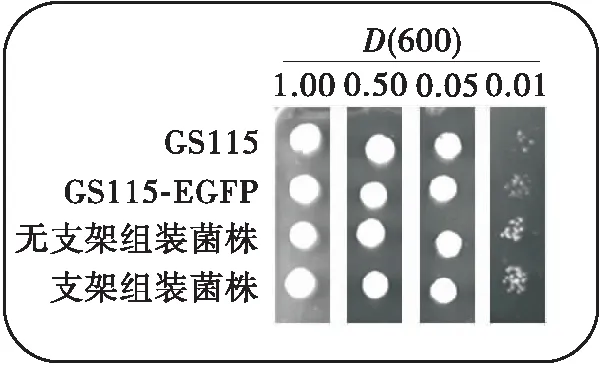
(a)3%甲醇的YPM

(b)4%甲醇的YPM

(c)5%甲醇的YPM无支架组装菌株:GS115-pPIC9K-DAS1-pPICZα-EGFP;支架组装菌株:GS115/△AOX1-SpyTag-DAS1-SpyCatcher-AOX1-pPICZα-EGFP图8 重组菌株甲醇耐受分析Fig.8 Methanol tolerance analysis of recombinant strains
3 结论
本研究分析毕赤酵母利用甲醇合成目的蛋白的关键节点问题,设计利用蛋白质支架SpyCatcher和SpyTag的相互作用组装甲醇代谢途径的关键酶AOX和DAS构建双酶复合物,在酶与酶之间构建底物通道,减小毒性中间代谢物甲醛的积累和扩散,增大毕赤酵母利用甲醇的同化途径通量,以提高细胞生成目的产物的能力。本研究中,验证了SpyTag/SpyCatcher体系和BiFC在毕赤酵母胞内的可行性,通过在AOX和DAS之间的底物通道,减少甲醛扩散和积累,提高毕赤酵母甲醇代谢途径同化效率,增强了酵母细胞利用甲醇生产目的蛋白的能力,提高了目的蛋白产量,证明在毕赤酵母中通过调控关键酶之间的空间状态实现提高底物代谢方向和通量的可能性,为解决毕赤酵母甲醛毒性积累,提高甲醇利用效率,构建高效利用甲醇的毕赤酵母人工细胞提供了一种新方向。
