酵母酶解物对HUVEC细胞氧化损伤的保护机制
2022-02-21黄滟波孙为正侯轶孙江文刘光毅胡松青
黄滟波 孙为正 侯轶 孙江文 刘光毅 胡松青†
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.华南理工大学 制浆造纸工程国家重点实验室,广东 广州 510640;3.华南理工大学医院,广东 广州 510640;4.中新国际联合研究院,广东 广州 510555)
活性氧是组织、细胞的基本成分,在细胞信号与稳态方面有重要的作用[1]。过量的活性氧会引起细胞内大分子的氧化损伤,进而造成生物膜损伤、蛋白质变性、各种酶失活、加速脂肪氧化和诱导DNA复制表达错误等问题,导致机体细胞和组织器官的各种损伤,引发一系列慢性疾病,如糖尿病、高血压、心血管疾病等[2]。食物是抗氧化剂的重要来源,世界卫生组织(WHO)一直主张在世界范围内增加饮食中的抗氧化剂[3]。蛋白质水解产物是天然抗氧化活性物质的重要来源。Oh等[4]报道紫贻贝的糜蛋白酶酶解产物具有较强的体外抗氧化活性,细胞实验显示其可以减少人脐静脉内皮细胞(HUVEC)细胞氧化损伤模型中活性氧(ROS)的生成,提高细胞的谷胱甘肽(GSH)、超氧化物歧化酶(SOD)及过氧化氢酶(CAT)等物质的抗氧化能力,同时可以通过下调caspase- 3、p53等蛋白的基因转录水平减少内皮细胞的凋亡。
本课题组在前期研究中利用芽孢杆菌发酵生产粗酶制剂酶解食用酵母获得了酵母酶解物(YH),并通过动物实验发现YH具有较强的降血压活性[5]。YH主要成分为多肽(占67.32%),另外存在少量糖(16.84%)、水分(6.80%)及核酸(0.44%)。从YH中鉴定得到了778个多肽序列,其中91%以上多肽相对分子质量小于1500。另外,YH中含有较多的疏水性氨基酸和芳香族氨基酸,推测其可能具有一定的抗氧化活性。由于氧化应激和血管内皮功能障碍在高血压的病理生理中起着重要作用,血管内皮细胞能产生的ROS包括超氧阴离子、H2O2、NO、过氧硝酸盐及羟自由基等,可通过不同的途径影响血管内皮功能[6]。许多具有降血压活性的药物或天然产物同时也具有较强的抗氧化活性[7- 9]。因此,本研究分析了YH的抗氧化活性,探讨其对H2O2引起的人脐静脉内皮细胞损伤的保护作用,可为YH在抗氧化功能食品及医药领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
食用酵母粉,购自广东省五洲制药有限公司;谷胱甘肽(GSH),购自广州健阳生物科技有限公司;邻苯三酚,购自上海润捷化学试剂有限公司;1,1-二苯基- 2-三硝基苯肼(DPPH),美国Sigma公司生产;H2O2(30%,体积分数),购自国药集团化学试剂有限公司;达尔伯克改良伊格尔(DMEM)细胞培养液、胎牛血清、青霉素/链霉素双抗、胰酶-乙二胺四乙酸(Trypsin-EDTA)、磷酸盐缓冲液(PBS),美国Thermo Fisher公司生产;噻唑蓝(MTT)、二甲基亚砜(DMSO)、台盼蓝,购自北京索莱宝科技有限公司;细胞培养瓶、无菌离心管,美国Corning公司生产;SOD、丙二醛(MDA)、二喹啉甲酸(BCA)蛋白定量试剂盒,南京建成生物工程研究所生产;人脐静脉细胞融合细胞系(EA.hy 926),购自中国科学院上海细胞库;原代HUVEC细胞、内皮细胞完全培养液及内皮细胞基础培养液,购自奥赛尔斯生物技术(上海)有限公司。
YH按参考文献[10]所述方法制备。以芽孢杆菌发酵产粗酶对食用酵母进行水解,水解产物离心弃去沉淀,上清液喷雾干燥后制得YH。经测定其主要成分为多肽和还原糖[5]。
1.2 仪器与设备
BSC- 1304IIA2型超净工作台,苏州安泰空气技术有限公司生产;SHELLAB2406型CO2培养箱,美国希尔顿制造股份有限公司生产;Axio vert型显微镜,德国Zeiss公司生产;5804R型冷冻离心机,德国Eppendorf公司生产;DW-HL678型超低温冰箱,中科美菱低温科技股份有限公司生产;Synergy Neo2型酶标仪,美国BioTek公司生产。
1.3 实验方法
1.3.1 DPPH自由基清除活性
DPPH自由基清除活性测定参考文献[11]的方法进行。样品组:取100 μL样品与100 μL 0.1 mmol/L 的DPPH乙醇溶液,室温避光反应1 h后,利用酶标仪测定517 nm处的吸光值(Dm);对照组以等量的去离子水代替样品溶液,反应后测517 nm处的吸光值(Dn);背景组:取100 μL样品与100 μL无水乙醇,室温避光1 h后,利用酶标仪测定517 nm处的吸光值(Dx)。按式(1)计算DPPH自由基清除率(S)。
S=[1-(Dm-Dx/Dn)]×100%
(1)
1.3.2 超氧阴离子清除活性
以邻苯三酚法测定样品的超氧阴离子清除活性[12]。取13 μL一定质量浓度的样品溶液和174 μL的Tris-HCl缓冲液(pH=8.2,0.5 mol/L)混合均匀后加入96孔板,25 ℃保温10 min。然后加入13 μL邻苯三酚溶液(3 mmol/L,10 mmol/L HCl)迅速摇匀后,在酶标仪上每隔30 s测定一次321 nm处的吸光值,总测定时间为150 s,计算线性范围内吸光度的增加,以蒸馏水代替样品溶液为对照组。按照式(2)计算超氧阴离子清除活性:
A=(1-Vs/Vc)×100%
(2)
式中,Vc为对照组邻苯三酚自氧化速率;Vs为样品组邻苯三酚自氧化速率。
1.3.3 还原力测定
还原力的测定参考Benjakul等[13]的方法。样品溶于0.2 mol/L的PBS 缓冲液。向试管中依次加入1.0 mL不同质量浓度(0.5、1.0、2.0、3.0、4.0、5.0、6.0、7.0 mg/mL)的样品以及1 mL 1%的铁氰化钾。之后于50 ℃水浴20 min,加入2 mL 10%的三氯乙酸终止反应。5 min后,再加入1.25 mL 0.1%的三氯化铁,混合均匀,静置30 min,测量反应液在700 nm处的吸光度值。以0.2 mol/L的PBS(pH=6.6)代替样品为空白对照,用GSH为阳性对照。
1.3.4 YH对氧化损伤细胞增殖的影响
EA.hy 926细胞培养液组成为90%DMEM培养液(添加NaHCO31.5 g/L,pH=7.0)、10%胎牛血清及1% 青霉素/链霉素双抗。
采用MTT法测定细胞增殖情况[14]。取对数期细胞消化后以1.0×105个/mL的密度接种于96孔板,每孔接入100 μL,边缘孔及未用孔以无菌PBS缓冲液填充。放入细胞培养箱培养24 h后,吸弃原培养液,加入以无血清培养液配制的不同浓度样品培养24 h,吸弃细胞培养液。然后在体系中加入200 μL H2O2浓度为250 μmol/L的无血清培养液继续培养,之后于24 h和48 h时每孔加入20 μL MTT(5 mg/mL)。继续培养4 h,吸弃孔中液体,加入150 μL DMSO轻微震荡10 min,用酶标仪测定570 nm 处的吸光值。以无细胞培养液,加入等量MTT相同处理作为调零孔。细胞存活率通过实验组吸光值除以对照组吸光值计算。实验分组如下。
空白对照组:无血清培养液代替样品溶液,不添加H2O2。损伤对照组:无血清培养液代替样品溶液,H2O2浓度为250 μmol/L。损伤+YH低剂量组:YH 250 μg/mL,H2O2250 μmol/L。损伤+YH高剂量组:YH 500 μg/mL,H2O2250 μmol/L。阳性对照组:GSH 1.63 μmol/L,H2O2250 μmol/L。
1.3.5 YH对细胞SOD和MDA的影响
取对数期细胞消化后以1.0×105个/mL的密度接种于6孔板,每孔接入1 mL,每个实验组4个复孔。培养24 h待细胞长满孔底90%以上时,吸弃原培养液,按分组加入以无血清培养液配制的样品继续培养24 h后吸弃细胞培养液。然后在体系中加入1 mL H2O2浓度为250 μmol/L的无血清培养液继续培养24 h。之后弃去细胞培养液,以胰酶消化细胞,离心后弃去上清液,再用4 ℃预冷的PBS重悬细胞并离心,重复两次,收集细胞并通过液氮反复冻融使细胞破碎。离心收集破碎后细胞进行SOD和MDA的测定。
细胞内总蛋白含量以BCA法试剂盒进行检测,细胞内SOD以试剂盒进行检测,细胞内MDA以硫代巴比妥酸(TBA)法试剂盒进行检测。
1.3.6 转录组学研究
由于EA.hy 926是HUVEC细胞与A549肺癌细胞融合的永生化细胞系,含有A549细胞基因。因此,转录组学研究采用原代HUVEC细胞为实验模型。实验分为2组:空白对照组(3个生物学平行分别命名为CTRL1、CTRL2、CTRL3)和YH组(300 μg/mL,3个生物学平行分别命名为YH1、YH2、YH3)。样品均以无血清基础培养液溶解,过0.22 μm滤膜除菌,每个实验组设置3个生物学平行。对数期细胞以1.0×105个/mL的密度均匀接种至T 25 cm2细胞培养瓶,接种量4 mL。待培养至细胞长满底部80%以上时,吸弃原培养液换以4 mL 基础培养液培养12 h,使细胞生长同步化。之后弃去培养液,加入4 mL含待测样品的基础培养液,对照组加入4 mL无血清培养液继续培养24 h后结束培养。之后弃去培养液,用PBS小心清洗细胞后加1 mL TRIzol试剂裂解细胞反复吹打至液体澄清透明,液氮速冻保存,送上海美吉生物科技有限公司进行转录组学测序分析。
1.3.7 数据统计
所有数据利用SPSS statistics进行统计分析,以单因素方差分析方法进行差异比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结果与讨论
2.1 YH的抗氧化活性
YH的DPPH清除活性结果见图1所示。随着YH浓度升高,DPPH自由基清除活性逐渐提高。在0.5~2.0 mg/mL范围内,DPPH自由基清除率与YH浓度有剂量效应。当YH浓度继续增大,自由基清除率增长趋于平缓,通过曲线拟合计算测定其半数效应浓度(EC50)为1.85 mg/mL。Ahn等[15]将三文鱼加工后的副产品利用碱性蛋白酶、胃蛋白酶、胰蛋白酶等进行水解,水解产物对 DPPH 清除的EC50值在1.63~4.95 mg/mL之间。Picot等[16]研究发现鱼蛋白水解物对DPPH清除的EC50值为24.7 mg/mL。大麦醇溶蛋白的碱性蛋白酶水解物EC50在0.5~3.8 mg/mL范围内[17]。与这些研究相比,YH具有一定的DPPH清除活性。
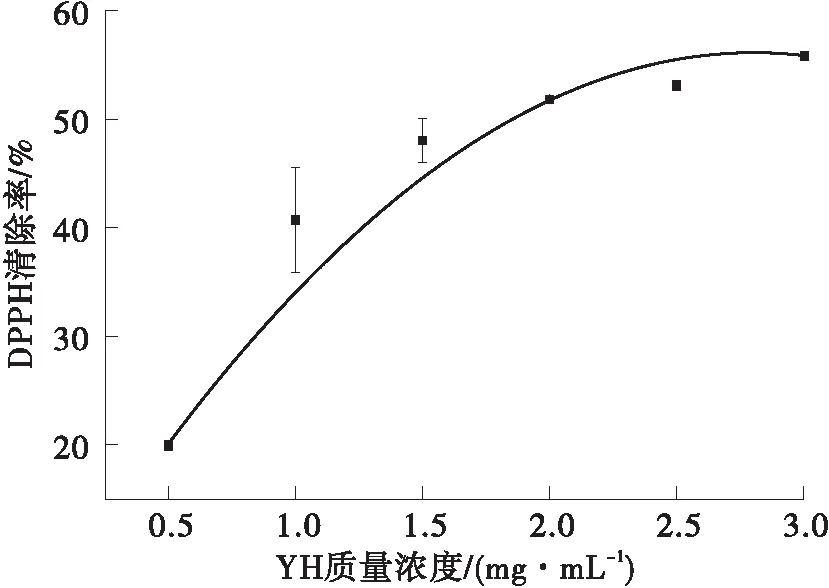
图1 YH的DPPH自由基清除活性Fig.1 DPPH free radical scavenging activity of YH
邻苯三酚自氧化法测定YH的超氧阴离子清除活性结果如图2所示。在5~25 mg/mL范围内,超氧阴离子清除活性随着YH浓度升高逐渐提高,其EC50为20.27 mg/mL,表明YH具有一定的超氧阴离子清除能力。YH还原力的测定结果如图3所示。在测定范围内,YH的还原力随浓度升高而增加,线性关系良好。当D(700)=0.5时,YH质量浓度为4.87 mg/mL,GSH质量浓度为0.15 mg/mL,YH的还原力是GSH的0.03倍,表明YH的还原能力相对较弱。

图2 YH的超氧阴离子清除活性Fig.2 Superoxide anion scavenging activity of YH

(a)YH

(b)GSH图3 还原力测定结果Fig.3 Results of reducing power assay
2.2 YH对氧化损伤EA.hy 926细胞增殖的影响
在细胞培养液中先加入不同浓度的YH,培养细胞24 h,以未添加YH的细胞为阴性对照。之后再加入H2O2培养24 h以诱导细胞产生氧化损伤,并通过MTT法测定细胞的存活率,以阴性对照组存活率为100%计算。结果显示,250 μmol/L的H2O2处理可以显著抑制EA.hy 926细胞的增殖,损伤模型组的细胞存活率为阴性对照组的(47.80±4.62)%。低、高剂量的YH处理后EA.hy 926细胞的存活率分别为对照组的(46.23±6.36)%和(57.92±8.10)%。低剂量的YH处理细胞后,细胞存活率与模型组相比无显著差异(P>0.05)。而高剂量的YH对细胞氧化损伤的保护作用极显著(P<0.01)。许多蛋白质酶解产物或多肽都被证实对血管内皮细胞的氧化损伤具有保护作用[9,18- 19]。文献报道多肽FWKWP和GIEWA可以将H2O2诱导的HUVEC存活率由51.66%分别提升至(64.74±2.02)% 及(63.99±3.78)%,其作用机制可能是通过促进细胞内SOD活性、清除细胞内活性氧等途径实现的[20]。因此,本研究进一步测定了YH对细胞内氧化指标的影响,以揭示其对血管内皮氧化损伤的保护机制。
2.3 YH对EA.hy 926细胞内MDA和SOD的影响
生物体内,自由基作用于脂质发生过氧化反应,最终产物为MDA,能引起蛋白质、核酸等生命大分子的交联聚合,具有细胞毒性[21]。MDA的含量是反映机体抗氧化潜在能力的重要指标,也能间接反映细胞的过氧化损伤程度。同时,生物体中存在许多抗氧化酶或者有抗氧化作用的化合物如SOD、GSH等,组成了复杂的保护体系,以对抗氧化损伤、维持机体的氧化平衡[22]。通过测定细胞内MDA和SOD的值,可以反映细胞所处的氧化状态,揭示YH对氧化损伤细胞的保护机制。
YH对EA.hy 926细胞内MDA、SOD的影响如图4所示。与对照组相比,H2O2处理的氧化损伤模型细胞内MDA含量由(3.05±0.65)μmol/mg(每毫克蛋白质)升高至(10.99±1.13)μmol/mg。高剂量YH对细胞内MDA的生成有一定程度抑制作用,测定值为(8.05±0.66)μmol/mg(P<0.01)。与对照组相比,H2O2处理的氧化损伤模型细胞内SOD酶活大幅下降,由(43.66±2.76)U/mg(每毫克蛋白质)降至(23.44±2.14)U/mg,表示H2O2对EA.hy 926造成的氧化损伤能极显著降低细胞内的SOD酶活(P<0.01)。当利用不同剂量的YH对氧化损伤的EA.hy 926细胞进行预处理后,细胞内的SOD酶活有了不同程度的变化。阳性对照组GSH可以提升细胞内SOD活性,达(34.83±1.90)U/mg。低剂量YH对氧化损伤细胞内SOD活性无显著影响(P>0.05),高剂量YH则能够提升SOD活性至(30.55±1.38)U/mg。Cai等[20]报道,五肽FPYLRH在100 μg/mL浓度条件下可以极显著地增加H2O2诱导氧化损伤HUVEC细胞的存活率。该五肽可在增加HUVEC细胞中SOD的活力同时,减低MDA的生成量。由以上结果可以看到,YH具有较强的体外抗氧化活性,并能通过抑制MDA生成、提升细胞内SOD活性等途径增强血管内皮细胞抵抗氧化损伤的能力。
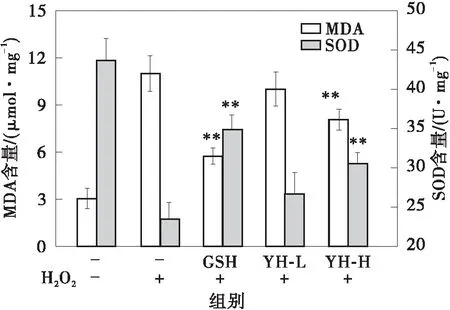
**表示与损伤模型组相比差异极显著(P<0.01)图4 YH对氧化损伤EA.hy 926细胞内MDA和SOD的影响Fig.4 Effects of YH on MDA and SOD of H2O2-induced EA.hy 926 injury model
2.4 YH对HUVEC细胞抗氧化相关基因转录水平的影响
YH组与对照组相比,差异表达基因的情况见图5。图中每个点代表一个特定的基因,横纵坐标的数值都做了对数化处理。纵坐标-lgP越大则表达差异越显著,横坐标中FC表示表达量差异倍数。在左边的点为表达差异下调的基因,右边的点为表达差异上调的基因,越靠近两边和上边的点表达差异越显著。YH组共有577个基因与对照组相比差异显著(P<0.05),其中上调445个,下调132个。值得注意的是,与对照组相比YH组细胞的与氧化应激相关的基因如SOD2和HMOX1等转录水平变化显著。图6中以基因转录本TPM值,即每百万读段中来自于该转录本的读段数,表示该基因转录水平。YH组SOD2基因(ENSG00000285441)转录水平显著上调至对照组的2.88倍,该基因编码的超氧化物歧化酶2(SOD2)是细胞内线粒体内重要的抗氧化酶,具有清除活性氧的作用[23]。文献[24]报道,虾青素可以通过上调SOD2抑制血管衰老。金环蛇抗菌肽(BF- 30)可通过上调细胞内SOD2等抗氧化酶的表达量从而显著改善由H2O2诱导的肾小管上皮细胞(HK- 2)氧化损伤[25]。YH组细胞HMOX1基因(ENSG00000100292)与对照组相比,其mRNA表达量上调2.07倍(见图6)。HMOX1基因编码的血红素加氧酶1(HO- 1)是体内重要的保护蛋白,可降解细胞内过多的游离血红素,被称为人体抵御氧化攻击的第一道防线,该基因的上调被证实有改善内皮细胞功能的作用[26]。研究发现,黄粉虫蛋白质水解产物可保护小鼠肝细胞(AML12)并抵抗H2O2引起的氧化损伤,其机制为通过上调HO- 1等抗氧化酶基因的表达从而降低细胞ROS水平[27]。贝莱斯芽孢杆菌中分离得到的具有抗菌活性和抗氧化活性的多肽MS15,可减少小鼠单核巨噬细胞(RAW264.7)中的ROS产生,并通过促进HO- 1的表达来提高SOD等抗氧化酶的转录速率[28]。大米来源的商品肽Oryza P60预处理肝癌细胞(HepG2)可极显著上调细胞中HO- 1的表达水平,并抵抗由H2O2或对乙酰氨基酚(APAP)引起的细胞毒性[29]。以上结果可知,YH可通过显著上调细胞SOD- 2和HO- 1等抗氧化酶的转录水平实现在细胞模型中的抗氧化活性。YH主要由大量的小分子多肽组成,从中分离、鉴定出有较强抗氧化的多肽,将是本课题下一阶段的研究重点。

图中红色点为显著上调基因,绿色点为显著下调基因,灰色点为非显著差异基因图5 YH组与对照组相比差异表达基因火山图Fig.5 Volcano plots of differential expressed genes of YH group with the control group

图6 HUVEC细胞中SOD2和HMOX1基因mRNA的表达量Fig.6 mRNA expression of SOD2 and HMOX1 genes in HUVEC
3 结论
YH具有体外抗氧化活性,其对DPPH自由基清除的EC50值为1.85 mg/mL。高剂量的YH对由H2O2造成的EA.hy 926细胞增殖活性降低有极显著改善作用(P<0.01)。YH可通过上调HUVEC细胞中与抗氧化活性相关的基因SOD2和HMOX1 mRNA表达量的作用机制,减少细胞内MDA生成,显著促进SOD的生成,实现对人脐静脉内皮细胞的保护活性。YH有望用于降血压或抗氧化相关的功能食品及医药领域。
