壳聚糖修饰甜菜红素脂质体的制备与抗肿瘤活性
2022-02-21赵振刚刘爽游丽君
赵振刚 刘爽 游丽君
(华南理工大学 食品科学与工程学院,广东 广州 510640)
甜菜红色素为一类水溶性含氮色素,甜菜苷是甜菜红素的主要成分,其中还包括前甜菜苷和异甜菜苷等成分[1- 2]。甜菜红素易溶于水,不溶于有机溶剂。甜菜红素具有多种生物活性,如抗氧化[3]、抗炎[4]、抗肿瘤[5]和降血糖[6]等生物活性,但甜菜红素在外部条件影响下容易发生降解,如酶、高温、光照、pH和氧气[7]等条件。此外,由于其低脂溶性,难以通过细胞膜被细胞吸收,因此甜菜红素的生物利用度较低,不利于口服吸收[8]。为克服这两大缺点,采用脂质体对甜菜红素包埋,可提高甜菜红素的稳定性和生物利用度[9]。
脂质体是由磷脂和胆固醇组成的双分子层膜的球形小泡,既可包载水溶性物质,亦可包载油溶性物质。其中水溶性物质位于脂质体的内部核心,油溶性物质嵌于磷脂双分子层中[10]。传统脂质体在储存和加工过程中仍存在诸多问题,如传统脂质体容易发生聚集、融合;脂类成分的氧化水解导致药物泄露[11]。针对这些问题,对脂质体进行表面修饰以提高脂质体的稳定性[12- 13]。壳聚糖是一种天然线性阳离子多糖,溶于酸性溶液中,具有较好的生物相容性、可降解性、低毒性和粘膜粘附性[14],可通过静电相互作用和氢键与脂质体结合[15]。壳聚糖修饰可增加脂质体的稳定性,保护脂类成分在外部刺激下不被降解[16];还可增加脂质体的缓释效果,从而增加被包载物质的活性[17]。Mazloomi等[18]采用0.2 %的壳聚糖修饰脂质体,壳聚糖修饰的脂质体相比于传统脂质体显示出更好的缓释效果、包封率和稳定性。Hao等[19]采用壳聚糖修饰包埋槲皮素的纳米脂质体,其抗氧化性和储存稳定性相比于游离的槲皮素都有较大提升。然而,壳聚糖与纳米脂质体的修饰结合在天然色素中的应用较少,其对甜菜红素生物活性的影响尚不清楚。这方面的研究不仅可以改善甜菜红素的稳定性,还有望通过提升甜菜红素的细胞亲和力进而提高甜菜红素的生物活性,扩大甜菜红素的应用范围。
本研究以壳聚糖作为修饰剂修饰脂质体,构建包埋甜菜红素的药物输送体系。以包封率为指标,分别进行单因素试验和正交试验确定制备甜菜红素纳米脂质体的最佳工艺条件。采用不同浓度的壳聚糖修饰甜菜红素纳米脂质体并测定脂质体的粒径、多分散指数(PDI)和Zeta电位,用以评价甜菜红素、甜菜红素纳米脂质体(NLP)和壳聚糖修饰的脂质体(CH-NLP)对HepG2细胞的抗增殖活性和细胞毒性。
1 实验部分
1.1 材料与试剂
甜菜红素(糊精稀释),上海瑞楚生物科技有限公司生产;大豆卵磷脂(纯度>90%),上海阿拉丁生化科技股份有限公司生产;胆固醇,国药集团化学试剂有限公司生产;透析袋(7000 u),上海源叶生物科技有限公司生产;HepG2细胞,源自广州中山大学动物实验中心。高糖杜氏改良Eagle培养基(DMEM)、青霉素和链霉素溶液,美国Gbico公司生产;胎牛血清,浙江天航生物科技有限公司生产。
1.2 仪器与设备
旋转蒸发仪,德国海道夫公司生产;超声细胞破碎JYⅡN,宁波新芝生物科技有限公司生产;Zetasizer Nano ZSE,英国马尔文仪器有限公司生产;核酸蛋白分析仪,美国贝克曼库尔特有限公司生产。
1.3 实验方法
1.3.1 甜菜红素纳米脂质体的制备
参考吴琦[20]的方法,采用逆相蒸发法制备脂质体。将大豆卵磷脂溶于9 mL乙醚中,甜菜红素溶于pH 6.8 0.05 mol/L的磷酸盐缓冲溶液(PBS)溶液中,向乙醚溶液中加入3 mL甜菜红素溶液,短时冰浴超声处理。超声功率为330 W,开1 s,关1 s,形成稳定的油包水(W/O)乳液。旋转蒸发仪除掉乙醚,当达到胶态后加入适量的含有吐温80的PBS溶液水合半小时,水合后的混悬液再一次短时冰浴超声处理以缩小脂质体粒径。混悬液储存在4 ℃冰箱中备用。
1.3.2 包封率及载药率的计算
参考童桂鸿[21]的方法测定脂质体的包封率和载药率,并进行简单的修改。取适量脂质体混悬液置于透析袋中,封口,按照1:100(透析内液:透析外液)的比例用pH 6.8 0.05 mol/L的PBS溶液透析,温和搅拌,每2 h换一次透析外液,直至透析外液变为无色。分别取透析后和透析前的脂质体混悬液加入10% Trolox-100溶液,溶解脂质。在538 nm下测定吸光度,计算甜菜红素的浓度,包封率(EE)和载药率(DL)的计算公式如下:
EE=m1/m2×100%
(1)
DL=m1/mt×100%
(2)
式中,m1为透析液中甜菜红素质量,m2为脂质体原液中甜菜红素质量,mt为加入的总脂质量。
称取10 mg的甜菜红素,用PBS(pH=6.8,0.05 mol/L)溶液溶解并稀释至5~50 μg/mL甜菜红素溶液,以PBS溶液作为空白,在538 nm下测定吸光值得到的甜菜红素标准曲线回归方程:
y=0.015 9x+0.014 3,r2=0.999 7。
1.3.3 单因素试验
考察单一因素对甜菜红素包封率的影响。在其他条件不变的情况下,选择超声处理时间(2、4、6、8、10 min)、卵磷脂质量浓度(20、30、40、50、60 mg/mL)、卵磷脂与胆固醇质量比即卵胆比(2:1、4:1、6:1、8:1、10:1)、甜菜红素与卵磷脂质量比即药脂比(1:6、1:12、1:18、1:24、1:30)进行研究。
1.3.4 正交试验
在单因素试验的基础上,以包封率为响应值,选出对甜菜红素包封率影响较大的3个因素,即卵磷脂质量浓度(A)、药脂比(B)、卵胆比(C),采用三因素三水平,按L9(34)设计正交试验,确定制备脂质体的最佳工艺条件,并对其进行验证。同时用最优条件制备传统脂质体用于制备壳聚糖修饰的脂质体和后续实验。
将2 g壳聚糖溶解在1%(体积分数)冰醋酸溶液中,过夜搅拌,并稀释成不同浓度的壳聚糖溶液。将纳米脂质体按照1:1(体积比)的比例逐滴加入到壳聚糖溶液中,以500 r/min搅拌1 h,静置0.5 h保证壳聚糖与脂质体充分结合。再在 3 000g4 ℃ 条件下离心30 min以除去多余的未与脂质体结合的壳聚糖。弃掉上清液,加入PBS重悬,得到的溶液放入4 ℃冰箱中储存备用。
1.3.6 粒径、PDI和Zeta电位的测定
取一定量的NLP和CH-NLP用去离子水稀释20倍。在25 ℃下采用Zetasizer Nano ZS型纳米粒度仪测定粒径、PDI和电位,折射指数为(1.420±0.001),每个样品重复测定3次。
1.3.7 细胞毒性
根据Zheng等[22]报道的方法测定脂质体的细胞毒性。采用高糖DMEM培养基培养HepG2细胞,代数为12~30代。高糖DMEM培养基中含有10%胎牛血清和1%青霉素-链霉素溶液。细胞置于37 ℃、含5% CO2的加湿二氧化碳培养箱中培养。癌细胞以2.5×104/孔的密度接种到96孔板中,置于培养箱中孵育12 h。之后弃掉培养基,加入不同浓度的用培养基稀释的脂质体溶液,空白孔为不含药物的培养基溶液。药物处理24 h,24 h后,弃掉培养基,每孔加入50 μL亚甲基蓝染液,置于培养箱中孵育1 h,使得活细胞被亚甲基蓝充分染色。除去亚甲基蓝染液,每孔加入100 μL洗脱缓冲液(49% PBS,50%乙醇,1%乙酸),振荡混合均匀。在570 nm下测定每孔的吸光度。细胞毒性按照式(3)计算:
C=(Dc-Ds)/Dc×100%
(3)
其中,Dc为空白组的吸光度,Ds为加药组的吸光度。
1.3.8 抗增殖活性
石蜡包埋的肝组织蜡块,切成5 μm厚。经二甲苯脱蜡和各级酒精水化后,苏木精染色,盐酸乙醇水化流水冲洗,1%伊红酒精溶液染色,蒸馏水稍洗,再经过脱水和透明后。中性树胶封片,进行图像采集和分析。
根据Wen等[23]报道的方法测定脂质体的抗增殖活性。癌细胞以1.5×104/孔的密度接种到96孔板中,放入培养箱中孵育4 h,待细胞完全贴壁后,弃掉培养基。加入不同浓度的用培养基稀释的脂质体溶液,空白孔为不含药物的培养基溶液,药物处理72 h。弃掉培养基,再按照细胞毒性方法采用亚甲基蓝法染色。将96孔板置于酶标仪中,在570 nm下测定每孔的吸光度。细胞存活率为
V=Dc/Ds×100%
(4)
其中,Dc为空白组的吸光度,Ds为加药组的吸光度。
1.4 统计分析
采用Origin 8.0软件绘图,用Calcusyn计算EC50和CC50,采用SPSS 22.0的ANVOA分析方法对数据进行显著性分析。所有实验都进行3次平行,数据以平均值±标准差表示。CC50为细胞毒性的半抑制浓度。EC50为细胞存活率的半数效应浓度。CC50/EC50为药物的选择指数(SI)。
2 结果与讨论
2.1 单因素试验结果
2.1.1 超声处理时间对甜菜红素纳米脂质体包封率的影响
如图1所示,随着超声时间的增加,甜菜红素脂质体的包封率先增后减。在超声时间为8 min时,包封率达到最大。超声时间较短时,不利于形成油包水的乳液;超声时间较长时,存在破乳的风险,甜菜红素会从内水相泄露,降低包封率。因此选择8 min为最佳超声时间。

不同字母表示具有显著性差异(P<0.05)图1 超声时间对脂质体包封率的影响Fig.1 Effect of ultrasound time on the encapsulation efficiency of the liposome
2.1.2 卵磷脂浓度对甜菜红素纳米脂质体包封率的影响
如图2所示,卵磷脂用量对脂质体包封率有一定的影响。随着卵磷脂浓度的增加,包封率不断增加。当卵磷脂质量浓度超过50 mg/mL时,包封率的变化不再明显。卵磷脂用量增加,载药量上升,因此包封率明显增加。但当卵磷脂浓度过高时,脂质体混悬液过于黏稠,引起脂质体的聚集,甚至出现少量沉淀。因此选择50 mg/mL为卵磷脂的最佳质量浓度。
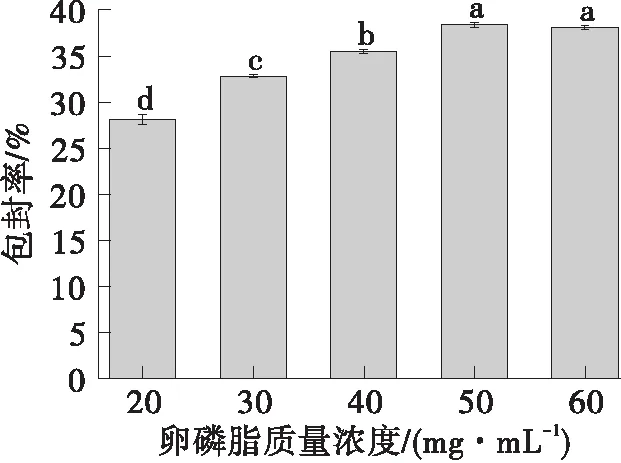
不同字母表示具有显著性差异(P<0.05)图2 卵磷脂质量浓度对脂质体包封率的影响Fig.2 Effect of soybean lecithin mass concentration on the encapsulation efficiency of the liposome
2.1.3 卵胆比对甜菜红素纳米脂质体包封率的影响
如图3所示,随着胆固醇用量的减少,包封率不断减少。胆固醇可以嵌入到脂质膜中调节脂质体的刚性和稳定脂质双分子膜,提高脂质体的稳定性,增加脂质体的包封率。但过量的胆固醇会破坏脂质分子结构,使药物渗出,降低包封率。因此选择2:1为最佳的卵胆比。
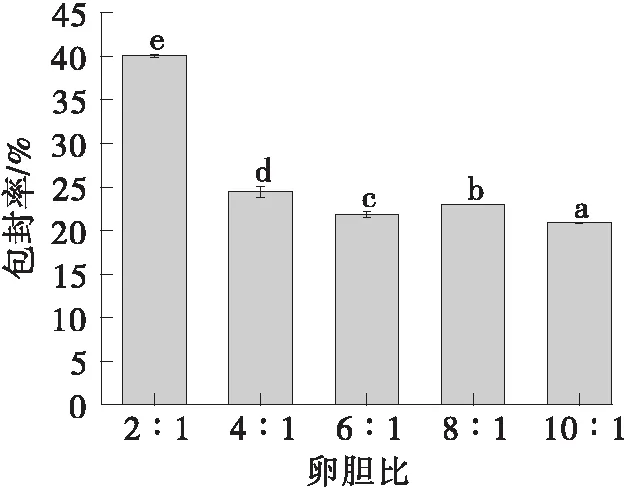
不同字母表示具有显著性差异(P<0.05)图3 卵胆比对脂质体包封率的影响Fig.3 Effect of the ratio of soybean lecithin content to cholesterol content on the encapsulation efficiency of the liposome
2.1.4 药脂比对甜菜红素纳米脂质体包封率的影响
如图4所示,药脂比对包封率是有一定影响的。随着卵磷脂用量的增加,包封率先增加后减小。在药脂比达到1:18时,包封率达到最大,之后小幅降低。当卵磷脂用量增加,可包封的甜菜红素的量随着增高。因此选择1:18作为最佳药脂比。

不同字母表示具有显著性差异(P<0.05)图4 药脂比对脂质体包封率的影响Fig.4 Effect of the ratio of betanin content to soybean lecithin content on the encapsulation efficiency of the liposome
2.2 正交试验优化试验结果
以卵磷脂质量浓度(A)、药脂比(B)、卵胆比(C)为自变量,包封率为因变量,进行三因素三水平正交试验,并采用极差分析对正交试验结果进行分析。按L9(34)设计正交试验,结果见表1。表中D表示空列。

表1 正交试验设计与结果Table 1 Orthogonal experimental design and results
由极差分析结果可以看出,3个因素对甜菜红素纳米脂质体包封率影响的主次顺序为卵胆比、卵磷脂质量浓度、药脂比。比较各因素的K值,确定最佳条件为C3A3B2,即卵磷脂质量浓度60 mg/mL,药脂比1:18,卵胆比6:1。验证最佳条件,得到甜菜红素纳米脂质体的包封率为(42.67±1.67)%,载药量为(2.63±0.42)%。证明该工艺稳定可行。
2.3 壳聚糖修饰的甜菜红素纳米脂质体的制备
采用0.05%、0.10%、0.20%、0.40%、0.60%、0.80%、10.00%(质量分数,余同)的壳聚糖溶液修饰甜菜红素纳米脂质体。平均粒径、PDI和电位如表2所示。由正交试验所得的最佳条件制备得到的甜菜红素纳米脂质体平均粒径为(156.40±2.88)nm,PDI为(0.27±0.01),Zeta电位为(-19.50±0.52)mV。随着壳聚糖含量的增加,脂质体的粒径逐渐增加,PDI小幅增加;这是因为壳聚糖与脂质体通过静电相互作用结合,壳聚糖包裹在脂质体表面,从而增加了壳聚糖的粒径。脂质体的Zeta电位由负变正,显示壳聚糖与脂质体成功结合。随着壳聚糖浓度的增加,脂质体的Zeta电位在壳聚糖含量为0.60%时达到最大值,之后随着壳聚糖含量的增加略微减小,脂质体表面的结合位点达到饱和。因此选择壳聚糖含量为0.60%进行后续的实验。实际上,壳聚糖与脂质体的结合除存在静电相互作用之外,还存在疏水相互作用,疏水相互作用的存在促进了壳聚糖在脂质体膜上的物理吸附和沉积[24]。
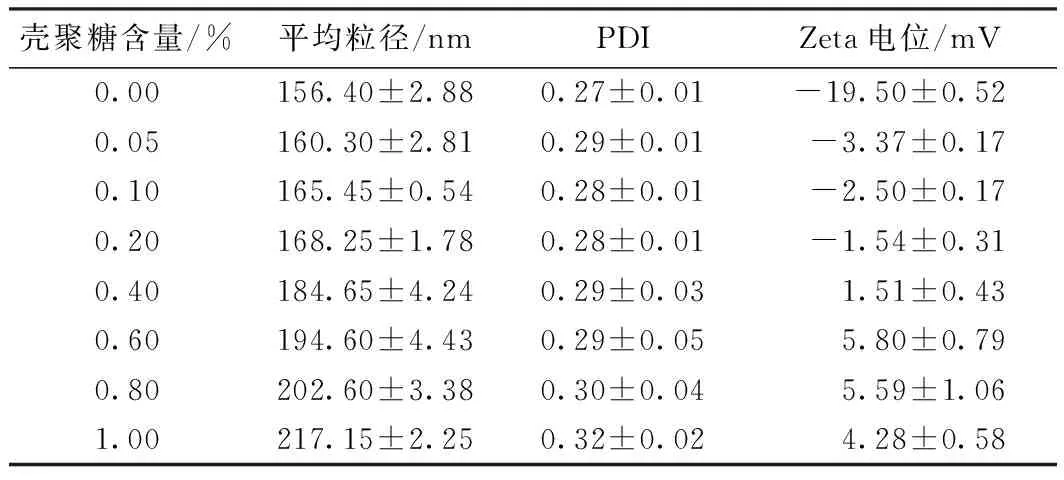
表2 壳聚糖浓度与平均粒径、PDI和Zeta电位的关系Table 2 Relationship among chitosan concentration and ave-rage size,PDI and Zeta potential
2.4 脂质体抗增殖活性评价
甜菜红素、甜菜红素纳米脂质体(NLP)和壳聚糖修饰的脂质体(CH-NLP)对HepG2细胞的毒性和抗增殖作用如图5所示。从图中可以看出,甜菜红素、NLP和CH-NLP对HepG2细胞都具有抗增殖作用,并且都具有一定的细胞毒性。甜菜红素、NLP和CH-NLP对HepG2细胞的EC50、CC50和SI值见表3。CH-NLP呈现最低的EC50值,为(69.46±1.75)μg/mL,对HepG2细胞的抑制效果最好。CH-NLP和NLP的SI值均大于2,说明CH-NLP和NLP对HepG2细胞的抑制作用是由其抗增殖活性而不是细胞毒性引起的[25]。甜菜红素对HepG2细胞展现出最弱的抑制作用。在甜菜红素质量浓度达2 000 μg/mL时,其细胞增值抑制率为40.65%,毒性仅为15.46%,这可能是因为甜菜红素易溶于水,具有较低的亲脂性,难以通过细胞膜被细胞吸收[26]。NLP和CH-NLP的抗增殖活性和细胞毒性相比于游离的甜菜红素都大幅提高,是因为脂质体载药体系可提高甜菜红素与细胞膜的亲和力,更有利于细胞对甜菜红素的吸收[8]。CH-NLP的抗增殖活性优于NLP,主要是因为壳聚糖涂层的存在提高了脂质体的细胞亲和力,由于壳聚糖修饰的脂质体带正电荷,增加了带负电荷的细胞膜对药物的吸收[27]。
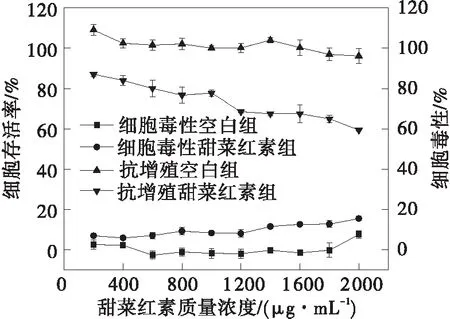
(a)甜菜红素
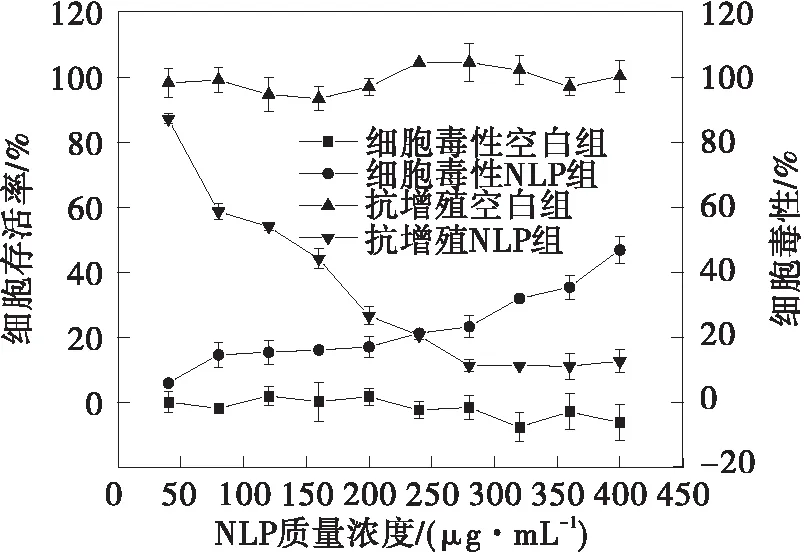
(b)NLP

(c)CH-NLP图5 甜菜红素、NLP和CH-NLP对HepG2细胞的细胞毒性和抗增殖活性Fig.5 Cytotoxicity and antiproliferative effects of betanin,NLP and CH-NLP against HepG2 cells

表3 甜菜红素、NLP和CH-NLP对HepG2细胞的EC50、CC50和SI值Table 3 EC50,CC50 and SI values of betanin,NLP and CH-NLP against HepG2 cells
3 结论
本研究在单因素试验结果的基础上,通过正交试验确定了制备甜菜红素纳米脂质体的最佳工艺条件,即卵磷脂质量浓度60 mg/mL,药脂比1:18,卵胆比6:1。最终得到的甜菜红素纳米脂质体包封率为(42.67±1.67)%,载药量为(2.63±0.42)%,平均粒径为(156.40±2.88) nm,PDI为(0.27±0.01),Zeta电位为(-19.50±0.52) mV。修饰脂质体的最佳壳聚糖含量为0.60%。得到的壳聚糖修饰的甜菜红素纳米脂质体平均粒径为(194.60±4.43) nm,PDI为(0.29±0.05),Zeta电位为(5.80±0.79) mV。CH-NLP和NLP对HepG2细胞都有明显的增殖抑制作用,其EC50值分别为(69.46±1.75)和(108.75±2.31) μg/mL;NLP的CC50大于400 μg/mL,CH-NLP的CC50大于240 μg/mL,两者SI值都大于2。甜菜红素对HepG2细胞的抑制能力最弱,可能是由于其低脂溶性难以被细胞吸收。脂质体载药体系极大地提高了甜菜红素的抗增殖活性,同时壳聚糖的修饰也提高了脂质体的细胞亲和力,使得带负电荷的细胞膜更容易吸收带正电荷的甜菜红素纳米脂质体。本研究的结果可为甜菜红素的开发利用提供新的方向。
