诱导冬眠期间野生达乌尔黄鼠肠道菌群结构和功能适应变化
2022-02-20杨潇瀛刘旭豪高福利张浩林韩莹莹袁峥嵘
杨潇瀛 刘旭豪 高福利 张浩林 韩莹莹 翁 强 袁峥嵘
(北京林业大学生物科学与技术学院,北京 100083)
肠道微生物是定植在肠道内数量庞杂的微生物群,在动物营养和健康中起着重要作用,对宿主的免疫、代谢、神经系统也具有一定的调节作用[1-2]。反过来,宿主为肠道微生物提供了一个营养丰富的环境,支持居住在多个生态位的不同微生物群落的发展[3]。肠道微生物已受到研究人员广泛关注。冬眠是动物进化出的一种应对冬季低温和食物短缺的生存特性,典型特征是长时间的昏睡(topor),在此期间体温仅略高于环境温度,基础代谢率降低到2%~4%[4]。冬眠前几周至几个月动物开始为冬眠做准备,在这一时期动物会过度进食,白色脂肪大量增加,体重可增加近1倍,在冬眠期间依靠储备的脂肪提供能量满足自身需求[5]。在冬眠哺乳动物中,食物短缺驱使肠道菌群依赖宿主来源的营养而不是外源底物。从组织学角度来看,冬眠会伴随着肠道形态的变化,包括质量、绒毛高度和肠细胞更新减少[6-7]。从微生物学的角度来看,冬眠会改变肠道微生物区系。Dill-Mcfarland等[8]对十三条纹地松鼠(Ictidomystridecemlineatus)盲肠微生物的研究表明冬眠期间厚壁菌门(Firmicutes)的相对丰度较低,而拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)的相对丰度较高。Stevenson等[9]研究表明,相对于夏季盲肠微生物组成,北极地松鼠(Urocitellusparryii)在冬眠期间厚壁菌门的相对丰度降低,拟杆菌门、疣微菌门和变形菌门(Proteobacteria)的相对丰度增加。Sommer等[10]对棕熊的研究表明,与活跃期相比,冬眠降低了厚壁菌门和放线菌门(Actinobacteria)的数量,增加了拟杆菌门的数量。同时,包括甘油三酯、胆固醇和胆汁酸在内的几种参与脂质代谢的代谢物也受到冬眠的影响。
野生达乌尔黄鼠(Spermophilusdauricus)是储脂类冬眠动物的典型代表,每年9—10月入蛰,次年3—4月出蛰,由反复的入眠—深冬眠—激醒的冬眠阵进行长达6个月的冬眠[11]。根据冬眠阵异温(体温<30 ℃)阶段的持续时间和最低体温可将其分为深冬眠阵(deep hibernation bouts,DHB)、短冬眠阵(short hibernation bouts,SHB)和日眠阵(daily torpor bouts,DTB)3类。其中,DTB多在冬眠初期发生,特点为在连续的浅而短的冬眠阵中体温逐渐降低,直到达到DHB,称之为体温的“试降(test drop,TD)”过程[12]。然而,在诱导冬眠期间野生达乌尔黄鼠肠道菌群结构如何变化尚未有报道。本研究对诱导冬眠组与对照组野生达乌尔黄鼠肠道菌群结构和功能进行研究,利用16S rRNA测序技术研究其在诱导冬眠过程中肠道菌群如何改变以帮助机体维持生理活动,并对肠道菌群功能进行预测,为今后进一步研究肠道菌群作用机制提供依据。
1 材料与方法
1.1 试验动物
2019年9月于河北省张家口坝上草原(北纬40.83°,东经114.88°)捕获野生达乌尔黄鼠8只,体重(363.4±36.9) g,饲喂标准鼠饲粮,自由采食及饮水。适应性喂养14 d后将野生达乌尔黄鼠随机分为2组,每组4只。对照组于自然温度[(22±4) ℃]下正常饲养,诱导冬眠组于(4±1) ℃恒温箱中饲养,无光照。以少量木屑置于黄鼠背部后,以木屑是否滑落为依据判定冬眠诱导是否成功。诱导10 d,使用红外测温仪及电子秤测定2组黄鼠体温和体重。采用二氧化碳吸入法处死动物,采集2组黄鼠盲肠内容物立即置入液氮,保存在-80 ℃冰箱备用。
1.2 试验方法
1.2.1 DNA提取及测序
根据TIANamp DNA试剂盒[天根生化科技(北京)有限公司]说明书提取每个肠道样本的总基因组DNA后,用260和280 nm处吸光度的比值(A260/280)和琼脂糖凝胶电泳评估DNA质量和完整性。采用两步PCR法,使用正向引物B341F(5’-CCTACGGGNGGCWGCAG-3’)和反向引物B785R(5’-ACTACHVGGGTATCTAATCC-3’)扩增细菌16S rRNA基因V3~V4区。所有扩增反应均在25 μL体积内进行,反应条件为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,这3个步骤重复25个循环,最终72 ℃延伸持续5 min。取2 μL PCR产物进行2%琼脂糖凝胶电泳,检测目的片段后,PCR产物经1×AMPure XP Beads纯化,进行第2轮PCR扩增。除变性—退火—延伸3个步骤进行8个循环外,其余步骤与第1轮PCR扩增相同。使用QIAick Gel Extraction Kit(Qiagen,V alencia,CA,美国)试剂盒从2%琼脂糖凝胶中对目的片段进行切胶回收。以KAPA Library Quantialization Kit(KAPA Biossystems,美国)作为文库混合标准进行定量。对扩增产物进行质量评估和定量后,在杭州开泰生物技术有限公司的Illumina MiSeq平台上进行双端高通量并行测序。
1.2.2 生物信息学分析
高通量测序结果为双端fastq文件格式,使用VSEARCH[13]v2.14.1将双端序列合并形成单个序列,并切除正反向引物,以错误率0.01进行质控。添加miniquesize为8去除低丰度噪音后,使用USEARCH v10.0.240中的unoise3[14]对序列进行去噪(denoise)以获得单碱基精度扩增子序列变体(amplicon sequence variants,ASVs),同时去除嵌合体,使用USEARCH[15]v10.0.240生成特征表。
比对RDP v1.6数据库,以0.60为阈值使用VSEARCH v2.14.1确定每个ASVs的分类信息,并去除质体和非细菌、古菌。经等量抽样标准化后,用vegan软件包[16]计算群落丰富度指数和多样性指数,以确定野生达乌尔黄鼠组内的α多样性。取1%~100%序列中ASVs的数量来计算稀释过程的丰富度变化。利用Bray_Curtis距离计算β多样性,并用主坐标分析(principal coordinate analysis,PCoA)进行可视化,找出组间微生物区系的结构差异。在分类学上从门水平到属水平对物种信息进行注释。所有上述数据均使用R v3.6.2生成可视化图像。使用线性判别分析(linear discriminant analysis effect size,LEfSe)来确定不同分类层级的物种差异[17]。
基于高质量序列,使用PICRUSt[18]对微生物功能进行预测,以得到KEGG通路中的基因相对丰度。使用STAMP[19]v2.1.1.0分析具有显著差异的功能通路(P<0.05)。
2 结果与分析
2.1 诱导冬眠组体重与体温变化
诱导冬眠组诱导10 d后,分别测量对照组与诱导冬眠组野生达乌尔黄鼠体重及体温。如图1所示,对照组黄鼠体重(373.7±37.4) g,诱导冬眠组黄鼠体重(297.3±28.9) g,诱导冬眠组与对照组黄鼠相比,体重降低20.4%,差异显著(P<0.05)。对照组黄鼠体温(31.5±2.2) ℃,诱导冬眠组黄鼠体温(22.3±4.5) ℃,相比对照组下降29.2%,差异显著(P<0.05)。上述结果说明机体在诱导冬眠期间调节自身体重及体温应对寒冷环境。
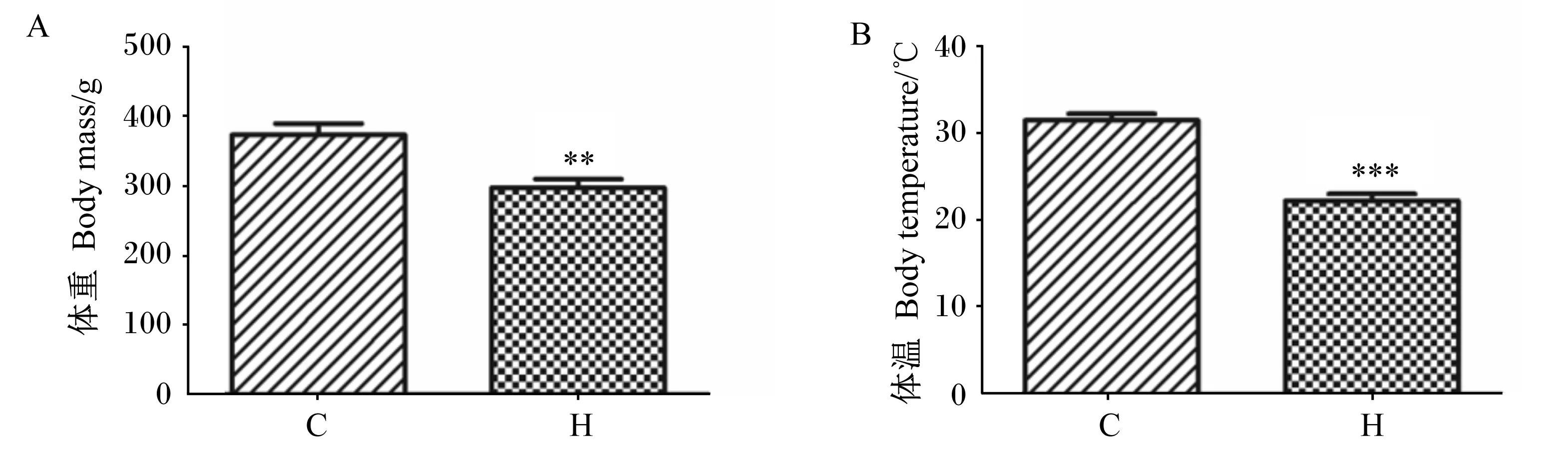
**:P<0.01;***:P<0.001。图1 对照组(C)与诱导冬眠组(H)野生达乌尔黄鼠体重及体温Fig.1 Body mass and body temperature of wild ground squirrel between control group (C) and induced hibernation group (H)
2.2 细菌群落丰富度和α多样性分析
稀释曲线可评估样本测序量并比较2组样本中物种丰富度。如图2-A所示,对照组和诱导冬眠组物种丰富度稀释曲线均趋于平坦,说明测序数据量处于合理范围,测序深度已经基本覆盖到样本中所有物种,更多的数据量对发现新的ASVs的贡献很小。Shannon指数同时考虑了物种丰富度以及均匀度,与物种多样性呈正相关,指数越大,样本中物种的多样性越大,反之越小。如图2-B所示,诱导冬眠组Shannon指数显著高于对照组(P<0.05),说明诱导冬眠可能使肠道菌群丰富度和均匀度提升。
2.3 β多样性分析
β多样性分析表示多组样本之间的差异,这种差异可以通过群落样品之间的距离来表现,2个群落组成成分越相似,它们之间距离就越小。本研究以Bray_Curtis指数进行衡量,对诱导冬眠组与对照组野生达乌尔黄鼠进行PCoA。如图3所示,诱导冬眠组与对照组样本各自可以很好的聚为一类,并且第1主坐标可以解释样本总差异的41.47%,第2主坐标可以解释样本总差异的20.42%,说明对照组与诱导冬眠组间细菌群落存在一定差异。
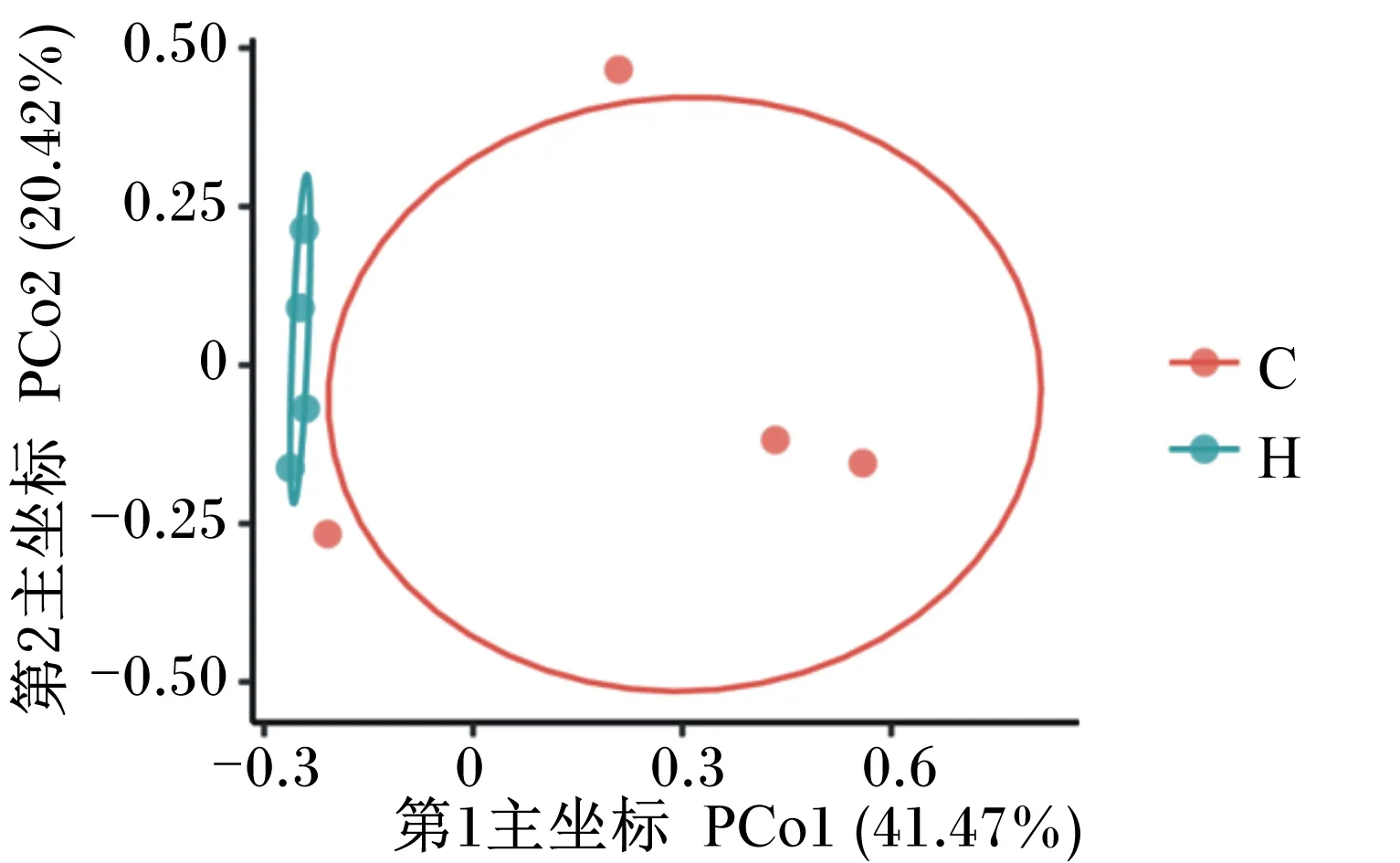
图3 对照组(C)与诱导冬眠组(H)野生达乌尔黄鼠肠道菌群PCoAFig.3 PCoA of gut microbiota of wild ground squirrel between control group (C) and induced hibernation group (H)
2.4 肠道菌群结构分析
2.4.1 门水平菌群结构
在门水平对相对丰度前9的菌群分析作图,得到菌群结构弦图(图4-A),从图中可以看出厚壁菌门和拟杆菌门在诱导冬眠组和对照组野生达乌尔黄鼠的肠道菌群中均占据统治地位,在所有样本中所占到的平均比例分别为56.1%和29.5%,其次是疣微菌门,所占比例为12.7%,变形菌门、放线菌门、软壁菌门(Tenericutes)的相对丰度均不足3%。
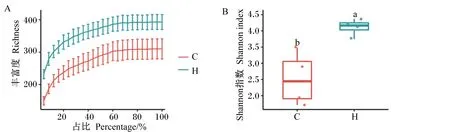
(A):丰富度稀释曲线;(B):Shannon指数。图B中不同小写字母不同表示差异显著(P<0.05)。(A): richness rarefaction curve; (B): Shannon index. In the figure B, different small letters mean significant difference (P<0.05).图2 对照组(C)与诱导冬眠组(H)野生达乌尔黄鼠肠道菌群α多样性Fig.2 α diversity of gut microbiota of wild ground squirrel between control group (C) and induced hibernation group (H)
2.4.2 属水平菌群结构
在属水平对相对丰度前10的菌群分析作图。如图4-B所示,有28.1%的序列未能归类,被列为未分类(Unassigned),其余相对丰度大于3%的菌属分别为乳杆菌属(Lactobacillus,21.7%)、阿克曼菌属(Akkermansia,11.6%)、拟杆菌属(Bacteroides,10.8%)、考拉杆菌属(Phascolarctobacterium,8.7%)、梭状芽胞杆菌ⅩⅣa属(Clostridium_ⅩⅣa,7.7%)和普雷沃菌属(Prevotella,6.9%)。
2.5 菌群结构差异分析
为在ASVs水平检测诱导冬眠组和对照组肠道菌群的差异,本研究使用曼哈顿图分析了门水平上ASVs的富集。如图5所示,在2组中,ASVs主要富集在拟杆菌门、厚壁菌门、变形菌门和疣微菌门;并且,从图中可以看出,相对于对照组,诱导冬眠组黄鼠肠道菌群中拟杆菌门的相对丰度升高,厚壁菌门和疣微菌门的相对丰度降低。
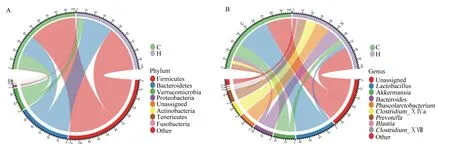
Phylum:门;Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Verrucomicrobia:疣微菌门;Proteobacteria:变形菌门;Unassigned:未分类;Actinobacteria:放线菌门;Tenericutes:软壁菌门;Fusobacteria:梭杆菌门;Other:其他;Genus:属;Lactobacillus:乳杆菌属;Akkermansia:阿克曼菌属;Bacteroides:拟杆菌属;Phascolarctobacterium:考拉杆菌属;Clostridium_ⅩⅣa:梭状芽胞杆菌ⅩⅣa属;Prevotella:普雷沃菌属;Blautia:布劳特氏菌属;Clostridium_ⅩⅧ:梭状芽胞杆菌ⅩⅧ属。下图同the same as below。图4 对照组(C)与诱导冬眠组(H)野生达乌尔黄鼠肠道菌群组成Fig.4 Composition of gut microbiota of wild ground squirrel between control group (C) and induced hibernation group (H)
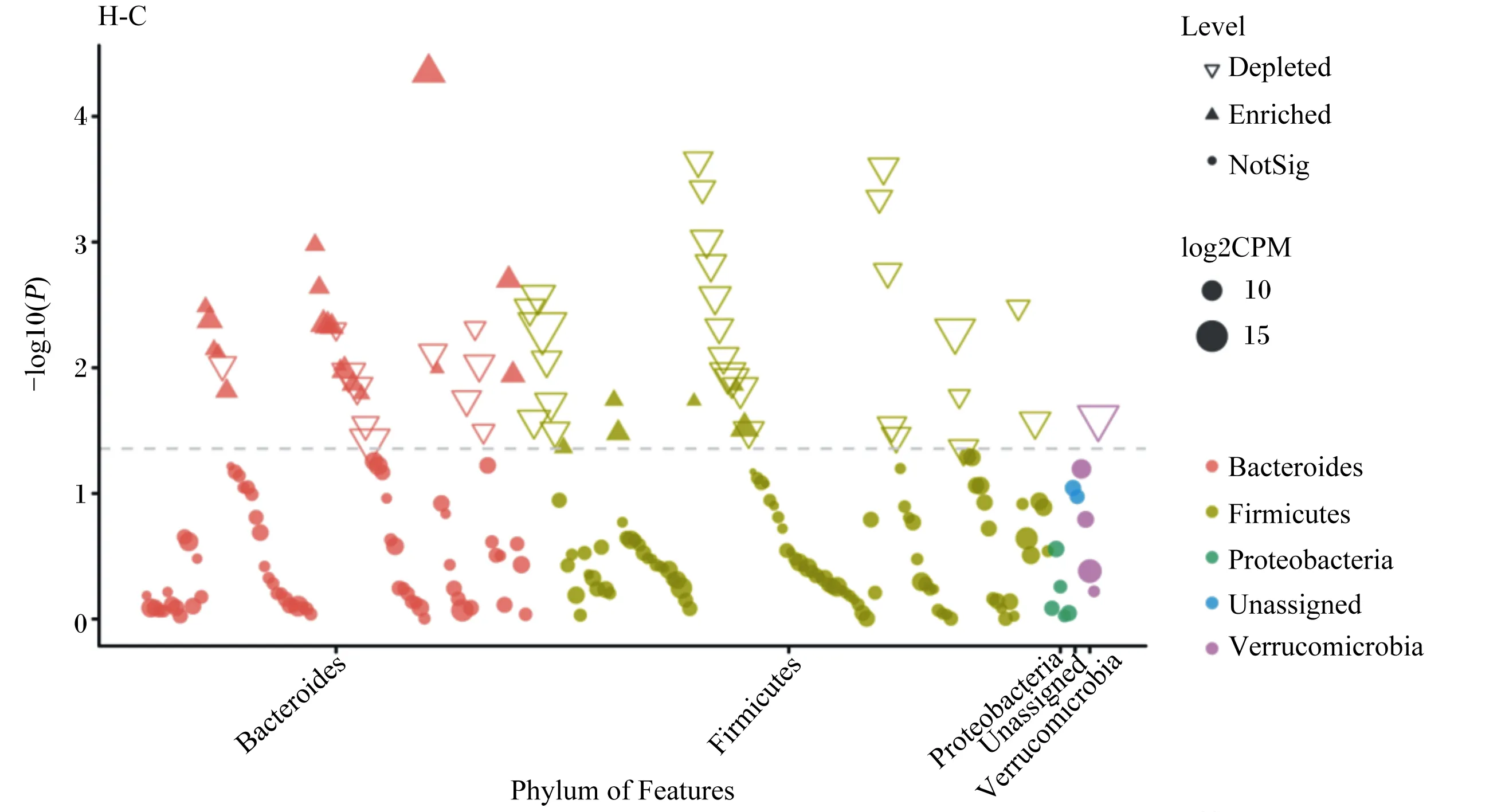
Level:水平;Depleted:降低;Enriched:增加;NotSig:不显著;CPM:counts per million每百万数;Phylum of Features:特征门。图5 诱导冬眠组(H)相比于对照组(C)门水平差异菌群曼哈顿图(FDR校正,P<0.05,秩和检验)Fig.5 Manhattan plot of different microbiota at phylum level compared induced hibernation group (H) with control group (C)(FDR adjusted, P<0.05, Wilcoxon rank sum test)
为进一步探究诱导冬眠期间野生达乌尔黄鼠差异性肠道菌群,本研究使用了LEfSe方法进行分析。由图6可知,在纲水平,梭菌纲(Clostridia)、厚壁菌纲(Negativicutes)的相对丰度在诱导冬眠期较高;在目水平,梭菌目(Clostridiales)、月形单孢菌目(Selenomonadales)的相对丰度在诱导冬眠期增加;此外,在科水平上氨基酸球菌科(Acidaminococcaceae)、毛螺菌科(Lachnospiraceae)和在属(Genus)水平上考拉杆菌属(Phascolarctobacterium)、梭状芽胞杆菌ⅩⅣa属(Clostridium_ⅩⅣa)、巴尼斯菌属(Barnesiella)、埃格特菌属(Eggerthella)、Lactonifactor、罗宾氏菌属(Robinsoniella)的相对丰度均在诱导冬眠期增加。

c:纲 class;o:目 order;f:科 family;g:属 genus;Clostridiales:梭菌目;Clostridia:梭菌纲;Phascolarctobacterium:考拉杆菌属;Selenomonadales:月形单孢菌目;Acidaminococcaceae:氨基酸球菌科;Negativicutes:厚壁菌纲;Lachnospiraceae:毛螺菌科;Clostridium_ⅩⅣa:梭状芽胞杆菌ⅩⅣa属;Barnesiella:巴尼斯菌属;Eggerthella:埃格特菌属;Robinsoniella:罗宾氏菌属;LDA SCORE:线性判别分析得分 linear discriminant analysis score。图6 LEfSe鉴定诱导冬眠组(H)野生达乌尔黄鼠代表性差异菌群(LDA>2,P<0.05)Fig.6 Representative differential microbiota of wild ground squirrel in induced hibernation group (H) identified by LEfSe (LDA>2, P<0.05).
2.6 PICRUSt菌群功能预测
为确定2组样本中菌群功能的差异性,利用PICRUSt软件对代表性序列KEGG第3层级通路进行预测。如图7所示,在诱导冬眠组存在显著差异的功能通路有11个(P<0.05),主要包括碳水化合物代谢通路(carbohydrate metabolism)、磷酸戊糖途径(pentose phosphate pathway)、细菌趋化性(bacterial chemotaxis)等,在对照组有5个显著差异的功能通路(P<0.05),主要包括脂类生物合成蛋白质通路(lipid biosynthesis proteins)、异戊烯基转移酶通路(prenyltransferases)等。
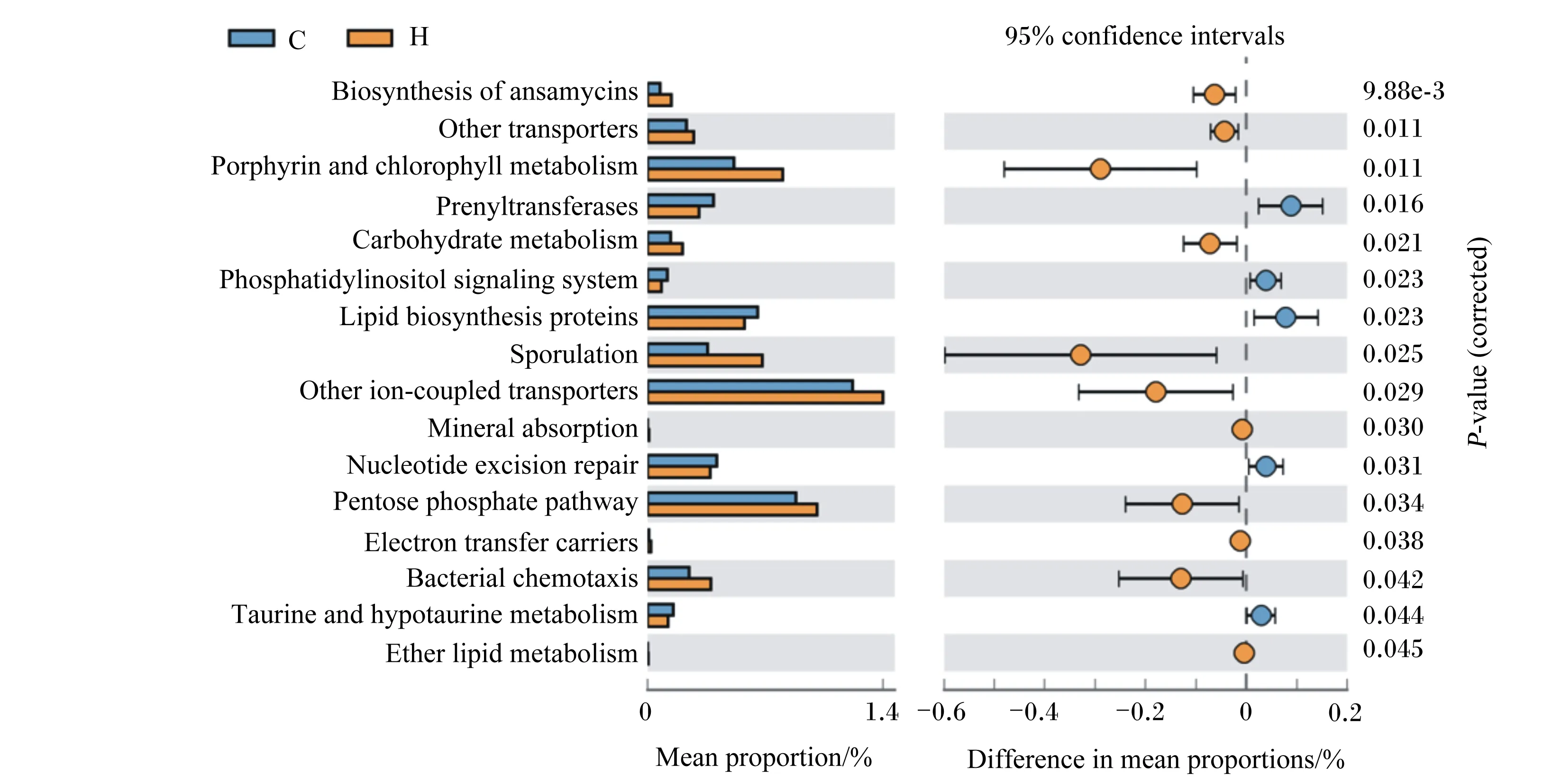
Biosynthesis of ansamycins:安莎霉素的生物合成;Other transporters:其他转运者;Porphyrin and chlorophyll metabolism:卟啉与叶绿素代谢;Prenyltransferases:异戊烯基转移酶通路;Carbohydrate metabolism:碳水化合物代谢通路;Phosphatidylinositol signaling system:磷脂酰肌醇信号系统;Lipid biosynthesis proteins:脂类生物合成蛋白通路;Sporulation:孢子形成;Other ion-coupled transporters:其他离子偶联转运蛋白;Mineral absorption:矿物质吸收;Nucleotide excision repair:核苷酸剪切修复;Pentose phosphate pathway:磷酸戊糖途径;Electron transfer carriers:电子转移载体;Bacterial chemotaxis:细菌趋化性;Taurine and hypotaurine metabolism:牛磺酸和亚牛磺酸代谢;Ether lipid metabolism:醚脂质代谢;confidence intervals:置信区间;Mean proportion:平均占比;Difference in mean proportions:平均占比差异;P-value (corrected):校正P值。图7 对照组(C)和诱导冬眠组(H)野生达乌尔黄鼠在KEGG第3层级通路中的功能预测差异分析Fig.7 Differential analysis of function prediction in the third level KEGG pathway of wild ground squirrel between control group (C) and induced hibernation group (H)
3 讨 论
肠道微生物寄生在宿主体内并与宿主相互作用,形成了平衡、复杂、多样的肠道微生物群系统。与宿主基因组不同,微生物组有很大可塑性,可以很容易地适应各种环境和宿主源性刺激。肠道微生物的结构和组成受遗传、免疫状态、肠道环境和饮食等几个宿主特征的影响,其中饮食为关键决定因素[20]。为应对冬季温度降低、食物短缺等问题,熊[10]、蝙蝠[21]、啮齿动物[8-9,22]、两栖动物[23-24]等形成了冬眠的生存特性。冬眠期间,动物停止进食,机体体温显著降低,代谢率减慢[25]。已有研究表明肠道微生物在冬眠期间会做出适应性改变,普遍情况下冬眠期间厚壁菌门的相对丰度降低,拟杆菌门和变形菌门的相对丰度升高[26]。
为了探究在诱导冬眠时期,肠道菌群如何改变得以辅助维持机体正常生命活动,本研究对野生达乌尔黄鼠进行诱导冬眠,并收集盲肠内容物进行16S rRNA高通量测序,通过α、β多样性分析、分类学组成分析、LEfSe差异分析、功能预测等研究了诱导冬眠期间野生达乌尔黄鼠肠道菌群结构及功能的变化。结果表明,诱导冬眠组黄鼠体重及体温均显著下降。体重减轻可能是由最大限度地吸收热量并增加肠道、绒毛和微绒毛长度的适应性机制引起的[27]。作为储脂类冬眠动物,野生达乌尔黄鼠冬眠前后的体重变化与冬眠密切相关,如北极地松鼠在进入冬眠前几周内体重增加,在冬眠期体重下降30%[28]。黄腹旱獭(Marmotaflaviventris)在冬眠前体重增加150%,冬眠后动物体脂肪从生成状态转变为分解状态,体重也随着降低[29]。体温下降同样为冬眠期间主要的特点之一,且体温的节律在冬眠期间被抑制或者减弱[30]。杨明等[12]研究表明,当达乌尔黄鼠体温降低到30 ℃以下可认定为开始入眠,环境温度处于-5~10 ℃时,达乌尔黄鼠为深冬眠状态,其体温保持在-2.4~11.0 ℃,随环境温度变化而变化;环境温度在3~10 ℃时个体处于日眠状态,体温保持在22~28 ℃。冬眠中的动物对体温调节能力的降低,有利于减少用于体温调节的代谢产热,从而减少能量消耗。
α多样性分析表明野生达乌尔黄鼠肠道菌群在冬眠期Shannom指数较对照组显著升高,说明冬眠期间微生物丰富度和均匀度显著增加。对十三条纹地松鼠Shannon指数的研究表明,肠道菌群物种多样性在不同季节没有显著差异[8];欧洲熊蜂(Bombusterrestris)在冬眠后Shannon指数升高[31];两栖动物东北林蛙(Ranadybowskii)[24]、斑腿泛树蛙(Polypedatesmegacephalus)[32]、马铁菊头蝠[21]肠道菌群Shannon指数在冬眠期降低。在冬眠期间肠道菌群α多样性表现出的结果差异可能是由于物种间差异及其食性差异引起的。基于Bray_Curtis距离矩阵的β多样性分析结果表明野生达乌尔黄鼠肠道菌群结构按诱导冬眠组与对照组聚集,2组样本群落结构存在差异。
菌群结构分析表明野生达乌尔黄鼠肠道菌群在门水平主要富集在厚壁菌门、拟杆菌门、疣微菌门和变形菌门,在属水平上主要富集于乳杆菌属,这一结果与其他啮齿类动物如十三线地松鼠[8]、北极地松鼠[9]、小林姬鼠(Apodemussylvaticus)[33]、北美红松鼠(tamiasciurushudsonicus)[34]肠道优势菌群一致。厚壁菌门和拟杆菌门在机体中占据主要地位,厚壁菌门是杆状或球形的革兰氏阳性菌,可通过包括淀粉体(amylosomes)和纤维小体(cellulosomes)的多酶复合物降解多糖[35]。拟杆菌门为革兰氏阴性菌,被认为是多糖的主要降解者,除此之外还可降解碳水化合物和蛋白质[36]。同时,厚壁菌门与拟杆菌门的比例与疾病状态的易感性也有关[37]。诱导冬眠组拟杆菌门的相对丰度增加可能是由于它们在缺乏膳食多糖的情况下,更多地降解宿主多糖。除此之外,在通过LEfSe对2组野生达乌尔黄鼠肠道菌群的差异分析发现在属水平考拉杆菌属、梭状芽胞杆菌ⅩⅣa属、巴尼斯菌属、埃格特菌属、Lactonifactor、罗宾氏菌属均在冬眠期相对丰度增加。研究表明考拉杆菌属(氨基酸球菌科)可利用拟杆菌属和普雷沃菌属降解动物体内不能被吸收消化的粗纤维产生的琥珀酸盐作为碳源,产生短链脂肪酸(short-chain fatty acids,SCFAs)为机体提供营养[38],说明诱导冬眠组肠道菌群中考拉杆菌属的相对丰度增加有利于冬眠期机体更好的维持生理状态。
本研究同时采用PICRUSt对诱导冬眠组与对照组野生达乌尔黄鼠肠道菌群进行了功能预测,基于KEGG第3层级的功能基因分析显示碳水化合物代谢通路、磷酸戊糖途径、细菌趋化性等11个功能通路在诱导冬眠组显著富集。研究表明,宿主黏蛋白产生及宿主饮食摄入的碳水化合物可以被肠道微生物发酵,产生以SCFAs(主要包括乙酸、丙酸、丁酸)为主的代谢产物,调节机体能量摄入[39]。在对照组显著富集的通路主要包括脂类生物合成蛋白质通路、异戊烯基转移酶通路等有5个功能通路。这进一步证明了肠道菌群具有参与机体能量代谢的能力,在冬眠期间调节机体生理功能保持稳定。
4 结 论
① 野生达乌尔黄鼠肠道菌群在冬眠期间发生改变,菌群多样性升高,拟杆菌门的相对丰度升高,厚壁菌门和疣微菌门的相对丰度降低。
② 野生达乌尔黄鼠肠道菌群在冬眠期间考拉杆菌属、梭状芽胞杆菌ⅩⅣa属、巴尼斯菌属、埃格特菌属、Lactonifactor、罗宾氏菌属的相对丰度升高。
③ 诱导冬眠组野生达乌尔黄鼠肠道菌群主要富集于碳水化合物代谢通路、磷酸戊糖途径、细菌趋化性等通路。
