竹叶黄酮对热应激诱导奶牛乳腺上皮细胞氧化损伤的保护作用
2022-02-20李建凤赵佳桢沈义媛关淑文韩思雨熊本海楚康康方洛云童津津蒋林树
李建凤 赵佳桢* 沈义媛 关淑文 韩思雨 熊本海 王 梦 楚康康 方洛云 童津津** 蒋林树**
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.首农集团,北京 100192)
奶牛由于采食后瘤胃发生厌氧发酵,运动和产奶等代谢产热增加,当代谢产热超过自身的散热能力时就会造成奶牛热应激。尤其在夏天,外界温度和湿度制约了奶牛自身体表的散热,会加剧奶牛热应激的发生。热应激会造成机体的氧化应激,体内过氧化物增加,膜系统损伤,免疫力降低[1];同时奶牛乳腺上皮细胞(bovine mammary epithelial cells,BMECs)中热休克蛋白的mRNA表达增强,影响BMECs活性和凋亡,进而影响奶牛乳腺的健康状况[2-4]。当奶牛消耗过多的能量来调节体温时产奶的能量就减少,极大降低了奶牛的生产效益。目前缓解热应激的措施主要有培育耐热品种、牛舍防暑降温、调整饲粮组成和使用抗热应激添加剂等[5]。有研究表明,植物提取物对奶牛抗热应激兼有药物和营养物质的作用,缓解热应激反应的同时,还有无残留和无污染的优点,是奶牛抗热应激的一个新途径[6]。吴德峰等[7]也发现,添加复合中草药添加剂有抗热应激作用,同时提高奶牛的产奶性能。目前研究者已从不同的植物中分离出多种类黄酮,并证明其具有显著的药理活性[8]。竹叶黄酮(bamboo leaf flavonoids,BLF)分子质量小,成本较低,具有提高奶牛生产性能和抗氧化能力的作用[9],所以可将其运用于缓解奶牛热应激。
BLF结构中的内邻位酚羟基极易被氧化,从而降低自由基的产生,加快自由基的清除,发挥抗氧化的效果[10]。核因子红细胞相关因子2(Nrf2)是自身抗氧化应激调节因子,Nrf2信号通路是目前最重要的抗氧化通路,通路激活剂和抗氧化剂的开发对于缓解氧化应激损伤、提高生产性能具有重要的意义[11]。此外,据报道Nrf2是活性氧(ROS)在细胞中的主要传感器,过量的ROS会导致Nrf2的连续激活并在细胞核中积累,启动下游参与抗氧化基因的转录。Li等[12]研究发现,Nrf2信号通路是机体抵抗内环境氧化和化学刺激的一条重要的防御性转导通路。BLF能够干预上调Nrf2基因的表达,以启动抗氧化防御系统抵抗氧化应激反应,从而减轻HepG2细胞的损伤。然而,BLF是否对热应激引起BMECs的损伤具有保护作用尚未明确。因此,本研究将通过对热应激BMECs添加BLF,探究其对BMECs的影响及其作用机制,以期为BLF在生产实践中的应用提供理论依据。
1 材料与方法
1.1 试验材料
BMECs由东北农业大学动物生物化学与分子生物学实验室惠赠;竹叶选购自陕西某天然制品有限公司,BLF参照张英[13]的方法由本实验室采用热回流法自行提取,提取效率1%~3%,总黄酮含量为20%~26%;DMEM/F12培养基(11995065,11765054)、澳洲胎牛血清(FBS,10099141)、青霉素/链霉素溶液(Pen Strep,15140-122)、Hank’s 平衡盐溶液(HBSS,14175095)、0.25%胰蛋白酶-二氨基乙烷四乙酸(EDTA)(25200056)购自美国Gibco公司;磷酸盐缓冲液(phosphate buffered saline,PBS)购自北京沃比森科技有限公司;ROS检测试剂盒(S0033S)购自上海碧云天生物技术有限公司;乳酸脱氢酶(LDH)活性定量测定试剂盒(E1020)购自北京普利莱基因技术有限公司;Annexin V-FITC/PI凋亡检测试剂盒(ZP327-1)购自北京友谊中联生物科技有限公司;总超氧化物歧化酶(total superoxide dismutase,T-SOD)试剂盒(A001-1-2)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(A005-1-2)、丙二醛(MDA)试剂盒(A003-1-2)购自南京建成生物工程研究所;线粒体膜电位(mitochondrial membrane potential,MMP)试剂盒(M34652)购自Thermo公司;总RNA提取试剂盒[Pure Link RNA小量试剂盒(12183018A)]购自赛默飞公司;cDNA反转录试剂盒和SYBR GreenTMPremix Ex Taq Ⅱ购自日本TaKaRa公司。热休克蛋白70(HSP70)抗体(sc-32239)购美国Santa Cruze公司,4′,6-二脒基-2-苯基吲哚(DAPI)-抗荧光淬灭封片液购自上海碧云天生物技术有限公司。
1.2 试验设计
将BMECs置于37 ℃、5% CO2细胞培养箱中培养,待细胞密度达到80%,进行细胞传代,传至3~5代,然后更换含有不同浓度的(0、1、5和10 μg/mL)BLF的DMEM/F-12(含有10% FBS)培养液于37 ℃培养12 h后,于42 ℃细胞培养箱中继续培养1 h后,恢复12 h,收集样本检测。将不添加BLF、37 ℃处理的BMECs设为对照组,不添加BLF、42 ℃处理的BMECs设为热应激组,以添加不同浓度的BLF(1、5、10 μg/mL)、42 ℃处理的BMECs设为试验组,每组3个重复。
1.3 试验方法
1.3.1 LDH法检测BLF对热应激诱导BMECs氧化损伤的保护作用
96孔板中以每孔200 μL接种BMECs的悬浮液,当细胞密度达到80%时,吸出完全培养液,用不含双抗的D’Hanks缓冲液洗2遍,按分组分别加入150 μL含有不同浓度(0、1、5和10 μg/mL)的BLF细胞培养液,在37 ℃、5% CO2条件下培养12 h后,42 ℃热应激1 h,恢复12 h。加入15 μL LDH检测液,孵育2 h,在450 nm处测定吸光度值。
1.3.2 AnnexinV-FITC法检测BLF对热应激诱导BMECs凋亡的影响
按照1.3.1的步骤将BMECs进行培养和处理后,按照Annexin V-FITC凋亡检测试剂盒说明书,200 μL含有5 μL Annexin V-FITC的结合缓冲液在室温和黑暗条件下染色20 min,在4 ℃的黑暗中再染色15 min,然后加入10 μL PI,用流式细胞仪进行检测。
1.3.3 BLF对热应激诱导BMECs氧化损伤后ROS含量的影响
按照1.3.1的步骤将BMECs进行培养和处理后,加入二氯二氢荧光素-乙酰乙酸酯(DCFH-DA),在37 ℃孵育30 min后,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。然后用流式细胞仪检测20 000个细胞的2′,7′-二氯荧光素(DCF)荧光分布,激发波长为488 nm,发射波长为525 nm。
1.3.4 BLF对热应激诱导BMECs氧化损伤后MMP水平的影响
按照1.3.1的步骤将BMECs进行处理和培养后,按照JC-1 MMP水平分析试剂盒进行操作。加入JC-1染料工作液,37 ℃孵育30 min,之后在37 ℃下用10 μmol/L的细胞凋亡诱导剂(CCCP)处理细胞30 min,再用JC-1染料工作液于37 ℃孵育30 min后,用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的JC-1染料,使用流式细胞仪在530 nm处测量MMP水平。
1.3.5 BLF对热应激诱导BMECs氧化损伤后抗氧化酶活性的影响
按照1.3.1的步骤将BMECs进行培养、处理后,按照T-SOD、GSH-Px和MDA试剂盒说明,使用酶标仪分别在532、550和412 nm的吸收波长下测定MDA、T-SOD和GSH-Px的吸光度,并计算MDA含量及T-SOD和GSH-Px活性。
1.3.6 BLF对热应激诱导BMECs氧化损伤中HSP70蛋白表达的影响
按照1.3.1的步骤将BMECs进行细胞爬片培养处理后,吸取上清液,PBS冲洗3次,4%多聚甲醛固定20 min,晾干后贴于载玻片上,用PBS冲洗,加入2%牛血清白蛋白(BSA)封闭抗原30 min;滴加用PBS稀释(1∶100)的一抗,4 ℃孵育过夜;次日用PBS冲洗3次,滴加用PBS稀释(1∶1 000)的FITC标记的羊抗兔/鼠二抗,37 ℃避光孵育60 min;PBS冲洗3次,滴加DAPI-抗荧光淬灭封片液,通过Leica TCS SP8X激光共聚焦显微镜观察。
1.3.7 BLF对热应激BMECs内凋亡相关基因及Nrf2通路相关基因mRNA相对表达量的影响
按照1.3.1的步骤将BMECs进行培养、处理和分组。每孔加入总RNA提取试剂Trizol 500 μL,吹打均匀,转移到EP管中;加0.1 mL的氯仿,混匀,4 ℃静置2 min,12 000 r/min离心15 min;取上层无色水相加入到另一EP管中,加入等体积异丙醇,混匀,室温静置10 min;4 ℃,离心弃上清,75%的乙醇洗涤2次;离心5 min去上清,室温干燥3~5 min;加50 μL DEPC水溶解,获得总RNA,-80 ℃下保存。取出适量RNA,用Nanodrop分光光度计检测吸光度(OD)值,分析RNA的纯度与浓度,OD260/OD280的值在1.8~2.0可用于后续试验分析。依据TAKARA BIO NIC cDNA试剂盒将RNA反转录成cDNA。所用的基因引物序列见表1。看家基因为磷酸甘油醛脱氢酶(GAPDH),采用-2△△Ct计算目的基因的mRNA相对表达量。

表1 基因的引物序列Table 1 Primer sequences of genes

续表1基因GenesGenBank登录号GenBank accession No.引物序列Primer sequences (5′—3′)热休克蛋白70HSP70NM_203322.2F:CGTGCTCATCTTTGATCTGGR:TGGCTGATGTCCTTCTTGTG热休克蛋白90HSP90 NM_001079637.1F: CCAAGTCTGGCACTAAAGR: GAAGACTCCCAAGCATAC兔抗人单克隆抗体BaxNM_173894.1F: TGGACATTGGACTTCCTTCGR:CCAGCCACAAAGATGGTCACB淋巴细胞瘤/白血病-2Bcl-2NM_001166486.1F:GGATGACCGAGTACCTGAACCR:GCCCAGATAGGCACCCAG半胱氨酸天冬氨酸蛋白酶-3Caspase-3BC123503F:AAGCCATGGTGAAGAAGGAAR:GGCAGGCCTGAATAATGAAA环氧合酶-2COX-2NM_174445F:TCCACCAACTTATAATGTGCACR:GGCAGTCATCAGGCACAGGA核因子红细胞相关因子2Nrf2NM_001011678.2F:AGGACATGGATTTGATTGACR:TACCTGGGAGTAGTTGGCA 血红素加氧酶-1HO-1NM_001014912.1F:GGCAGCAAGGTGCAAGAR:GAAGGAAGCCAGCCAAGAG硫氧化还原蛋白还原酶1Txnrd1NM_174625.3F:GTGTTCACGACTCTGTCGGTR:CTGCCTTCCACGAATCACCT NADPH-醌氧化还原酶1NQO1NM_001034535.1F:GGTGCTCATAGGGGAGTTCG R:GGGAGTGTGCCCAATGCTAT 半胱氨酸摄取转运蛋白xCTXM_002694373.2F:GATACAAACGCCCAGATATGC R:TGATGAAGCCAATCCCTGTA
1.4 数据统计与分析
试验数据用Excel 2010进行初步整理分析,然后用SPSS 21.0进行单因素方差分析(one-way ANOVA)及多重比较。试验结果用平均值和均值标准误表示,其中P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 LDH法检测BLF对热应激诱导BMECs氧化损伤的保护作用
LDH是存在于细胞质的重要酶类,当细胞膜受到损伤后会被释放胞外。本试验通过检测LDH释放率来反映BLF对热应激诱导BMECs氧化损伤的保护作用。本研究结果表明,与对照组相比,高温作用于BMECs发生热应激损伤后,LDH释放率显著增强(P<0.05)(图1)。当发生热应激损伤的BMECs组中,添加1、5、10 μg/mL BLF后,与热应激组相比,LDH释放率显著降低(P<0.05),其中5 μg/mL BLF组的LDH的释放率最低,由此表明BLF抑制了LDH释放,对热应激诱导的细胞损伤具有保护作用。

数据柱标注不同字母表示差异显著(P<0.05)。下图同。Value bars with different letters mean significant difference (P<0.05). The same as below.图1 BLF对热应激诱导BMECs氧化 损伤后释放LDH的影响Fig.1 Effects of BLF on LDH release of BMECs induced by heat stress after oxidative damage
2.2 BLF对热应激诱导BMECs凋亡的影响
Annexin V和PI双重染色将细胞分为3类:活细胞(Annexin V 和 PI 阴性)、早期凋亡细胞(Annexin V 阳性,PI 阴性)和晚期凋亡/坏死细胞(Annexin V 和 PI 阳性)(图2-A)。热应激损伤后,BMECs的早期凋亡率、晚期凋亡率和总凋亡率极显著升高(P<0.01)。与对照组相比,在42 ℃条件下细胞凋亡率极显著提高(P<0.01);添加5、10 μg/mL BLF与BMECs共培养,当热应激发生时,可极显著降低细胞早期凋亡率和晩期凋亡/坏死率(P<0.01)(图2-B)。在热应激条件下,添加1、5和10 μg/mL的BLF,与对照组相比,细胞总凋亡率无显著差异(P>0.05),表明BLF可以减少热应激造成的BMECs的凋亡。
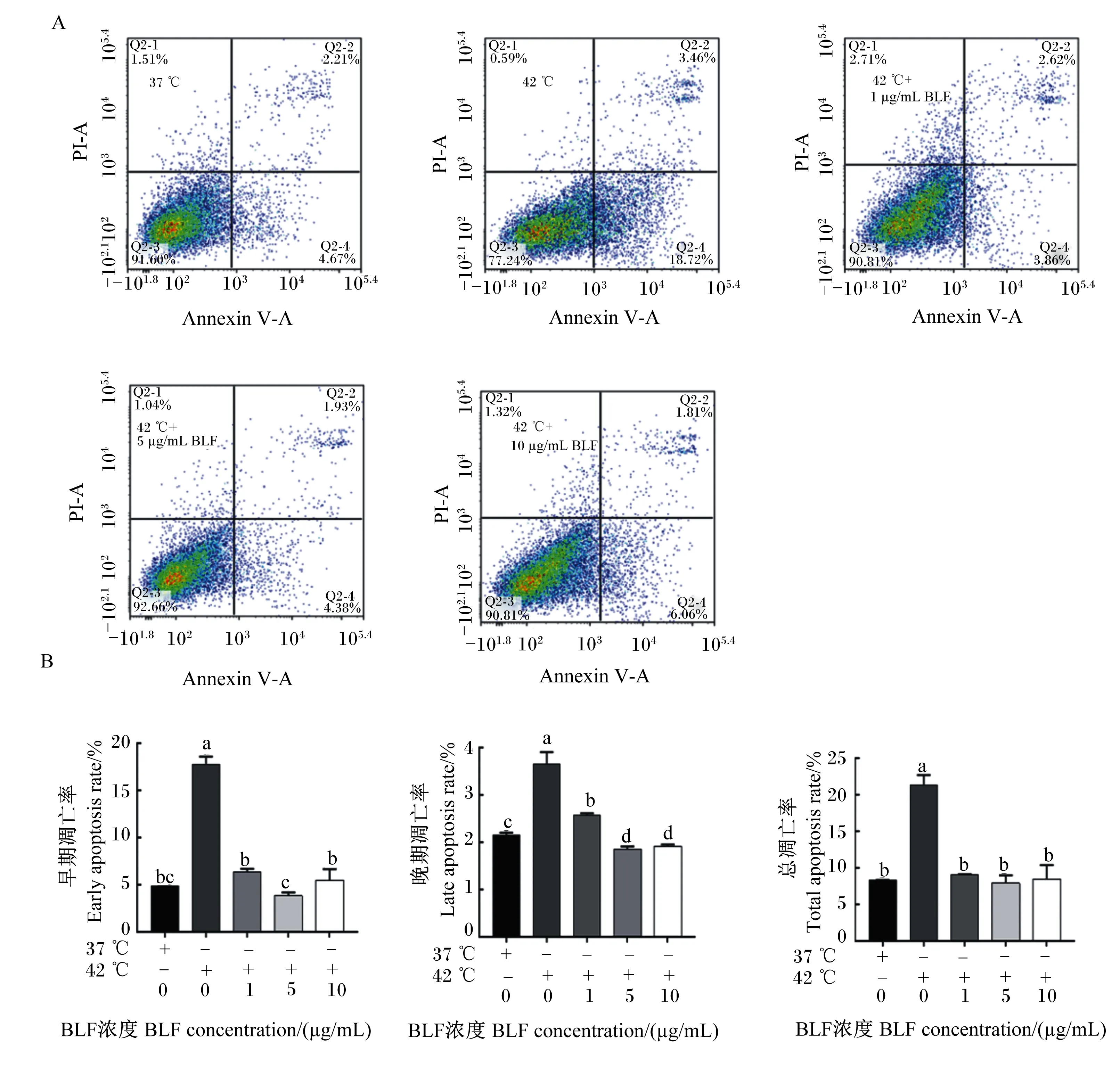
A图为流式细胞仪检测Annexin V/PI双染结果;B图为BLF对热应激诱导BMECs凋亡的影响。Figure A showed the results of Annexin V/PI double staining by flow cytometry; Figure B showed the effects of BLF on apoptosis by heat stress induced injury of BMECs.图2 BLF对热应激诱导BMECs凋亡的影响Fig.2 Effects of BLF on apoptosis of BMECs induced by heat stress
2.3 BLF对热应激诱导BMECs氧化损伤后ROS含量的影响
由图3可知,与对照组相比,热应激组中ROS含量极显著增加(P<0.01),但添加1、5和10 μg/mL浓度BLF可极显著减少细胞内ROS的产生(P<0.01);值得注意的是5和10 μg/mL的BLF组间,细胞内的ROS含量无显著差异(P>0.05)。由此可见,BLF可减少热应激情况下BMECs内产生ROS,抑制热应激诱导细胞产生的氧化损伤。
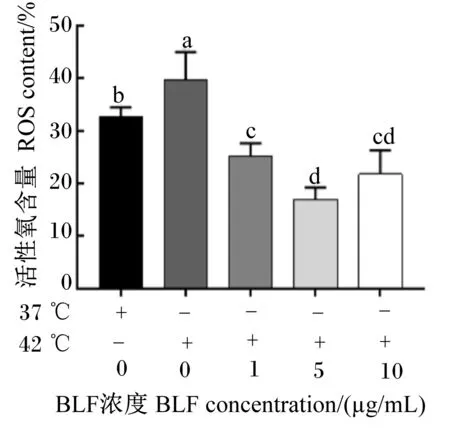
图3 BLF对热应激诱导BMECs氧化损伤后ROS含量的影响Fig.3 Effects of BLF on ROS content of BMECs induced by heat stress after oxidative damage
2.4 BLF对热应激诱导BMECs氧化损伤后MMP水平的影响
如图4所示,与对照组相比,热应激组的BMECs内MMP水平显著增加(P<0.05)。但在热应激条件下,添加1、5、10 μg/mL的BLF与BMECs共培养,可显著降低MMP水平(P<0.05),其中添加5 μg/mL的BLF保护作用最好。
2.5 BLF对热应激诱导BMECs氧化损伤后抗氧化酶活性的影响
由图5可知,与对照组相比,热应激组中的T-SOD和GSH-Px的活性显著降低(P<0.05), MDA的含量显著升高(P<0.05);与热应激组相比,添加BLF后,T-SOD和GSH-Px的活性显著升高(P<0.05),MDA的含量显著降低(P<0.05)。由此可见,BLF对热应激诱导BMECs氧化损伤具有保护作用,而且5 μg/mL的BLF组与其他组相比,效果更好。

图5 BLF对热应激诱导的BMECs的抗氧化酶活性的影响Fig.5 Effects of BLF on antioxidant enzyme activity of BMECs induced by heat stress
2.6 BLF对热应激诱导BMECs氧化损伤中HSP70蛋白表达的影响
应用激光共聚焦显微镜观察HSP70蛋白表达的变化(图6),与对照组相比,FITC(绿色荧光)标记的HSP70在热应激组中荧光强度较强,而添加BLF处理后,HSP70的荧光强度介于对照组与热应激组之间。结果表明,BLF处理可以保护由热应激引起的细胞损伤。
2.7 BLF对热应激诱导BMECs氧化损伤后凋亡相关基因及Nrf2信号通路中相关基因mRNA相对表达量的影响
由表2可知,与对照组相比,热应激组中的热休克转录因子1(HSF1)、HSP70和热休克蛋白90(HSP90)的mRNA相对表达量极显著增加(P<0.01)。与热应激组相比,添加1、5和10 μg/mL的BLF后,HSF1、HSP70和HSP90的mRNA相对表达量极显著降低(P<0.01),表明BLF可以抑制BMECs内热休克蛋白相关基因的表达从而减轻机体的热应激反应。此外,与对照组相比,热应激组中兔抗人单克隆抗体(Bax)、Bax/B淋巴细胞瘤/白血病-2(Bax/Bcl-2)、环氧合酶-2(COX-2)和半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)的mRNA相对表达量显著增加(P<0.05),而Bcl-2的mRNA相对表达量显著降低(P<0.05)。与热应激组相比,添加BLF后,Bax、Bax/Bcl-2、COX-2和Caspase-3的mRNA相对表达量显著降低(P<0.05),而Bcl-2的mRNA相对表达量显著升高(P<0.05),由此可见,BLF对凋亡相关基因的表达具有一定的抑制作用。此外,我们又检测了BLF对Nrf2信号通路中相关调节基因mRNA相对表达量的影响。与对照组相比,热应激组中的Nrf2、血红素加氧酶-1(HO-1)、半胱氨酸摄取转运蛋白(xCT)、硫氧化还原蛋白还原酶1(Txnrd1)和NADPH-醌氧化还原酶1(NQO1)的mRNA相对表达量极显著降低(P<0.01)。与热应激组相比,添加1、5和10 μg/mL的BLF均能极显著上调Nrf2、HO-1、xCT、Txnrd1和NQO1的mRNA相对表达量(P<0.01),而且极显著高于对照组(P<0.01)。由此可见,BLF通过调节凋亡相关因子和Nrf2信号通路中相关基因的表达,从而对热应激诱导的BMECs氧化损伤具有保护作用。
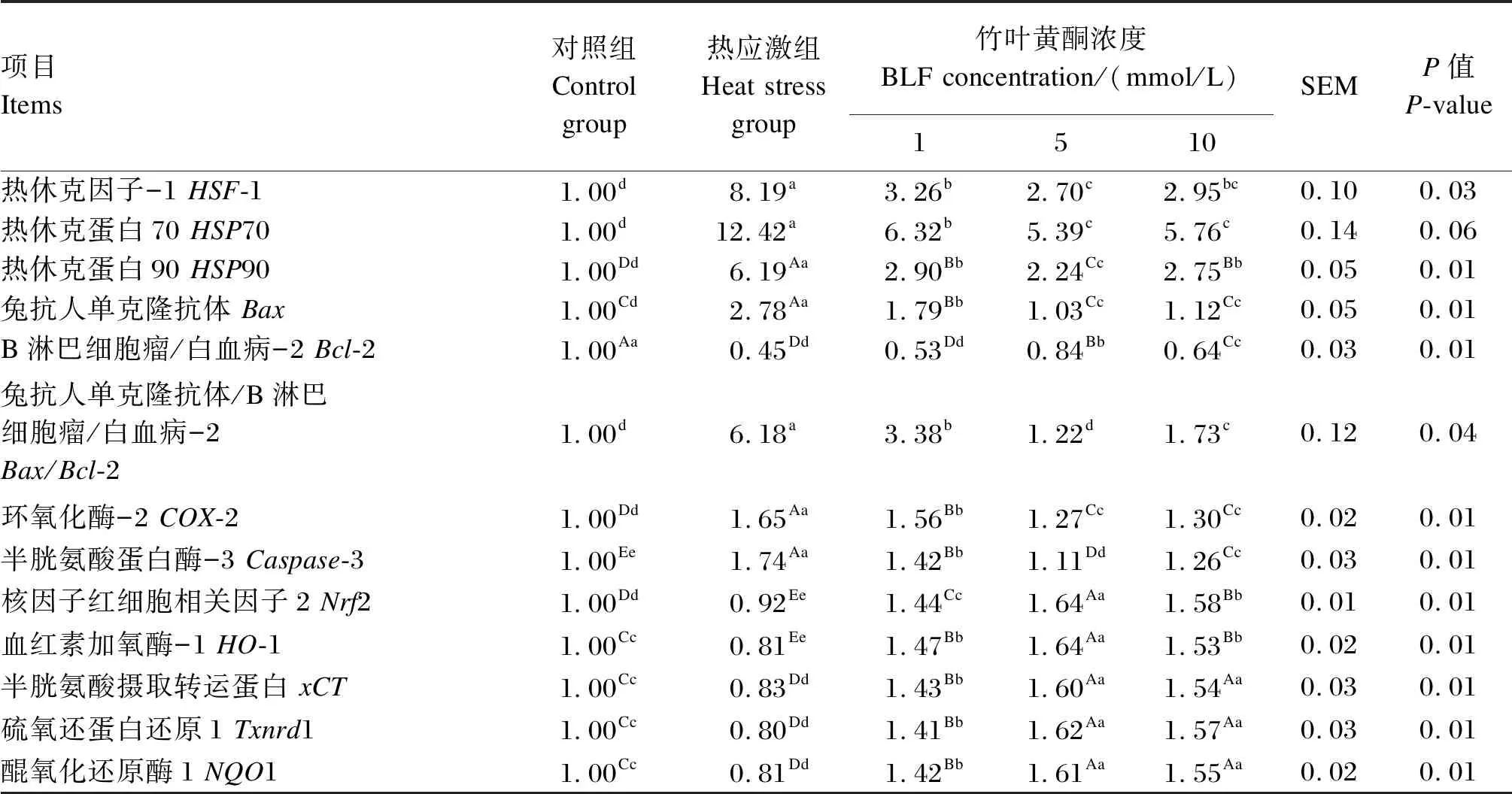
表2 BLF对热应激诱导BMECs氧化损伤后相关基因mRNA相对表达量的影响Table 2 Effects of BLF on mRNA relative expression level of related genes of BMECs induced by heat stress after oxidative damage
3 讨 论
热应激会诱导细胞发生多种变化,包括细胞和膜结构在形态和功能上的改变及蛋白质合成、DNA和RNA的聚合、转录和翻译受到抑制等,导致细胞功能发生异常,最终影响生物性能[14]。而且,热应激还会打破机体的氧化平衡状态引起氧化应激反应,产生过多自由基,引起机体抗氧化机能紊乱[15]。近年来,黄酮类物质因具有较强的抗氧化活性,且与其质量浓度呈现良好的依赖关系,可以对BMECs产生抗氧化的保护作用[16-17]而受到了广泛关注。据报道,BLF具有多种生理功能,除抗氧化作用以外,还兼具抗菌、抑菌的功效和一定的营养保健作用,尤其在奶牛生产中,BLF可以通过改善BMECs的活性提高奶牛产奶量、乳脂率及乳蛋白含量[14,18]。本研究结果发现,和热应激组相比,添加1、5、10 μg/mL的BLF对热应激诱导的BMECs中T-SOD和GSH-Px活性均有提高,而MDA的含量有所下降,这与冯磊等[19]研究结果相一致,表明BLF具有明显降低脂质过氧化、升高SOD和GSH-Px活性的作用。因此,本研究结果为BLF改善热应激损伤作用提供了理论依据。

A图为流式细胞仪检测MMP的结果(FITC-A,绿色荧光;PE-A,红色荧光);B图为BLF对热应激诱导BMECs氧化损伤后MMP水平的影响。Figure A showed the results of MMP by flow cytometry (FITC-A, green fluorescence; PE-A, red fluorescence); Figure B showed the effects of BLF on MMP level of BMECs induced by heat stress after oxidative damage.图4 BLF对热应激诱导BMECs氧化损伤后MMP水平的影响Fig.4 Effects of BLF on MMP level of BMECs induced by heat stress after oxidative damage
热应激是重要的诱导细胞凋亡的应激因素之一,细胞在受到热应激时更容易发生凋亡[20-22]。Zou等[23]报道热应激处理BMECs 1 h后,细胞存活率降低,细胞凋亡及坏死率显著增加。这与本试验结果相一致,热应激损伤后的BMECs凋亡率显著升高;但当添加1、5、10 μg/mL BLF后,细胞早期调亡率和总凋亡率均下降;值得注意的是,添加5 μg/mL BLF时,热应激损伤的BMECs的早期凋亡率与正常组无显著差异。由此可见,BLF对热应激表现了抗性,提高了相对细胞存活率对BMECs的保护作用。此外,有研究表明处于热应激状态下的动物,机体内MDA和ROS的含量显著上升,而SOD和GSH-Px的活性显著下降[24-26]。本团队前期研究结果表明,在奶牛生产中饲喂BLF提取物后,可显著提高奶牛血清中SOD活性,降低ROS和MDA的含量[27]。在本试验中时,添加BLF可显著降低热应激损伤发生时SOD活性和MDA的含量,表明BLF对BMECs热应激损伤发生时具有保护作用,而且5 μg/mL的BLF效果最好。据报道,MMP水平不仅在细胞凋亡过程中显著降低[28-32],而且过量的ROS的产生会破坏呼吸链,增加质子的线粒体通透性,从而导致MMP水平的下降[29,31]。本研究结果发现,添加BLF显著降低热应激后BMECs的ROS含量和MMP水平,其中5 μg/mL的BLF效果最好,进一步证明了BLF对热应激诱导的氧化损伤具有保护作用。

DAPI:4′,6-二脒基-2-苯基吲哚 4′,6-diamidino-2-phenylindole;FITC:异硫氰酸荧光素 fluorescein isothiocyanate;Merged:合并。图6 BLF对热应激诱导的BMECs中HSP70蛋白表达的影响Fig.6 Effects of BLF on HSP70 protein expression of BMECs induced by heat stress
此外,大量研究结果表明,细胞凋亡的信号调控与Bcl-2家族、Caspase家族和线粒体密切相关[33-35]。线粒体内有许多凋亡信号聚集用于控制细胞凋亡,特别是Bcl-2家族蛋白中的Bax在线粒体凋亡调控中又起着关键作用。而且,据报道,Bax/Bcl-2的比值升高会诱导Caspase-3的裂解和表达量增多,从而引起细胞发生凋亡[36]。在本研究中,热应激损伤使BMECs凋亡相关基因Bax、Bax/Bcl-2、COX-2和Caspase-3的mRNA相对表达量均升高,而Bcl-2的mRNA相对表达量降低;但是,对热应激的BMECs中添加BLF后,细胞内BaxmRNA相对表达量和Bax/Bcl-2的比值都有所降低,且5 μg/mL的BLF效果最好。由此我们推测,这些变化可能都是通过抑制Caspase信号通路的激活从而降低细胞凋亡率,但具体的调控机制有待进一步的研究。据报道,HSP表达的增加可以保护细胞免受各种损伤,尤其是在耐热性方面[32],其中HSP70是家族中高度诱导的HSP[37],HSP90是抵抗热应激的主要防御蛋白[38-39]。本研究结果中发现,当添加BLF后,在热应激条件下BMECs中的HSF1、HSP70和HSP90的mRNA相对表达量降低,表明BLF预处理既可以通过诱导HSF1、HSP70和HS90基因的表达来增加细胞的耐热性,又可显著降低热应激BMECs的凋亡率、ROS含量及MMP水平,证明BLF可抑制细胞凋亡,对处于热应激状态下的BMECs具有保护作用。
Nrf2是体内一种重要的转录调节因子,调节抗氧化相关基因的表达[40]。据报道,Nrf2/HO-1级联反应对病理生理过程中的氧化应激反应具有显著的抑制效果,当Nrf2/HO-1表达上调时,ROS和促炎因子含量等显著减少[41]。值得注意的是,竹叶中的主要生物活性成分是以异荭草苷、荭草苷、异牡荆苷和牡荆苷为代表的C-糖苷黄酮类化合物[42-44],具有清除自由基、抗氧化、抗衰老、增强免疫力和预防退行性疾病等生物学功效[45]。而且有研究显示,牡荆苷和荭草苷均能够减轻脂多糖(LPS)诱导的小鼠急性肺损伤(ALI),表明牡荆苷和荭草苷通过抑制炎症和氧化应激在抗ALI中发挥重要作用,这可能与上调Nrf2信号通路基因表达密切相关[46-47]。Yu等[48]的研究表明,BLF能够上调Nrf2、HO-1、醌氧化还原酶1(NQO1)基因的表达,从而启动抗氧化防御反应,以对抗氧化应激。与本研究结果相一致,随着热应激发生导致ROS的聚集引起Nrf2的积累并促进其核转位,BLF启动了参与抗氧化应激关键事件的基因的转录,通过激活Nrf2/HO-1信号通路抑制ROS生成,从而抑制热应激诱导的BMECs氧化应激损伤,使机体内最终达到氧化和抗氧化反应的平衡(图7)。
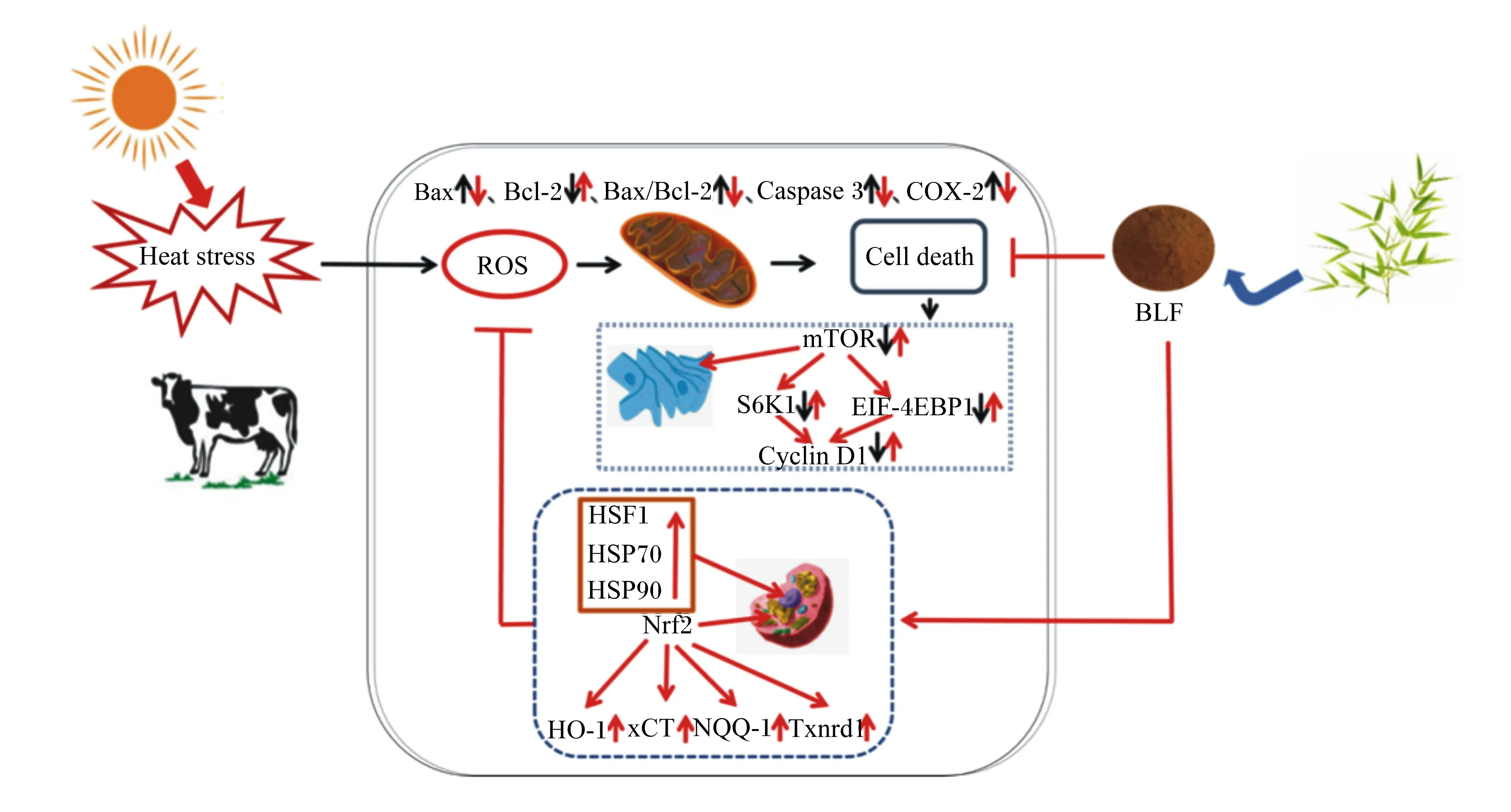
BLF:竹叶黄酮 bamboo leaf flavonoids;Bax:兔抗人单克隆抗体BCL2-associated X rabbit anti-human monoclonal antibody BCL2-associated X;Bcl-2:B淋巴细胞瘤/白血病-2 B-cell lymphoma-2; Caspase-3:半胱氨酸天冬氨酸蛋白酶-3 cysteine aspartate protease-3; COX-2:环氧合酶-2 cyclooxygenase-2; ROS:活性氧reactive oxygen species; mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin; S6K1:核糖体p70S6 ribosome p70S6; EIF-4EBP1:真核翻译起始因子4E结合蛋白 eukaryotic translation initiation factor 4E binding protein; CyclinD1:细胞周期素D1; HSF1:热休克转录因子1 heat shock transcription factor 1; HSP70:热休克蛋白70 heat shock protein 70; HSP90:热休克蛋白90 heat shock protein 90; Nrf2:核因子红细胞相关因子2 nuclear factor erythroid 2 related factor 2; HO-1:血红素加氧酶-1 hemeoxygenase-1; xCT:半胱氨酸摄取转运蛋白cysteine uptake transporter; NQO-1:NADPH-醌氧化还原酶1 NADPH-quinone oxidoreductase 1; Txnrd1:硫氧化还原蛋白还原酶1 thioredoxin reductase 1。图7 BLF对热应激诱导BMECs氧化损伤的保护作用概略图Fig.7 Graphical effects of BLF protective function on oxidative damage of BMECs induced by heat stress
4 结 论
添加BLF对热应激诱导BMECs的氧化损伤,可抑制ROS生成、减少细胞凋亡和线粒体损伤。添加不同浓度的BLF上调Nrf2、HO-1、xCT、Txnrd1和NQO1的mRNA相对表达量,可通过Nrf2信号通路的调节有效减轻热应激对BMECs的氧化损伤,且添加5 μg/mL BLF对热应激诱导BMECs氧化损伤的保护效果最好。
