复合菌发酵豆粕的效果及代谢产物研究
2022-02-20郭萌萌杨雨鑫王小龙陈玉林
郭萌萌 曹 锡 张 科 杨雨鑫 王小龙 陈玉林*
(1.西北农林科技大学动物医学院,杨凌 712100;2.西北农林科技大学动物科技学院,杨凌 712100)
豆粕是大豆制油后的一种副产品,粗蛋白质含量在40%以上[1],氨基酸的组成合理且供应充足,是重要的植物蛋白质资源。但是,豆粕中的蛋白质分子质量较大,还含有大豆抗原蛋白、植酸、低聚糖、胰蛋白酶抑制剂等抗营养因子,不同程度地影响豆粕的消化和吸收,对动物的健康和生产性能产生了不良的影响[2-3],限制了对豆粕的利用效率。目前世界范围内降低豆粕抗营养因子的方法主要包括:热处理、化学处理、微生物发酵等[4]。热处理法主要使用高温膨化,效果较好但是成本过高,不利于生产推广;化学处理法主要使用化学试剂处理豆粕原料,但容易导致化学物质的残留[5-7]。微生物发酵不但可以有效去除抗营养因子,还能在发酵的过程中将蛋白质分解成小肽,提高必需氨基酸的比例,提高动物对豆粕的消化吸收率[8]。
本试验通过在陕西省火地塘林场、红河谷等地采集的腐殖质及淤泥样品中筛选的2株蛋白酶活性较高的枯草芽孢杆菌,结合实验室贮备的3株乳酸菌和3株酵母菌,按不同接种比例进行复合菌发酵豆粕试验,以期得到最佳的接菌量和料水比,优化豆粕发酵工艺条件,并采用非靶向代谢组学筛选发酵豆粕中差异代谢产物,以期为饲用微生物发酵豆粕提供基础数据。
1 材料与方法
1.1 试验材料
豆粕原料是陕西杨凌某公司提供的未发生霉变的饲料。从火地塘腐殖土、漆水河淤泥、豆粕腐殖质等样品中筛选到枯草芽孢杆菌(Bacillussubtilis)2株:Bacillussubtilis-Byn 8、Bacillussubtilis-dou 2,结合实验室保存的乳酸菌[植物乳杆菌(Lactobacillusplantarum)]3株:Lactobacillusplantarum-L3、Lactobacillusplantarum-L11、Lactobacillusplantarum-L18,酵母菌[酿酒酵母(Saccharomycescerevisiae)]3株:Saccharomycescerevisiae-S1、Saccharomycescerevisiae-S11、Saccharomycescerevisiae-S12进行发酵。
1.2 试验设计
按照枯草芽孢杆菌、乳酸菌、酵母菌接种体积比例不同设置9个组(G1~G9组),具体试验设计如表1所示。菌液在37 ℃摇床培养24 h,菌液总添加量为12%,红糖添加量为2%,发酵时间5 d。Bacillussubtilis-Byn 8的活菌数为1×107CFU/mL,Bacillussubtilis-Bdou 2的活菌数为2.2×107CFU/mL,Lactobacillusplantarum-L3的活菌数为2.8×107CFU/mL,Lactobacillusplantarum-L11的活菌数为1.2×107CFU/mL,Lactobacillusplantarum-L18的活菌数为2×107CFU/mL,Saccharomycescerevisiae-S1的活菌数为1×107CFU/mL,Saccharomycescerevisiae-S11的活菌数为1×108CFU/mL,Saccharomycescerevisiae-S12的活菌数为2.1×107CFU/mL。对照组(Con组)仅添加试验组所添加菌液等体积的无菌水。枯草芽孢杆菌采用LB培养基进行培养,酵母菌采用马铃薯葡萄糖琼脂培养基进行培养,乳酸菌采用MRS培养基培养进行培养,具体培养基配方参照文献描述[9-10]。

表1 试验设计(接种体积比例)Table 1 Experiment design (volume ratio of bacteria liquid)
非靶向代谢组学测定前饲料样品的制备:准备无菌发酵袋,在超净台上将发酵袋里层翻出,用酒精棉球反复擦拭,将其立于工作台中。用紫外线进行灭菌,待乙醇全部挥发,将袋子恢复,并标号。试验设置5个组,对照组(CK组)为豆粕原料未灭菌组,料水比为1∶0.42,红糖添加量为2%,37 ℃发酵5 d;4个试验组分别为枯草芽孢杆菌组(Bac组)、乳酸杆菌组(Lac组)、酵母菌组(Yea组)、混菌组(Mix组),接菌量为12%,料水比为1∶0.42,红糖添加量为2%,枯草芽孢杆菌、乳酸菌和酵母菌添加的体积比例为6∶3∶2,每组3个重复。
1.3 测定指标及方法
pH:称取5 g样品加45 mL蒸馏水在250 mL锥形瓶中充分振荡30 min,用便携式pH计测定溶液pH;粗蛋白质含量:参照GB/T 6432—2018《饲料中粗蛋白质的测定》方法测定;小肽含量:参照QBHHS JC006—2013发酵豆粕中小肽的检测方法(三氯乙酸法)测定;粗脂肪含量:参照GB/T 6433—2006《饲料中粗脂肪的测定》方法测定;中性洗涤纤维含量:参照GB/T 20806—2006《饲料中中性洗涤纤维的测定》方法测定;酸性洗涤纤维含量:参照NY/T 1459—2007《饲料中酸性洗涤纤维的测定》方法测定;有效磷含量:用高分辨自动化学分析仪进行测定;黄曲霉毒素含量:参照酶联免疫吸附试验(ELISA)毒素检测试剂盒说明书(MB-11241A,酶标生物,江苏)测定;玉米赤霉烯酮含量:参照ELISA毒素检测试剂盒说明书(JC-P09431A,酶标生物,江苏)测定;大豆球蛋白含量:参照大豆球蛋白快速定量检测试剂盒说明书(EA02,北京龙科方舟生物工程技术有限公司,北京)测定。
1.4 非靶向代谢组学测定与分析
1.4.1 样品处理
取50 mg发酵后的豆粕样品,加入400 μL提取液(甲醇∶水=4∶1)于样品中,低温条件下,高通量组织破碎仪破碎旋涡混匀后,冰上超声萃取10 min,将样品静止于-20 ℃ 30 min。
1.4.2 液相色谱与质谱条件
色谱柱为BEHC18柱,流动相A为水(含0.1%甲酸),流动相B为乙腈/异丙醇(1∶1)(含0.1%甲酸),流速为0.40 mL/min,进样量为20 μL,柱温为40℃。样品质谱信号采集分别采用正负离子扫描模式,电喷雾毛细管电压,进样电压和碰撞电压分别为1.0 kV,40 V和6 eV。离子源温度和去溶剂温度分别为20和500 ℃,载气流量900 L/h,质谱扫描范围50~1 000 m/z,分辨率为30 000。
1.4.3 非靶向代谢组学数据分析
在进行统计分析之前,对原始数据进行预处理。原始数据导入处理软件Progenesis QI(Waters Corporation,Milford,美国)进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵,然后进行数据预处理:1)仅保留所有样品中非零值50%以上的变量;2)原始矩阵中最小值填补缺失值;3)总峰归一化,同时删除QC样本相对标准偏差(RSD)>30%的变量,得到最终用于后续分析的数据矩阵。用软件Progenesis QI进行搜库鉴定。主要数据库为http://www.hmdb.ca/; https://metlin.scripps.edu/公共数据库。
1.5 数据统计与分析
利用SPSS 20.0统计软件进行单因子方差分析(one-way ANOVA),Turkey差异检验。统计结果以P<0.05具有统计学意义,结果用“平均值±标准误”表示,使用Graphpad Prism 8软件进行图表的绘制。采用Kruskal-Wallis秩和检验分析差异代谢产物,通过美吉生信云平台进行代谢组学的可视化分析。
2 结果与分析
2.1 复合菌发酵豆粕pH指标变化
如图1所示,各试验组初始pH约为6.2,随着发酵时间的延长,pH一直在下降,直到第4天达到最低,约4.2,第4天后开始升高。

图1 复合菌发酵豆粕中pH的动态变化Fig.1 Dynamic change of pH in fermented soybean meal by compound microbes
2.2 发酵豆粕营养指标含量的变化
对发酵后豆粕中粗蛋白质、小肽、粗脂肪、有效磷、中性洗涤纤维和酸性洗涤纤维含量进行测定,如表2所示,与对照组相比,9个试验组的粗蛋白质和小肽含量均显著增加(P<0.05)。其中G9组的粗蛋白质含量增加率最高,达到了10%。G3组小肽含量增加率最高,达到39.37%。与对照组相比,G3和G6组的粗脂肪含量均显著提高(P<0.05),而有效磷含量只有G5组显著增加(P<0.05)。与对照组相比,试验组酸性洗涤纤维含量均显著下降(P<0.05),G7组效果最显著;G5组中性洗涤纤维含量与对照组无显著差异(P>0.05),其他试验组均显著下降(P<0.05)。
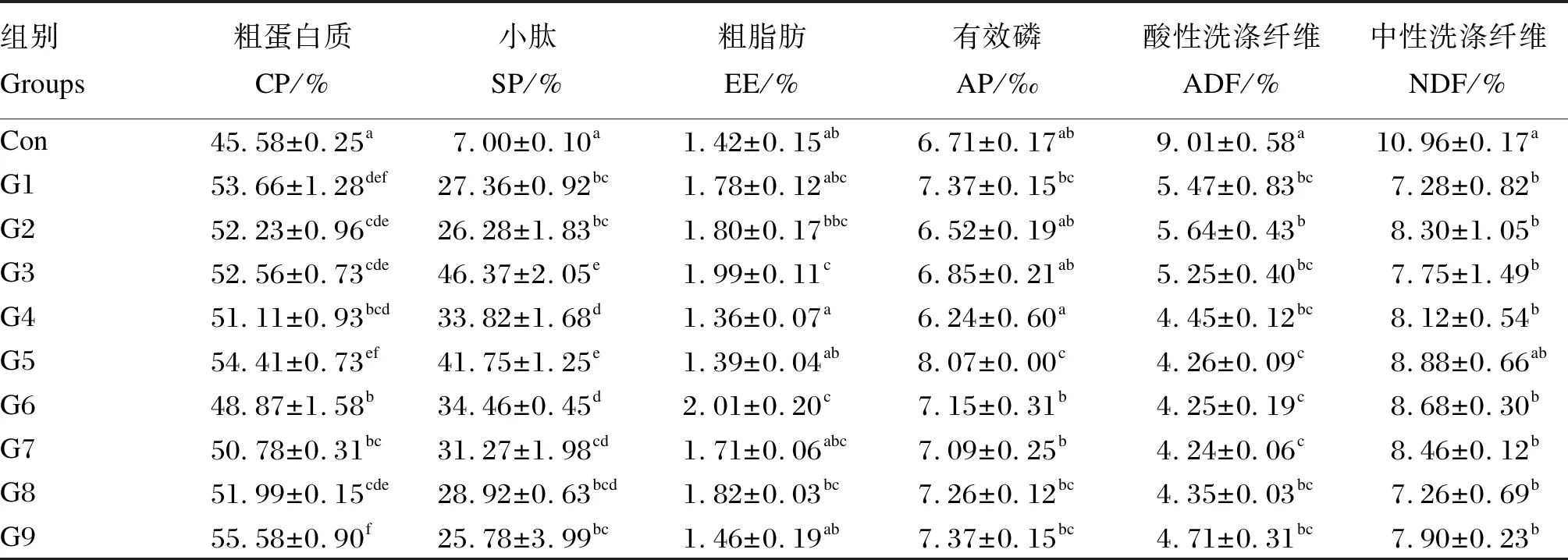
表2 复合菌发酵对豆粕中营养成分含量的影响(绝干样)Table 2 Effects of compound microbes fermentation on nutrient contents of soybean meal (absolute dry sample)
2.3 复合菌发酵豆粕大豆球蛋白含量变化
如表3所示,复合菌发酵豆粕后,各试验组的大豆球蛋白含量均显著降低(P<0.05),其中G5组含量最低,为107.19 mg/g。

表3 复合菌发酵对豆粕的大豆球蛋白含量的影响Table 3 Effects of compound microbes fermentation on soybean globulin content of soybean meal mg/g
2.4 复合菌发酵豆粕毒素含量变化
如表4所示,豆粕中主要存在的毒素为黄曲霉毒素和玉米赤霉烯酮,经过复合发酵后,依据GB 13078—2017《饲料卫生标准》,各试验组毒素含量均未超标。

表4 复合菌发酵对豆粕毒素含量的影响Table 4 Effects of compound microbes fermentation on soybean meal toxin contents of soybean meal ng/g

续表4组别 Groups黄曲霉毒素 Aflatoxin玉米赤霉烯酮 ZearalenoneG22.28±0.03de5.61±0.05bcG32.53±0.05bc5.28±0.04cG42.83±0.02a9.32±0.28aG52.12±0.01e6.27±0.08bG62.12±0.03e8.51±0.16aG72.58±0.02bc6.12±0.12bcG82.63±0.07b9.12±0.17aG92.43±0.03cd5.88±0.24bc
2.5 复合菌发酵豆粕代谢产物的变化
2.5.1 不同微生物发酵豆粕的代谢组分聚类分析
将液相色谱-质谱联用(LC-MS)分析所得数据进行偏最小二乘法判别分析(PLS-DA),如图2-A所示,Bac、Lac和Mix组与CK组之间显著分开,各组发酵代谢产物分别单独聚类,不同微生物发酵豆粕代谢产物存在明显差异。进一步通过Venn图分析各组之间的差异代谢产物数量发现,Bac、Lac、Yea和Mix组分别有20、27、22和26个独特的差异代谢产物(图2-B)。分析各组之间差异代谢产物的聚类情况发现,Bac和Yea组的代谢产物相似,Lac和Mix组的代谢产物出现显著的差异聚类(图2-C)。
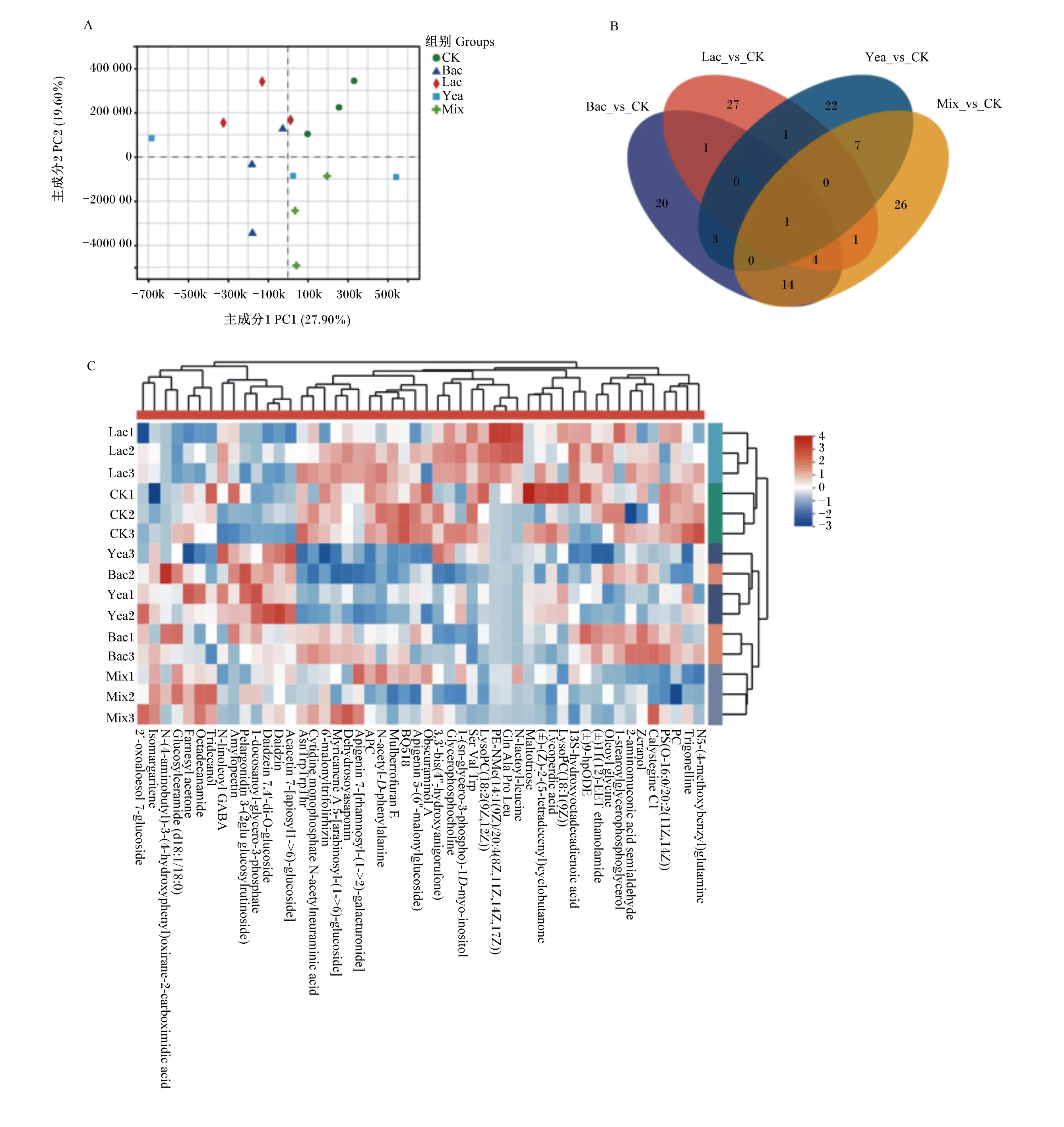
A:主成分分析 PCA;B:Venn图 Venn diagram;C:差异代谢产物聚类分析 cluster analysis of differential metabolites。2’-oxoaloesol 7-glucoside:2’-氧代木糖醇7-葡萄糖苷;Isomargaritene:刺槐黄素-6-C-新橙皮糖苷;N-(4-aminobutyl)-3-(4-hydroxyphenyl)oxirane-2-carboximidic acid:N-(4-氨基丁基)-3-(4-对羟基苯) 环氧乙烷-2-甲亚胺酸;Glucosylceramide (d18∶1/18∶0): 葡糖神经酰胺;Farnesyl acetone:金合欢基丙酮;Octadecanamide:硬脂酸酰胺;Tridecanol:十三醇;N-linoleoyl GABA:N-亚油酰基氨基丁酸;Amylopectin:支链淀粉;Pelargonidin 3-(2glu glucosylrutinoside):花葵素;1-docosanoyl-glycero-3-phosphate:1-二十二碳酰-丙三醇-3-磷酸盐;Daidzein 7,4′-di-O-glucoside:黄豆苷元7,4′-di-O-葡萄糖苷;Daidzin:黄豆苷;Acacetin 7-[apiosyl(1->6)-glucoside]:金合欢素;AsnTrpTrpThr:天冬酰胺色氨酸色氨酸苏氨酸;Cytidine monophosphate N-acetylneuraminic acid:胞苷单磷酸N -乙酰神经氨酸;6′-malonyltrifolirhizin:6′-丙二酰三叶草酸根;Myricanene A 5-[arabinosyl-(1->6)-glucoside]:月桂烯 A 5-[阿拉伯糖基-(1->6)-葡萄糖苷];Dehydrosoyasaponin:去氢大豆皂甙;Apigenin 7-[rhamnosyl-(1->2)-galacturonide]:芹黄素7-[鼠李糖-(1->2)-葡萄糖苷];APC:别藻蓝蛋白;N-acetyl-D-phenylalanine:乙酰氨基;Mulberrofuran E:桑呋喃E;Apigenin 5-(6″-malonylglucoside):芹黄素-5-(6″-丙二酰葡萄糖苷);3,3′-bis(4″-hydroxyanigorufone):3,3′-bis(4″-羟基茴香醚);Glycerophosphocholine:甘油磷酰胆碱;1-(sn-glycero-3-phospho)-1D-myo-inositol:1-(sn-丙三基-3-磷光体)-1D-肌红蛋白-肌醇;Ser Val Trp:丝氨酸缬氨酸色氨酸;LysoPC(18∶2(9Z,12Z)):胆碱(18∶2(9Z,12Z));PE-NMe(14∶1(9Z)/20∶4(8Z,11Z,14Z,17Z)):聚乙烯-NMe(14∶1(9Z)/20∶4(8Z,11Z,14Z,17Z));Gln Ala Pro Leu::谷氨酰胺丙氨酸脯氨酸亮氨酸;N-lactoyl-leucine:N-乳酰-亮氨酸;Maltotriose:麦芽三糖;(±)-(Z)-2-(5-tetradecenyl)cyclobutanone:(±)-(Z)-2-(5-十四碳烯基酯)环丁酮;Lycoperdic acid:番茄红酸;LysoPC(18∶1(9Z)):胆碱(18∶1(9Z));13S-hydroxyoctadecadienoic acid:13s-二烯酸;(±)9-HpODE:(±)9-十八碳二烯酸;(±)11(12)-EET ethanolamide:(±)11(12)-EET乙醇胺;Oleoyl glycine:油酰甘氨酸;1-stearoylglycerophosphoglycerol:1-硬脂酰甘油磷酸甘油;2-aminomuconic acid semialdehyde:2-aminomuconic酸半醛;Zeranol:玉米赤霉醇;Calystegine C1:打碗花精C1;PS(O-16∶0/20∶2(11Z,14Z)):聚苯乙烯(O-16∶0/20∶2(11Z,14Z));PC:聚碳酸酯;Trigonelline:葫芦巴碱;N5-(4-methoxybenzyl)glutamine:N5-(4-甲氧苯甲醇)谷氨酰胺。图2 不同微生物发酵豆粕的代谢产物聚类分析Fig.2 Cluster analysis of metabolites of soybean meal fermented by different microorganisms
2.5.2 不同微生物发酵豆粕差异代谢产物的筛选
根据变量权重值(VIP)>2的筛选原则,筛选试验组与对照组的差异代谢产物,其中Bac组与CK组的差异代谢产物主要包括:亚油酸盐(linoleamide)、1-palmitoylglycerophosphoinositol、DG、黄豆苷元(daidzein)、PC等。Lac组与CK组的差异代谢产物主要包括:亚油酸盐、N-hexadecanoylpyrrolidine、PS、芹菜素(apigenin)、1-palmitoylglycerophosphoinositol等。Yea组与CK组的差异代谢产物主要包括:PC、黄豆苷元、PS、芹菜素、1-palmitoylglycerophosphoinositol等。Mix组与CK组的差异代谢产物主要包括:PC、linoleamide、PS、黄豆苷元、芹菜素、1-palmitoylglycerophosphoinositol等。其中4组比较共有的差异代谢产物包括:芹菜素、水苏糖(stachyose)、麦芽三糖(maltotriose)、黄豆苷元、LysoPC、PS、tetramethylquercetin、11-keto、1-palmitoyl-2-linoleoyl PE等。其中Mix组特有的差异代谢产物包括:Pro Pro Ile Leu、N-lactoyl-isoeucine、phloretin xylosyl-galactoside、octadecanamide。其中Yea组特有的差异代谢产物包括:indoleacrylic acid、6-beta-hydroxydexamethasone、araliasaponin等。其中Lac组特有的差异代谢产物包括:pinolenic acid、netilmicin、Arg Val Val Phe、omphalotin C等。其中Bac组特有的差异代谢产物包括:1-oleoylglycerophosphoinositol、linoleoyl ethanolamide。
微生物群落代谢特征的变化反映了微生物群落动态的变化;因此,我们试图根据代谢组学数据定义微生物群落结构与代谢功能之间的关系。如图4所示,与CK组相比,差异代谢产物主要参与亚油酸代谢、苯丙氨酸代谢、组氨酸和嘌呤衍生生物碱的生物合成、α-亚麻酸代谢、半乳糖代谢、碳水化合物的消化吸收、鞘脂代谢、植物次生代谢产物的生物合成、植物激素的生物合成。
3 讨 论
本试验以乳酸菌、酵母菌和枯草芽孢杆菌为发酵菌种,按不同的接菌体积比例发酵豆粕,发酵时长为5 d,结果显示pH在第4天降至4.2,第5天开始回升。这个过程是由于前期乳酸菌利用底物产生乳酸,降低了pH,使发酵处于酸性环境,同时枯草芽孢杆菌利用氧气,为乳酸菌的生长提供了厌氧环境,这与陈倩倩等[11]、柯芙容等[12]研究结果一致。第5天后pH回升可能是由于乳酸菌死亡,乳酸生成减少。
在发酵过程中,粗蛋白质和小肽含量是评价发酵效果的重要指标。一方面,微生物的呼吸作用消耗部分有机物,使得产物总量减少,出现了蛋白质的“浓缩效应”[13];另一方面,微生物利用发酵体系中的无机铵盐和碳源大量繁殖,产生菌体蛋白[14],这是提高粗蛋白质含量的重要原因。本研究各试验组的粗蛋白质含量均显著增加,其中粗蛋白质含量增加最多的G9组与对照组相比粗蛋白质含量提高了10%。刘星等[15]利用不同的微生物发酵豆粕,发现产枯草芽孢杆菌组发酵使粗蛋白质含量从45.28%提高至48.37%。郑环宇等[16]在优化混菌株固态发酵高温豆粕工艺的研究中,发现在黑曲霉、酿酒酵母菌、枯草芽孢杆菌、植物乳酸杆菌比例为2∶2∶1∶1,接种量为10%,料水比为1∶3,温度为33 ℃的条件下发酵96 h,粗蛋白质含量相比于豆粕原料增加了24.36%。刘剑飞[17]利用枯草芽孢杆菌、酵母菌、植物乳杆菌混菌发酵豆粕后,测得粗蛋白质含量提高了13.5%,这与本研究结果一致。小肽在动物体内吸收效率高、吸收快、能耗低、不易饱和,各种肽之间转运无竞争性抑制,因此营养价值更高[18]。熊涛等[19]利用筛选出的一种甲基营养型芽孢杆菌,进行单菌发酵豆粕,与未发酵豆粕相比,小肽含量提高了27.22%,而陈倩倩等[11]使用解淀粉芽孢杆菌、植物乳杆菌、酿酒酵母菌按特定接种比例进行混菌发酵,发现小肽含量提高了8.68倍。本研究的小肽含量最高达到了46.37%。
研究表明,枯草芽孢杆菌能产生大量的纤维素酶,对于降解底物中的纤维素起重要作用[20]。邱丰艳等[21]在多菌复合固态发酵富硒豆粕的研究中发现粗纤维含量有所降低,但不显著,而任志青等[22]利用粗壮脉纹孢菌,发酵豆粕96 h,粗纤维降解率高达71.62%。在本试验结果中发现,各试验组的中性洗涤纤维和酸性洗涤纤维含量均显著降低,说明本试验所筛选的枯草芽孢杆菌在降低纤维素含量方面效果显著。经复合菌发酵后,G2、G3、G6组的粗脂肪含量都显著提高,这可能是豆粕中部分有机物被微生物生长所利用而造成干物质损失,使得它们的含量相对提高[11]。
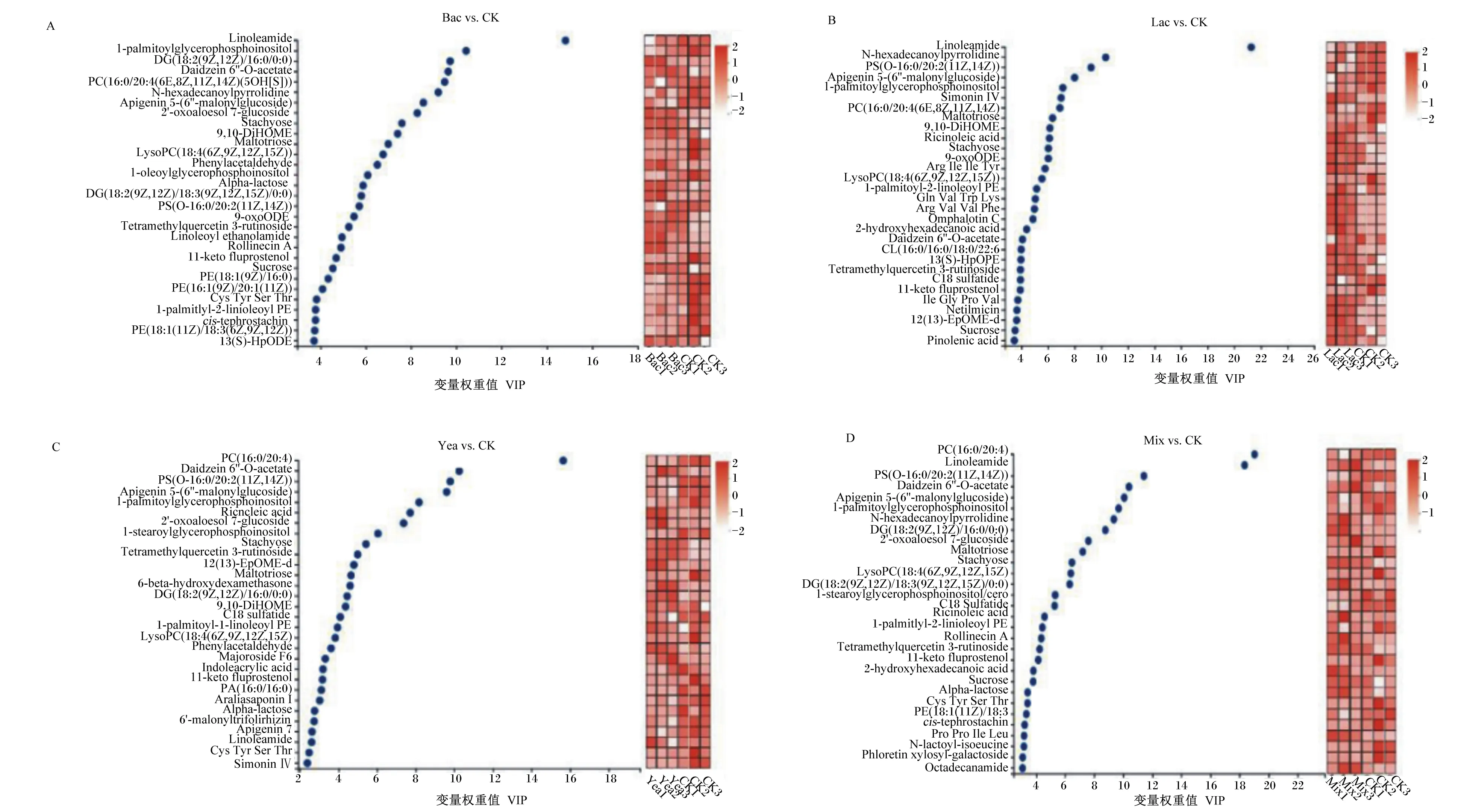
A:Bac与CK组发酵豆粕的差异代谢产物 differential metabolites of fermented soybean meal between Bac group and CK group;B:Lac与CK组发酵豆粕差的异代谢产物 different metabolites of fermented soybean meal between Lac group and CK group;C:Yea与CK组发酵豆粕差的异代谢产物 differential metabolites of fermented soybean meal between Yea group and CK group;D:Mix与CK组发酵豆粕的差异代谢产物 differential metabolites of fermented soybean meal between Mix group and in CK group。Linoleamide:亚油酰胺;1-palmitoylglycerophosphoinositol:1-棕榈酰甘油磷酸肌醇;DG(18∶2(9Z,12Z)/16∶0/0∶0):二酰甘油(18∶2(9Z,12Z)/16∶0/0∶0);Daidzein 6″-O-acetate:黄豆苷元6″-O-醋酸盐;PC(16∶0/20∶4(6E,8Z,11Z,14Z)(5OH[S])):聚碳酸酯;N-hexadecanoylpyrrolidine:N-十六酰基吡咯烷;Apigenin 5-(6″-malonylglucoside):芹黄素5-(6″-malonylglucoside);2′-oxoaloesol 7-glucoside:2’-氧代木糖醇 7-葡萄糖苷;Stachyose:水苏糖;9,10-DiHOME:十八-9,12-二烯酸;Maltotriose:麦芽三糖;LysoPC(18∶4(6Z,9Z,12Z,15Z)):胆碱(18∶4(6Z,9Z,12Z,15Z));1-oleoylglycerophosphoinositol:1-油酰甘油磷酸肌醇;Alpha-lactose:α-乳糖;DG(18∶2(9Z,12Z)/18∶3(9Z,12Z,15Z)/0∶0):二酰甘油;PS(O-16∶0/20∶2(11Z,14Z)):磷脂酰-L-丝氨酸;9-OxoODE:氧十八碳二烯酸;Tetramethylquercetin 3-rutinoside:四甲基槲皮素3-芸香苷;Linoleoyl ethanolamide:亚油酰乙醇酰胺;Rollinecin A:罗林霉素A;11-keto fluprostenol:11-酮氟前列腺素;Sucrose:蔗糖;PE(18∶1(9Z)/16∶0):聚乙烯(18∶1(9Z)/16∶0);PE(16∶1(9Z)/20∶1(11Z)):聚乙烯(16∶1(9Z)/20∶1(11Z));Cys Tyr Ser Thr:半胱氨酸酪氨酸丝氨酸苏氨酸;cis-tephrostachin:顺式铁强酸;PE(18∶1(11Z)/18∶3(6Z,9Z,12Z)):聚乙烯(18∶1(11Z)/18∶3(6Z,9Z,12Z));13(S)-hpODE:13(S)-十八碳二烯酸;Simonin IV:C68H120O24;Ricinoleic acid:蓖麻油酸;Arg Ile Ile Tyr:精氨酸异亮氨酸异亮氨酸酪氨酸;Arg Val Val Phe:精氨酸缬氨酸缬氨酸苯丙氨酸;Omphalotin C:脐菇亭C;2-hydroxyhexadecanoic acid:羟基十六酸;CL(16∶0/16∶0/18∶0/22∶6:氯化物;Tetramethylquercetin 3-rutinoside:四甲基槲皮素3-芸香苷;C18 sulfatide:C18硫苷脂;Ile Gly Pro Val:异亮氨酸甘氨酸脯氨酸缬氨酸;Netilmicin:奈替米星;12(13)-EpOME-d:(±)-斑鸠菊酸;Pinolenic acid:皮诺敛酸;1-stearoylglycerophosphoinositol:1-硬脂酰甘油磷酸肌醇;6-beta-hydroxydexamethasone:6-β-羟基地塞米松;DG(18∶2(9Z,12Z)/16∶0/0∶0):二酰甘油(18∶2(9Z,12Z)/16∶0/0∶0);1-palmitoyl-2-linoleoyl PE:1-棕榈酰-2-亚油酰基聚乙烯;Phenylacetaldehyde:苯乙醛;Majoroside F6:大车前草苷 F6;Indoleacrylic acid:吲哚丙烯酸;PA(16∶0/16∶0):聚酰胺(16∶0/16∶0);Araliasaponin Ⅰ:阿拉里亚皂苷Ⅰ;Alpha-lactose:α-乳糖;6′-malonyltrifolirhizin:6′-丙二酰三叶豆紫檀苷;Apigenin:芹黄素;1-stearoylglycerophosphoglycerol:1-硬脂酰甘油磷酸甘油;Rollinecin A:罗林霉素A;2-hydroxyhexadecanoic acid:2-羟基十六烷酸;cis-tephrostachin:顺式铁强酸;Pro Pro Ile Leu:脯氨酸脯氨酸异亮氨酸亮氨酸;N-lactoyl-isoeucine:N-乳酰基异亮氨酸;Phloretin xylosyl-galactoside:根皮素;Octadecanamide:硬脂酸酰胺。图3 基于OPLS-DA模型加权系数的VIP评分分析、差异代谢产物VIP气泡图及表达量热图Fig.3 VIP score analysis based on weighted coefficient of OPLS-DA model, VIP bubble map and expression heatmap of differential metabolites

Linoleic acid metabolism:亚油酸代谢;Phenylalanine metabolism:苯丙氨酸代谢;Biosynthesis of alkaloids derived from histidine and purine:组氨酸和嘌呤生物碱的生物合成;Central carbon metabolism in cancer:癌症的中心碳代谢;alpha-Linolenic acid metabolism:亚麻酸代谢;Galactose metabolism:半乳糖代谢;ABC transporters:ABC转运蛋白;Biosynthesisof plant hormones:植物激素的生物合成;Biosynthesis of plant secondary metabolites:植物次生代谢产物的生物合成;Sphingolipid metabolism:鞘脂类代谢;Carbohydrate digestion and absorption:碳水化合物的消化吸收;Mineral absorption:矿质营养吸收;mTOR signaling pathway:丝氨酸/苏氨酸激酶(雷帕霉素靶蛋白)信号通路;Protein digestion and absorption:蛋白质消化吸收;PPAR signaling pathway:过氧化物酶体增殖物激活受体信号通路;Aminoacyl-tRNA biosynthesis:氨酰生物合成;Nicotinate and nicotinamide metabolism:烟酸盐和烟酰胺代谢;GABAergic synapse:GABA能神经元突触;Choline metabolism in cancer:癌症中的胆碱代谢;Glucosinolate biosynthesis:芥子油苷生物合成。P<0.05、P<0.01和P<0.001分别用“*”、“**”和“***”表示。P<0.05, P<0.01 and P<0.001 are denoted by “*”, “**” and “***”, respectively.图4 基于KEGG的功能富集分析Fig.4 Functional enrichment analysis based on KEGG
大豆球蛋白作为豆粕中热稳定型的抗营养因子,严重影响了豆粕的营养价值,可诱发仔猪的断奶综合征,降低仔猪成活率[23],此外还可引起动物过敏反应和肠黏膜的损伤,导致动物消化不良、腹泻和生长受阻[24]。利用发酵豆粕粉代替鱼粉饲喂育虾,发现可提高育虾的品质和存活率[25]。Seo等[26]发现豆粕经枯草芽孢杆菌固态发酵后,发现大部分β-伴大豆球蛋白被降解;程天德等[27]使用枯草芽孢杆菌发酵豆粕,发现可以降解85.39%的大豆抗原蛋白;黄颖[28]利用多菌种固态和液态发酵豆粕对比发酵效果,发现植物乳杆菌液态发酵能使大豆球蛋白的降解率达到75.00%。本研究中各试验组的大豆球蛋白含量均显著下降,其中效果最好的G5组下降了52.15%。有研究发现,多种微生物复合发酵豆粕可以将豆粕的大分子蛋白质降解为小肽、氨基酸等小分子物质,减少抗营养因子,优化了豆粕的营养质量,提高了豆粕的营养价值[29]。而植酸也是存在于豆粕中的一种热稳定型抗营养因子,另有研究证实,植酸会使消化酶活性降低,降低动物生产性能[30]。前期研究发现枯草芽孢杆菌与酿酒酵母代谢产生植酸酶,从而降低豆粕中植酸的含量,提高有效磷含量[31],在本研究中,G5组有效磷含量显著增加,这与前期研究结果一致。通过复合菌发酵处理,能有效消除了豆粕中的抗营养因子,使豆粕的营养价值得到改善。
豆粕中的主要氨基酸包括:苯丙氨酸、赖氨酸、亮氨酸、甘氨酸、丙氨酸、丝氨酸和谷氨酸等[32]。豆粕中的水苏糖含量占大豆可溶性糖类的12.1%~35.2%。发酵豆粕增加了水苏糖的含量。水苏糖可以调节肠道微生物区系,增加双歧杆菌丰度,改善肠道蠕动,增强免疫力,降低血压和血脂[33-34]。芹菜素是一种黄酮类化合物,广泛存在于多种植物中,药学价值丰富,具有抗肿瘤、抗氧化、抗炎等多种生物学作用[35]。发酵可以降低芹菜素的含量。黄豆苷元是豆科植物的次级代谢产物大豆异黄酮的一种,具有抑菌和防控大豆胞囊线虫病的作用[36-37]。发酵有效提高了黄豆苷元的含量。G1和G4组差异代谢产物筛选显示,枯草芽孢杆菌和混菌发酵增加了α-乳糖的含量,而G3组(酵母菌发酵)降低了α-乳糖的含量。研究表明α-乳糖能显著减轻脓毒症诱发的肝脏损伤[38]。总的来说,发酵改善了饲料品质,提高了利用率。
4 结 论
本试验在温度为37 ℃,料水比为1∶0.42,接种量为12%,发酵时间为120 h的条件下,通过添加不同接种体积比例的枯草芽孢杆菌、乳酸菌、酵母菌,进行复合菌发酵豆粕的研究。研究发现发酵豆粕的粗蛋白质和小肽等营养物质含量显著提高,大豆球蛋白、毒素等抗营养因子含量显著下降,综合各试验组的结果,当枯草芽孢杆菌∶乳酸菌∶酵母菌接种体积比例为6∶2∶3时,发酵豆粕效果最优。固态发酵豆粕显著提高了水苏糖、麦芽三糖、黄豆苷元、丝氨酸、缬氨酸、色氨酸、脯氨酸、异亮氨酸、亮氨酸等有益物质的含量,显著提高亚油酸代谢、苯丙氨酸代谢、组氨酸和嘌呤衍生生物碱的生物合成等代谢通路的丰度。
