发酵麸皮多糖对杜寒杂交肉羊瘤胃菌群及其屏障功能相关指标的影响
2022-02-20王文文孟子琪安晓萍齐景伟
王文文 王 园* 孟子琪 安晓萍 齐景伟
(1.内蒙古农业大学动物科学学院,呼和浩特 010018;2.内蒙古自治区草食家畜饲料工程技术研究中心,呼和浩特 010018;3.内蒙古自治区农牧业科学院动物营养与饲料研究所,呼和浩特 010031)
瘤胃对于反刍动物消化吸收营养物质至关重要。瘤胃微生物会将饲料中的碳水化合物和蛋白质发酵,降解生成短链脂肪酸、氨基酸及维生素等物质[1-2]。这些营养物质通过瘤胃上皮被吸收,为机体供能[3]。瘤胃上皮除具有吸收代谢营养物质的作用外,还具有阻止细菌有害代谢产物(组胺、脂多糖)通过上皮细胞入血、保护瘤胃的作用[4-5]。因此,通过营养手段调控瘤胃菌群结构和瘤胃上皮屏障功能对改善瘤胃内环境和维持瘤胃健康具有重要意义。研究发现,功能性多糖在调控瘤胃菌群结构和改善瘤胃发酵方面有积极作用。李颖[6]研究表明,猴头菇多糖可通过调控瘤胃菌群结构和与酸代谢相关的酶活性进而缓解山羊瘤胃酸中毒,维持瘤胃健康。发酵麸皮多糖(fermented wheat bran polysaccharides,FWBPs)作为一种功能性多糖,具有抗氧化[7]、抗炎[8]及调节免疫[9]等多种作用。本课题组前期研究发现,FWBPs具有调节大鼠肠道菌群结构和提高肠道屏障功能的作用[9-10]。同时,FWBPs还可以优化杜寒杂交肉羊瘤胃内环境,改善瘤胃发酵功能[11]。然而,目前关于FWBPs的研究主要集中于单胃动物上,其对反刍动物瘤胃菌群结构及瘤胃上皮屏障影响的研究未见报道。因此,本试验拟研究FWBPs对杜寒杂交肉羊瘤胃组织紧密连接蛋白和细胞因子基因表达及瘤胃菌群结构的影响,以期为FWBPs应用于反刍动物生产提供理论依据。
1 材料与方法
1.1 FWBPs的制备
参照史俊祥[12]的FWBPs制备方法。以小麦麸皮为原料,配以豆粕粉、玉米粉,三者比例为80.46∶9.32∶10.22;使用枯草芽孢杆菌和酿酒酵母菌混菌发酵,二者比例为6.7∶3.3;接种量10.4%,添加0.1%尿素,发酵温度35.4 ℃,时间52.7 h,料水比1∶1。发酵结束后,将发酵底物45 ℃烘干48 h,粉碎。与蒸馏水1∶20混合后80 ℃水浴提取30 min,离心弃沉淀,上清液加入4倍体积的95%乙醇,静置过夜,离心收集沉淀,干燥沉淀后即为FWBPs,经测定,其含量可达130.21 mg/g。
1.2 试验设计与饲养管理
试验选取健康且体重[(21.85±0.64) kg]相近的6周龄杜寒杂交肉羊21只,随机分为3个组,每组7只羊。对照组、低剂量组和高剂量组分别在基础饲粮中添加0、200、400 mg/kg BW的FWBPs。基础饲粮根据《肉羊饲养标准》(NY/T 816—2004)配制,其组成及营养水平见表1。基础饲粮为全混合颗粒饲料,直径为6 mm,长度为10 mm。预试期14 d,正试期56 d。试验在内蒙古农业大学实验基地海流图牧场进行,常规饲养管理,每日定时饲喂(08:00和17:00),每天根据前1天的剩料量重新调整饲喂量,保证料槽中每天有10%左右的剩料,自由饮水。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet (air-dry basis) %
1.3 样品采集
试验结束后,屠宰所有羊只,采集未过滤瘤胃食糜2 mL和瘤胃组织,液氮速冻,并将样品存于-80 ℃冰箱中待测。
1.4 瘤胃组织紧密连接蛋白和细胞因子基因表达的测定
采用Trizol法提取瘤胃组织总RNA。经微孔板分光光度计测得260和280 nm吸光度比值为1.8~2.0,琼脂糖凝胶电泳法评价RNA质量。参照FastQant RT Kit(with gDNase)说明书分别将各样品的总RNA进行逆转录合成cDNA,并以此为模板,使用表2所列的引物,按照SuperReal PreMix Plus(SYBR Green)说明书进行实时荧光定量PCR检测。以β-肌动蛋白(β-actin)为内参,干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-12(interleukin-12,IL-12)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、闭合小环蛋白-1(zonula occludens-1,ZO-1)、闭锁蛋白(occludin)、闭合蛋白-1(claudin-1)及闭合蛋白-4(claudin-4)的mRNA相对表达量采用2-△△Ct法进行计算。引物由生工生物(上海)股份有限公司合成,基因引物序列信息见表2。

表2 基因引物序列信息Table 2 Information of primer sequences of genes
1.5 Illumina-Nova测序分析
1.5.1 瘤胃食糜总DNA的提取、扩增及测序
1.5.2 生物信息学分析
测序所得的原始序列,首先使用Flash V1.2.7软件进行拼接,参照Qiime V1.7.0软件进行质量控制,得到有效序列。利用Uparse v7.0.1001软件对所有样品的有效序列以97%的一致性进行操作分类单元(operational taxonomic unit,OTU)聚类,用Mothur软件与SILVA的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0),在门水平、属水平下统计每个样品的菌群组成。各样品的数据经过均一化处理后,采用Qiime软件进行Alpha多样性和Beta多样性分析。通过线性判别分析(LDA)和线性判别分析效应大小(LEfSe)分析找出导致组间菌群变化的生物标志物。
1.6 统计分析
基因表达和菌群Alpha多样性指标数据使用SAS 9.2软件进行单因素方差分析,并进行Duncan氏法多重比较检验,试验结果以平均值和均值标准误(SEM)表示。菌群相对丰度数据使用SPSS 21.0进行非参数t检验分析,试验结果以平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 FWBPs对杜寒杂交肉羊瘤胃组织中紧密连接蛋白基因表达的影响
由表3可知,与对照组相比,低剂量组和高剂量组肉羊瘤胃组织中occludin、claudin-1和claudin-4的mRNA相对表达量显著增加(P<0.05),且低剂量组和高剂量组之间无显著差异(P>0.05);此外,高剂量组肉羊瘤胃组织中ZO-1的mRNA相对表达量显著增加(P<0.05)。

表3 FWBPs对杜寒杂交肉羊瘤胃组织中紧密连接蛋白基因表达的影响Table 3 Effects of FWBPs on expression of tight junction protein gene in rumen tissue of Dorper×thin-tailed Han crossbred meat lambs
2.2 FWBPs对杜寒杂交肉羊瘤胃组织中细胞因子基因表达的影响
由表4可知,各组之间肉羊瘤胃组织中IL-12和TNF-α的mRNA相对表达量无显著差异(P>0.05)。高剂量组肉羊瘤胃组织中IFN-γ和IL-6的mRNA相对表达量显著高于对照组和低剂量组(P<0.05)。

表4 FWBPs对杜寒杂交肉羊瘤胃组织中细胞因子基因表达的影响Table 4 Effects of FWBPs on expression of cytokine gene in rumen tissue of Dorper×thin-tailed Han crossbred meat lambs
2.3 FWBPs对杜寒杂交肉羊瘤胃菌群结构的影响
2.3.1 FWBPs对杜寒杂交肉羊瘤胃菌群Alpha多样性指数的影响
由表5可知,对照组、低剂量组和高剂量组瘤胃菌群的测序覆盖率为99.87%~99.88%。各组之间肉羊瘤胃菌群观测物种数、Chao1指数及ACE指数无显著差异(P>0.05)。高剂量组肉羊瘤胃菌群Shannon指数和Simpson指数显著高于对照组和低剂量组(P<0.05)。

表5 FWBPs对杜寒杂交肉羊瘤胃菌群Alpha多样性指数的影响Table 5 Effects of FWBPs on rumen microbiota Alpha diversity indexes of Dorper×thin-tailed Han crossbred meat lambs
2.3.2 FWBPs对杜寒杂交肉羊瘤胃菌群Beta多样性的影响
由图1可知,主成分1(PC1)的贡献率为39.94%,主成分2(PC2)的贡献率为25.75%。高剂量组与对照组和低剂量组瘤胃菌群结构有一定的差异,而对照组和低剂量组瘤胃菌群结构相似。

S3:低剂量组 low dose group;S4:高剂量组 high dose group;S5:对照组 control group。下图同 the same as below。图1 主成分分析图Fig.1 PCA diagram
2.3.3 FWBPs对杜寒杂交肉羊瘤胃菌群相对丰度的影响
由表6可知,与对照组相比,低剂量组肉羊瘤胃菌群中螺旋菌门(Spirochaetota)的相对丰度显著增加(P<0.05);高剂量组肉羊瘤胃菌群中变形菌门(Proteobacteria)的相对丰度显著降低(P<0.05),拟杆菌门(Bacteroidota)的相对丰度显著增加(P<0.05)。高剂量组肉羊瘤胃菌群中Proteobacteria的相对丰度极显著低于低剂量组(P<0.01),Spirochaetota的相对丰度显著低于低剂量组(P<0.05);而Bacteroidota的相对丰度极显著高于低剂量组(P<0.01)。
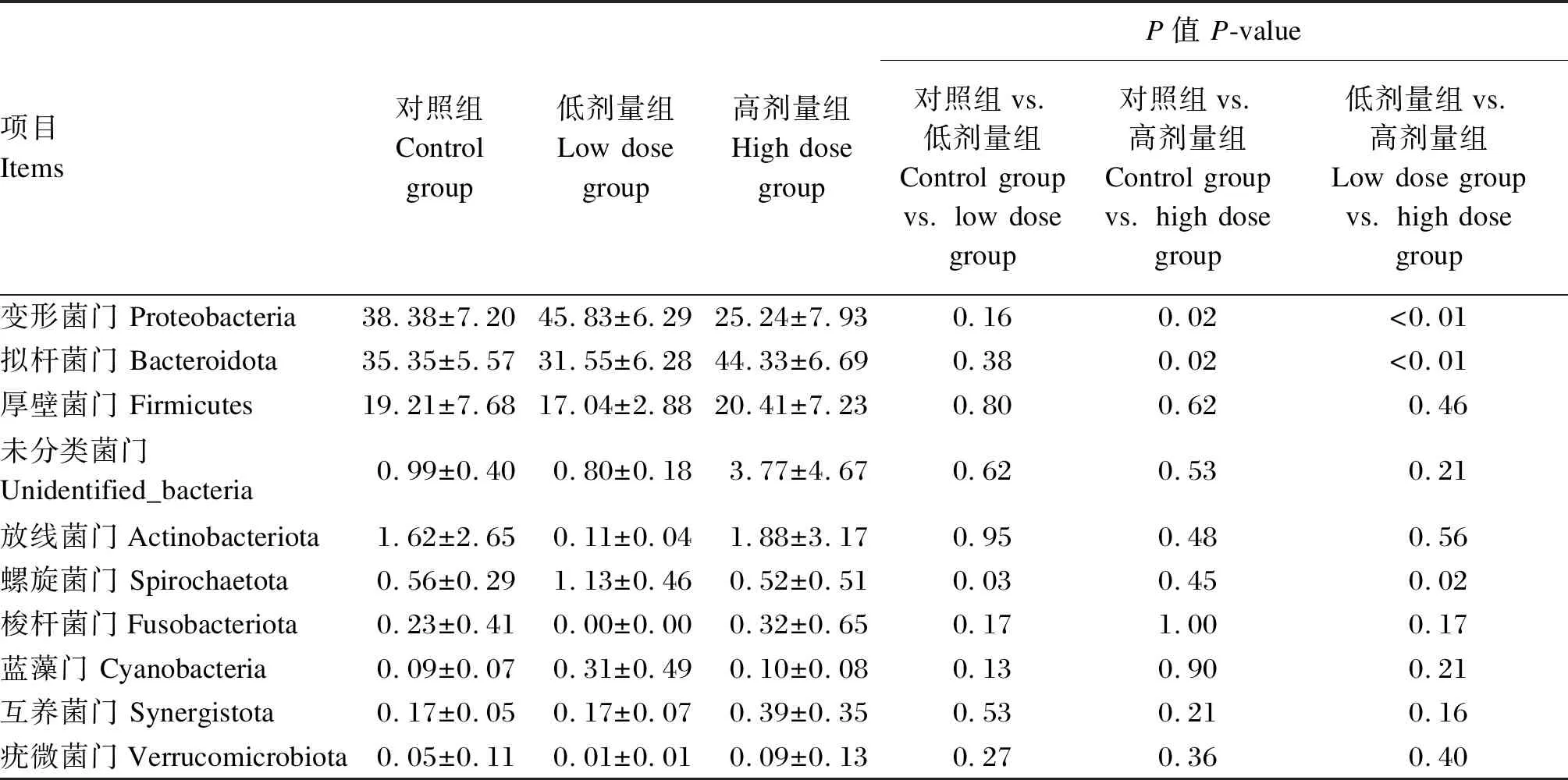
表6 瘤胃菌群在门水平的显著性分析Table 6 Significance analysis of rumen microbiota at phylum level %
由表7可知,与对照组相比,低剂量组肉羊瘤胃菌群中琥珀酸弧菌属(Succinivibrio)的相对丰度显著增加(P<0.05);高剂量组肉羊瘤胃菌群中琥珀酸弧菌科_UCG-001(Succinivibrionaceae_UCG-001)的相对丰度极显著降低(P<0.01),解琥珀酸菌属(Succiniclasticum)的相对丰度显著降低(P<0.05),新月形单胞菌属(Selenomonas)的相对丰度显著增加(P<0.05)。高剂量组肉羊瘤胃菌群中韦荣球菌科_UCG-001(Veillonellaceae_UCG-001)和Selenomonas的相对丰度极显著高于低剂量组(P<0.01),而Succinivibrionaceae_UCG-001的相对丰度极显著低于低剂量组(P<0.01)。

表7 瘤胃菌群在属水平的显著性分析Table 7 Significance analysis of rumen microbiota at genus level %
LEfSe分析可以实现多个分组之间的比较,从而找到组间在相对丰度上有显著差异且影响力较大的标记物种。由图2可知,当LDA阈值设定为4.0时,柔膜菌目(Erysipelotrichales)、氨基酸球菌科(Acidaminococcaceae)、氨基酸球菌目(Acidaminococcales)、Succiniclasticum在对照组中富集;琥珀酸弧菌科(Succinivibrionaceae)、气单胞菌目(Aeromonadales)、γ-变形菌纲(Gammaproteobacteria)、Proteobacteria、Succinivibrionaceae_UCG-001在低剂量组中富集;Bacteroidota、拟杆菌纲(Bacteroidia)、拟杆菌目(Bacteroidales)、普雷沃氏菌科(Prevotellaceae)、新月形单胞菌科(Selenomonadaceae)、栖瘤胃普雷沃氏菌(Prevotella_ruminicola)、Selenomonas、反刍兽月形单胞菌(Selenomonas_ruminantium)、Veillonellaceae_UCG-001在高剂量组中富集。

Erysipelotrichales:柔膜菌目;Acidaminococcaceae:氨基酸球菌科;Acidaminococcales:氨基酸球菌目;Succiniclasticum:解琥珀酸菌属;Bacteroidia:拟杆菌纲;Bacteroidales:拟杆菌目;Prevotellaceae:普雷沃氏菌科;Selenomonadaceae:新月形单胞菌科;Prevotella_ruminicola:栖瘤胃普雷沃氏菌;Selenomonas:新月形单胞菌属;Selenomonas_ruminantium:反刍兽月形单胞菌;Veillonellaceae_UCG-001:韦荣球菌科_UCG-001;Succinivibrionaceae:琥珀酸弧菌科;Aeromonadales:气单胞菌目;Gammaproteobacteria:γ-变形菌纲;Proteobacteria:变形菌门;Succinivibrionaceae_UCG-001:琥珀酸弧菌科_UCG-001。图2 瘤胃菌群LDA判别柱形图Fig.2 LDA discrimination column of rumen microbiota
3 讨 论
瘤胃上皮作为反刍动物吸收营养物质的重要场所和抵御病原微生物的屏障,其生理结构的完整对保持瘤胃健康具有重要意义。在集约化的养殖模式下,适应高精料饲粮对肉羊瘤胃微生物和瘤胃上皮是一个巨大的挑战。瘤胃微生物在对高精料饲粮进行发酵时,会产生大量有机酸,降低瘤胃pH,杀死革兰氏阴性菌并释放脂多糖,改变紧密连接蛋白的表达和分布,从而破坏瘤胃屏障并引发瘤胃上皮组织的炎症反应[13-14]。李碧波[15]研究发现,高精料饲粮会降低绒山羊瘤胃pH,增加脂多糖含量,降低瘤胃黏膜ZO-1、occludin、claudin-1及claudin-4的mRNA相对表达量,并提高白细胞介素-1β(interleukin-1β,IL-1β)、TNF-α和白细胞介素-10(interleukin-10,IL-10)的mRNA相对表达量。紧密连接蛋白(ZO-1、occludin、claudin-1和claudin-4)是评价瘤胃上皮屏障功能的重要指标,其mRNA相对表达量的下降代表瘤胃屏障功能受损。IFN-γ、IL-6、IL-1β、IL-10和TNF-α是调节机体免疫功能的重要细胞因子,其中IFN-γ、IL-6、IL-1β和TNF-α为促炎细胞因子,IL-10为抗炎细胞因子[16]。正常情况下,这些细胞因子会诱导并激活免疫细胞前往感染部位,发挥正向调节作用。但是,当机体内促炎细胞因子大量产生时就会引发炎症反应。本试验结果显示,饲粮添加200 mg/kg BW的FWBPs可增加肉羊瘤胃组织中occludin、claudin-1及claudin-4的mRNA相对表达量,而添加400 mg/kg BW的FWBPs可增加肉羊瘤胃组织中ZO-1、occludin、claudin-1和claudin-4的mRNA相对表达量。由此可推断,FWBPs可通过增加ZO-1、occludin、claudin-1和claudin-4的mRNA相对表达量来提高肉羊瘤胃屏障功能。有趣的是,FWBPs也提高了肉羊瘤胃组织中IFN-γ和IL-6的mRNA相对表达量。瘤胃中革兰氏阴性菌大量繁殖释放脂多糖是导致瘤胃炎症的主要原因[14]。Proteobacteria中含有很多产脂多糖的革兰氏阴性菌,如大肠杆菌(Escherichiacoli)、假交替单胞菌属(Pseudoalteromonas)和希瓦氏菌属(Shewanella)等[17]。本试验发现,饲粮添加400 mg/kg BW的FWBPs会降低瘤胃食糜中Proteobacteria的相对丰度。由此推测,肉羊瘤胃组织中IFN-γ和IL-6的mRNA相对表达量增加可能与瘤胃炎症无关,具体原因有待进一步研究。
饲料添加剂主要通过调控瘤胃内环境,稳定瘤胃pH,减少乳酸产量,增强纤维消化能力,进而改善瘤胃健康状况[18]。调控瘤胃内环境的关键是调节瘤胃微生物区系,而瘤胃中细菌的数量和种类最多。因此,本文主要讨论瘤胃细菌。已有研究表明,摄食功能性多糖可改变瘤胃菌群多样性和相对丰度。金鹿等[19]研究发现,沙蒿多糖组合制剂可改变滩羊瘤胃菌群结构,提高Chao1指数、Shannon指数和Simpson指数,增加了瘤胃菌群的多样性和丰富度,有利于促进瘤胃健康。与上述试验结果相似,本试验发现,饲粮添加400 mg/kg BW的FWBPs显著提高了肉羊瘤胃菌群Shannon指数和Simpson指数;在门水平上,饲粮添加200 mg/kg BW的FWBPs可增加瘤胃菌群中Spirochaetota的相对丰度;添加400 mg/kg BW的FWBPs可增加瘤胃菌群中Bacteroidota的相对丰度,并降低Proteobacteria的相对丰度。此外,高剂量组瘤胃菌群中Proteobacteria和Spirochaetota的相对丰度显著低于低剂量组,而Bacteroidota的相对丰度显著高于低剂量组。与本试验结果相似,在荞麦秸秆饲粮中添加甘露寡糖可提高滩羊瘤胃菌群中Bacteroidota和厚壁菌门(Firmicutes)的相对丰度,降低Proteobacteria的相对丰度[20]。Han等[21]研究显示,高精料饲粮会导致瘤胃中放线菌门(Actinobacteriota)和Proteobacteria的相对丰度增加,而Bacteroidota的相对丰度下降。Proteobacteria中的含有很多产脂多糖的革兰氏阴性菌,其相对丰度的增加会导致脂多糖增加,破坏瘤胃屏障,诱发瘤胃炎症[14]。Bacteroidota基因组中含有较多编码糖苷水解酶和多糖裂解酶的基因,这2类酶能降解纤维类物质[22]。基于上述研究推测,饲粮添加400 mg/kg BW的FWBPs可能通过增加Bacteroidota的相对丰度和降低Proteobacteria的相对丰度来提高纤维物质的消化和减少脂多糖释放,进而改善瘤胃健康状况。在属水平上,与对照组相比,低剂量组瘤胃菌群中Succinivibrio的相对丰度增加;而高剂量组瘤胃菌群中Selenomonas的相对丰度增加,Succinivibrionaceae_UCG-001和Succiniclasticum的相对丰度减少。高剂量组瘤胃菌群中Veillonellaceae_UCG-001和Selenomonas的相对丰度高于低剂量组,而Succinivibrionaceae_UCG-001的相对丰度低于低剂量组。与本研究结果不同,甘露寡糖可增加滩羊瘤胃菌群中普氏菌属_1(Prevotella_1)、理研菌科_RC9_肠道群(Rikenellaceae_RC9_gut_group)和Succiniclasticum的相对丰度,这可能是由于添加多糖种类或羊品种不同导致的[20]。
LEfSe分析的结果也显示,Succiniclasticum在对照组中富集;Succinivibrionaceae、Proteobacteria和Succinivibrionaceae_UCG-001在低剂量组中富集;Bacteroidota、Prevotella_ruminicola、Selenomonas、Selenomonas_ruminantium、Veillonellaceae_UCG-001在高剂量组中富集。Succiniclasticum主要以淀粉为发酵底物,也能发酵纤维或纤维二糖,主要代谢产物是琥珀酸和乙酸[23]。本试验所用基础饲粮中玉米(含70%淀粉)比例较高,会促使Succiniclasticum大量繁殖,使其成为对照组中的标志物种。Succinivibrionaceae_UCG-001可以发酵多种糖类,主要的代谢终产物是乙酸、琥珀酸和乳酸[24]。当给反刍动物饲喂大量可发酵的碳水化合物时,瘤胃中通过糖酵解生成乳酸的速率远大于其被利用的速率,导致乳酸积累,瘤胃pH急速下降,造成酸中毒。因此,低剂量组肉羊瘤胃菌群中Succinivibrionaceae_UCG-001的相对丰度增加可能会造成乳酸积累,且Proteobacteria的相对丰度增加也可能会造成脂多糖的大量生成,损伤瘤胃。研究发现,活性干酵母可以通过降低荷斯坦奶牛瘤胃中Succinivibrionaceae_UCG-001的相对丰度,进而减少高精料条件下瘤胃乳酸的产生量,维持瘤胃pH的稳定[25]。Bacteroidota中的Prevotella_ruminicola是一种降解菌,在蛋白质、淀粉、木聚糖和果胶的降解过程中发挥着重要作用[26-27],其相对丰度的增加有利于提高肉羊对营养物质的消化。Selenomonas中的Selenomonas_ruminantium是瘤胃中非常重要的一种乳酸利用菌,其比例的提高有利于减低瘤胃乳酸累积,稳定瘤胃pH[28]。Veillonellaceae_UCG-001也是一种乳酸利用菌,可以发酵乳酸、丙酮酸、延胡索酸、L-苹果酸,但不能发酵糖类物质[26]。有学者认为瘤胃微生物区系紊乱和乳酸代谢菌菌群比例失衡是导致瘤胃中乳酸积累,诱发瘤胃酸中毒的直接原因[29]。本试验中,高剂量组肉羊瘤胃菌群中Veillonellaceae_UCG-001和Selenomonas的相对丰度增加,这有利于减少乳酸积累,稳定瘤胃pH。本课题组前期研究结果也显示,饲粮添加400 mg/kg BW的FWBPs可稳定肉羊瘤胃pH,瘤胃总挥发性脂肪酸含量较对照组减少了19%[11]。基于上述结果推测,饲粮添加400 mg/kg BW的FWBPs可能通过调控杜寒杂交肉羊瘤胃中乳酸产生菌(Succinivibrionaceae_UCG-001)和乳酸利用菌(Veillonellaceae_UCG-001和Selenomonas)的相对丰度,减少乳酸累积,稳定瘤胃pH,改善瘤胃健康状况。
4 结 论
① 饲粮添加200和400 mg/kg BW的FWBPs均能提高杜寒杂交肉羊瘤胃组织中紧密连接蛋白(occludin、claudin-1、claudin-4)的mRNA相对表达量,添加400 mg/kg BW的FWBPs可提高细胞因子(IFN-γ和IL-6)的mRNA相对表达量。
② 饲粮添加FWBPs可影响瘤胃菌群中Succinivibrio、Selenomonas、Veillonellaceae_UCG-001、Succinivibrionaceae_UCG-001和Succiniclasticum的相对丰度。
③ 综上所述,FWBPs能够提高杜寒杂交肉羊瘤胃组织中紧密连接蛋白和细胞因子的mRNA相对表达量,调控瘤胃菌群结构,有利于维持瘤胃健康。
