核糖体装配因子WD重复结构域74在恶性肿瘤中的研究进展△
2022-02-19刘俏君邱飞郑丽萍李玉梅
刘俏君,邱飞,郑丽萍,李玉梅
赣南医学院1基础医学院,2康复学院,4基础医学院生物化学与分子生物学教研室,江西 赣州 341000 3福建省儿童医院药剂科,福州 350000
恶性肿瘤是威胁人类生命健康的重大疾病,也是造成人类死亡的主要原因之一。2020年全球新发恶性肿瘤病例1929万例,其中中国新发恶性肿瘤病例457万例,占全球的23.7%,2020年全球恶性肿瘤死亡病例996万例,其中中国恶性肿瘤死亡病例300万例,占全球的30.1%[1]。中国恶性肿瘤新发病例和死亡病例均居全球首位,疾病负担沉重。恶性肿瘤发病隐匿、疾病进展迅速导致患者确诊时间晚、难治愈且预后极差。寻找有效的诊疗靶点对恶性肿瘤的早期诊断和开发新型靶向药物以降低患者病死率至关重要。
核糖体是细胞内进行蛋白质合成的细胞器。核糖体生成指的是合成新核糖体的过程,决定着蛋白质的合成速率[2]。肿瘤发生发展过程中最显著的特征是肿瘤细胞不受控制地增殖和转移,其重要基础在于核糖体生成增强了细胞内蛋白质合成水平,以提供维持肿瘤细胞生长和转移的物质基础[3-4]。研究表明,核糖体生成对肿瘤的发生发展十分关键,核糖体生成受阻引发的核仁应激可显著阻滞肿瘤细胞活跃的增殖行为[5]。许多核糖体生成因子也被发现在肿瘤细胞的增殖、凋亡、侵袭和耐药性等多种生物过程中发挥关键作用[6-8]。
WD重复结构域 74(WD repeat domain 74,WDR74)是真核细胞中重要的核糖体装配因子,其通过参与前体核糖体RNA(ribosomal RNA,rRNA)的加工过程影响核糖体大亚基的组装,最终介导细胞内蛋白质的合成[9]。研究发现,WDR74在人类肿瘤中广泛表达,并且在多种肿瘤组织中异常表达。WDR74可通过激活多种癌基因和失活多种抑癌基因促进肿瘤的发生发展,与肿瘤患者的预后显著相关,提示WDR74是潜在的肿瘤诊疗靶点。本文就WDR74的生物学功能及其在肿瘤中的作用进行综述,以评估其作为生物标志物和分子靶点的可行性。
1 WDR74的结构
人类WDR74基因位于染色体11q12.3上,包含15个外显子,其编码的WDR74蛋白由385个氨基酸组成,分子量为42 441 Da。WDR74是WD40重复结构域蛋白超家族中的一员,包含6个WD40区域,且在进化上高度保守。WDR74包含两个功能结构,分别为N末端的6个可与其他蛋白质相互作用的WDR结构域和C末端的富含赖氨酸的区域。WDR结构域是人类蛋白质组中最丰富的蛋白质相互作用结构域之一。WDR结构域具有典型的7个叶片的β-螺旋桨域,呈现类似包含中心孔的“车轮状结构”。研究表明,WDR74蛋白结构的中心孔结构域是一个良好的“结合口袋”,可以介导与其他蛋白质相互作用,发挥广泛的生物学功能[10]。WDR74的WDR结构域中包含一簇保守的氨基酸残基序列可与核VCP样蛋白2(nuclear VCP-like 2,NVL2)的D1 AAA域相互结合,参与核糖体生成过程(图1)。WDR74蛋白的C末端含有大量赖氨酸残基,对于WDR74蛋白的细胞核仁定位具有重要作用[11]。
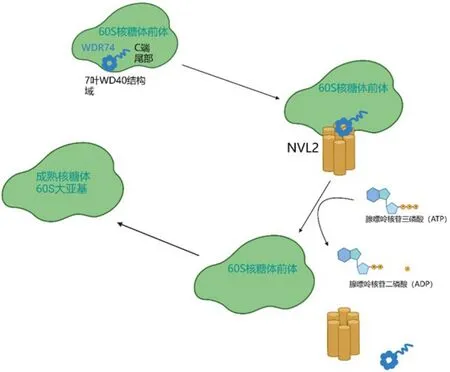
图1 WDR74参与核糖体60S大亚基合成的示意图
2 WDR74的生物学功能
WDR蛋白超家族广泛参与多种信号通路,包括DNA损伤修复、蛋白质合成和降解、细胞周期、基因表达、表观遗传调控以及免疫系统调节等[10]。WDR74作为WDR蛋白超家族成员,其功能主要集中在以下几个方面。
2.1 WDR74参与rRNA加工和核糖体大亚基的生成
真核生物的核糖体由40S小亚基和60S大亚基组装形成,核糖体亚基由rRNA和一系列核糖体蛋白共同组成。核糖体生成是细胞内十分复杂且精细运作的过程,包括rRNA的转录、修饰、折叠、加工以及核糖体蛋白的加工与组装等步骤,超过两百多种组装因子参与其中[12]。核糖体生成从核仁中由单个的前核糖体RNA(precursor ribosomal RNA,pre-rRNA)(在人类中是47S pre-rRNA)转录开始,经过多种修饰后产生18S、5.8S和28S的成熟rRNA[13-14]。在pre-rRNA加工途径中,外部转录间隔区(external transcribed spacer,ETS)和内部转录间隔区(internal transcribed spacer,ITS)序列通过一系列有序的内切割和外切割步骤从47S pre-rRNA中移除[9]。在核仁中,pre-rRNA通过与许多核糖体蛋白结合形成90S前核糖体颗粒,然后转化为一系列的40S和60S前体颗粒,最后在核质中进行一系列组装并被运送到细胞质中生成成熟的核糖体60S和40S亚基。其中MTR4(一种已知的RNA解旋酶和外泌体辅助因子)可以在细胞核内协助核酸外切体发挥DExD/H-box RNA解旋酶活性,参与各种RNA(包括pre-rRNA)的加工或降解过程。在核糖体生成过程中,WDR74参与了pre-rRNA加工早期阶段中ITS1的剪切步骤,但关于WDR74如何参与ITS1的切割目前尚不明确,主要有几种猜想。一种是认为WDR74可能直接参与了ITS1的切割反应,而与MTR4的相互作用无关,但还未找到证据证实这种猜想。另一种则认为WDR74可能通过调节5'ETS的加工来影响ITS1的切割。在小鼠细胞中,5'ETS的加工影响了ITS1的选择性切割[15],这与人类细胞中WDR74缺失引起36S异常中间体产生的现象相符合。WDR74还在pre-rRNA的加工途径中调节核酸外切体的活性。在核糖体前颗粒达到成熟途径中的特定步骤前,WDR74与MTR4-核酸外切体的结合限制了其加工活性。只有NVL2水解腺苷三磷酸(adenosine triphosphate,ATP)时使WDR74从复合物中释放,12S pre-rRNA 3'端开始的加工反应才启动,从复合体中释放的WDR74返回到加工途径的早期阶段并参与此阶段中ITS1的剪切步骤(图2)。总而言之,WDR74缺失将严重影响核糖体大亚基的成熟,导致组装中间体积累,从而产生大量无活性的核糖体,最终影响生命活动的正常进行[16]。
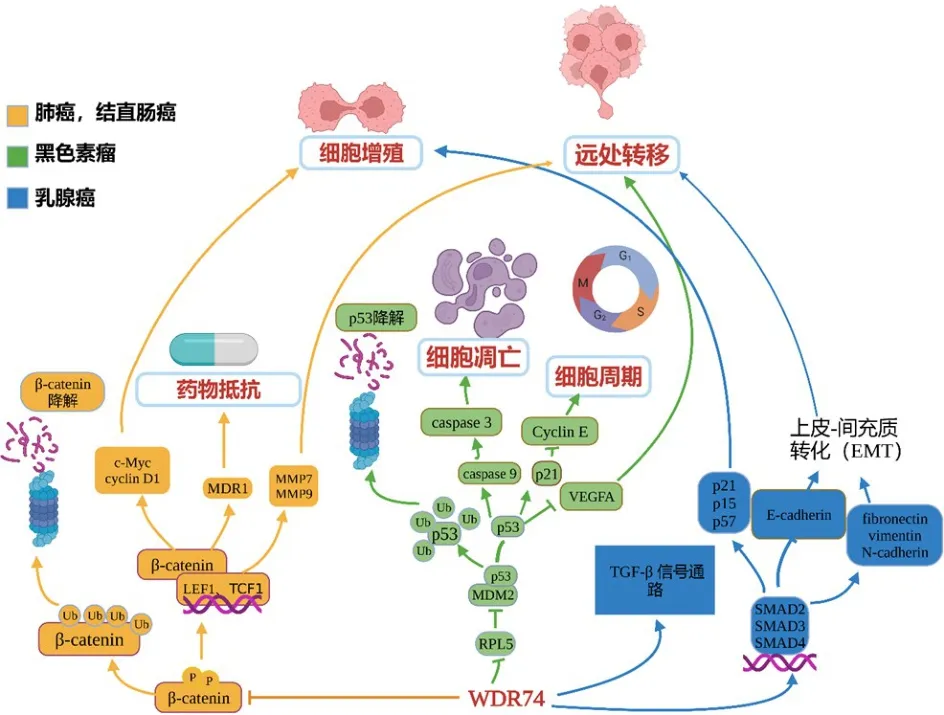
图2 WDR74参与多种肿瘤发生发展的信号通路图
2.2 WDR74对囊胚形成的影响
WDR74是小鼠着床前发育过程中RNA转录、加工或稳定所必需的基因,对囊胚的形成具有重要影响。卵母细胞受精后,从输卵管迁移到子宫中,胚胎在子宫内膜上植入。从受精卵到胚胎植入子宫内膜期间有几个关键事件,对胚胎的发育起着重要作用。例如,胚胎合子基因激活、胚胎致密化、胚胎内细胞团和滋养层细胞形成以及胚胎内细胞团分化为原始内胚层和原始外胚层[17]。WDR74作为RNA聚合酶复合体的重要组成部分在囊胚形成中发挥着重要作用。WDR74缺失导致细胞总RNA水平降低和转录水平受限,从而影响胚胎正常发育,不能形成囊胚也不能正确分化形成内细胞团和滋养层细胞。这个过程中细胞周期的异常变化还可导致p53基因及其下游基因激活,从而导致细胞凋亡[18]。
2.3 WDR74调节转化生长因子-β(transforming growth factor-β,TGF-β)信号通路
TGF-β是在细胞中广泛存在的一种细胞因子,不仅可调控细胞生长、凋亡、分化和迁移等过程,还参与了炎症反应和肿瘤的发生发展过程。经典的TGF-β信号通路起始于细胞外配体和细胞膜上受体的结合,进而将细胞外信号传递给细胞质内的效应蛋白SMAD。被激活的SMAD蛋白形成三元复合体进入细胞核与DNA起始转录区结合,从而促进下游基因的转录。经典的TGF-β信号通路调控的细胞过程包括抑制细胞生长、促进细胞凋亡、促进上皮-间充质转化等。刘锦泉[19]的研究发现,WDR74的C端功能域可与SMAD蛋白的MH2区域相互作用,对SMAD发挥多种作用,包括促进SMAD2和SMAD3的磷酸化、抑制SMAD2和SMAD3的去磷酸化、促进SMAD2-SMAD3-SMAD4复合物形成和入核,还可通过促进SMAD蛋白和转录因子结合共同调控下游基因的转录,从而促进TGF-β诱导的下游基因蛋白水平的表达。TGF-β在肿瘤微环境中具有双重作用,在早期肿瘤中,TGF-β可诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖,而在肿瘤晚期,TGF-β通过调节基因组不稳定性、上皮-间充质转化、肿瘤新生血管生成、免疫逃逸、细胞运动和转移等过程促进肿瘤进展[20]。刘锦泉[19]的研究还发现,WDR74可以通过TGF-β诱导p21、p57、p15表达并抑制原癌基因表达,使细胞停留在G1期从而抑制细胞增殖,促进细胞凋亡。在肿瘤晚期,WDR74可通过调节TGF-β上调SMAD2和SMAD3的表达,促进上皮-间充质转化,进而促进肿瘤细胞转移,导致肿瘤恶化。
3 WDR74与肿瘤
WDR74最初被发现与犬乳腺癌细胞的肺转移有关[21]。研究表明,WDR74的5'侧翼区域和启动子区域在肿瘤中频繁突变,可能与多种肿瘤的预后较差有关[22-23]。WDR74在多种人类肿瘤中高表达,不利于肿瘤患者的预后。在WDR74高表达的肿瘤细胞中,CD8+T细胞和成纤维细胞的浸润水平增加,可能促进肿瘤的发生、发展和转移[24]。肿瘤的发生发展是一个复杂的、多因素共同作用的结果。
3.1 WDR74与肺癌
肺癌是中国最常见的恶性肿瘤,发病率和病死率均居第一位[1]。大多数原发性肺癌可以通过手术切除和化疗治愈[25]。但目前超过55%的肺癌患者首次发现即被诊断为伴随转移的晚期,此时手术切除和化疗几乎无法治愈,患者的5年生存率仅为5%[25-26]。研究表明,WDR74有望成为诊断肺癌的肿瘤标志物,通过对癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库的检索发现,与正常肺组织相比,WDR74在肺腺癌组织中的表达显著上调,在肺鳞状细胞癌组织中略有上调。通过分析发现,WDR74表达水平随着肺癌的发生和转移逐渐升高,这预示着WDR74可能成为判断肺癌发生发展的生物标志物。Kaplan-Meier生存分析结果显示,WDR74高表达与肺癌患者的预后不良有关,WDR74高表达与肺鳞状细胞癌患者的预后不良有关,而与肺腺癌患者的预后无关。这预示着WDR74可成为评估肺鳞状细胞癌患者预后的分子标志物。WDR74缺失后,肺癌细胞的体外和体内增殖能力和转移能力均显著下降,并且对抗肿瘤药物多柔比星的耐药性也显著降低。另外,通过分子机制研究发现,WDR74缺失可导致肺癌细胞的细胞质中β-联蛋白(β-catenin)含量显著减少,同时β-catenin在细胞核中的含量显著增加,进而造成β-catenin蛋白降解增加,下游靶基因c-Myc、细胞周期蛋白D1(cyclin D1)、基质金属蛋白酶7(matrix metallopeptidase 7,MMP7)、基质金属蛋白酶9(matrix metallopeptidase 9,MMP9)和多重耐药蛋白 1(multidrug resistance 1,MDR1)等的表达减少。表明WDR74可通过招募β-catenin入核减少其降解,从而激活经典WNT信号通路,促进下游靶基因的表达,参与肺癌的发生和发展[27]。
3.2 WDR74与黑色素瘤
黑色素瘤是最常见和病死率最高的皮肤肿瘤[28],最常见于白种人中,而在黄种人和黑种人中发病率较低。中国每年约有2万例新增黑色素瘤患者,发病率仍在上升。黑色素瘤极易发生转移,甚至在尚未见原发病灶时即可发生远处转移,这导致即使经手术切除后的患者也难逃因肿瘤细胞转移导致的肿瘤复发和最终死亡的命运[29]。Lim和Lee[30]研究发现,WDR74突变可能与黑色素瘤的侵袭和转移能力有关。研究发现,WDR74在黑色素瘤中高表达且与黑色素瘤的恶性程度呈正相关;WDR74可提高黑色素瘤细胞的增殖、克隆、抗凋亡、侵袭、迁移能力;免疫共沉淀和体内泛素化实验共同发现,敲除WDR74基因后可抑制p53蛋白与小鼠双微体 2(mouse double minute 2,MDM2)蛋白结合,降低p53的泛素化水平,最终导致细胞内p53蛋白表达水平升高,p53信号激活,p21、胱天蛋白酶(caspase)3和caspase 9表达增加,细胞周期蛋白E(cyclin E)和血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)表达降低[31]。总的来说,WDR74激活核糖体蛋白L5(ribosomal protein L5,RPL5)-MDM2-p53信号通路在黑色素瘤中发挥重要作用。
3.3 WDR74与结直肠癌(colorectal cancer,CRC)
CRC是中国最常见的胃肠道肿瘤之一,近年来中国CRC的发病率和病死率均逐渐上升,晚期CRC患者的5年生存率不足10%[32-33]。研究发现,结肠癌细胞系HT29、HCT116、SW48和 HCT15中WDR74mRNA和WDR74蛋白表达水平均显著上调。WDR74在CRC中具有显著的促癌活性,且与在肺癌中的作用机制类似,均是通过促进β-catenin从细胞质向细胞核移位,抑制β-catenin蛋白降解,从而导致细胞内β-catenin水平增加,最终促进下游靶基因c-Myc、cyclin D1、淋巴增强因子 1(lymphoid enhancer binding factor 1,LEF1)和转录因子1(transcription factor 1,TCF1)的表达,促进肿瘤细胞生长和转移,这些结果显示WDR74可作为CRC潜在的治疗靶点[34]。
3.4 WDR74与其他肿瘤
有研究发现,WDR74的非编码区突变在尿路上皮膀胱癌中所占比例为17.2%,并且可能被证明是诊断膀胱癌的有价值的生物标志物[35]。还有研究发现,WDR74突变在乳腺癌中增加[36]。WDR74还与其他疾病相关,WDR74可以通过激活TGF-β/SMAD信号通路促进M2型巨噬细胞极化,从而促进小鼠的糖尿病足溃疡伤口愈合[37]。
4 WDR74应用于肿瘤靶向治疗的巨大潜力
WDR74与人类肿瘤的发生发展有着密切关系,它可以通过破坏多种癌基因和抑癌基因的平衡以及调节多种信号通路促进多种肿瘤进展,WDR74可能是潜在的肿瘤治疗靶点。从WDR74的生物学功能出发,WDR74作为真核细胞中重要的核糖体装配因子对核糖体的成熟至关重要[16]。肿瘤细胞最显著和最广泛的特征是无限增殖,而这依赖于核糖体中蛋白质的合成[38]。通过靶向WDR74破坏核糖体生成,使蛋白质合成受限可能可以作为抑制肿瘤细胞增殖、遏制肿瘤恶化的有效策略。WDR74在生物体生命活动中的重要作用是WDR74可能成为有效的、广谱的肿瘤治疗靶点的理论基础。目前有关WDR74的功能研究以及WDR74与肿瘤发生发展关系的研究仍然较少,因此应深入研究WDR74的生物学功能和其与肿瘤发生发展的关系。
更重要的是,WDR74蛋白的WDR结构域中的中心孔区域存在许多可以与蛋白质、肽、RNA、DNA结合的位点,可作为一个优越的药物结合口袋,这为靶向药物的稳定结合提供了重要的结构基础。WDR结构域的靶向药物还可以诱导WDR结构域发生构象变化,使其从不可成药状态变为可成药状态,提示在通过计算机分子对接的方法筛选WDR74结构域靶向药物时,不应该因为药物表面上缺乏与WDR74相互作用而彻底放弃这种药物。通过成药性算法预测WDR结构域的侧链也可以成为药物作用靶点,同时侧链有可能通过影响中心孔的构象抑制中心孔的功能[39]。
通过CTD在线网站探索WDR74与现有的化学物质相互作用的信息后,发现很多化学物质可以影响WDR74的表达水平或WDR74蛋白的修饰(图3)。其中有12种化学物质可以促进WDR74的表达,肿瘤患者或肿瘤高危人群应该尽量避免接触或使用这12种化学物质。另外有15种能够抑制WDR74的化学物质,包括维A酸、伊维菌素、地塞米松等。但在开发药物时不能只考虑药物对WDR74的抑制效果,还应考虑药物对患者的综合影响。另外,在临床治疗中需要进一步探究WDR74过表达的肿瘤患者是否可以从WDR74抑制剂中受益,具体药物的药理机制和毒理作用也应得到进一步的验证。有3种化学物质,双酚A、丙戊酸、氯化铜对WDR74的影响还不明确,可继续进行探究得出可靠的结论。还有一种化学物质TAK-243可以影响WDR74的小类泛素化修饰肽(small ubiquitin-like modifier,SUMO)蛋白修饰。提示可以从WDR74的蛋白修饰为切入点开发抑制WDR74功能的药物。
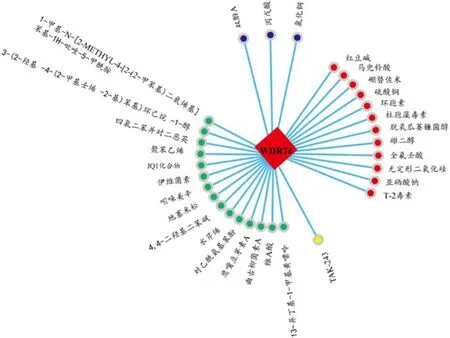
图3 与WDR74相互作用的化学物质
目前已经开发出针对WDR结构域家族蛋白的靶向药物,虽然这不意味着对WDR74也有抑制作用,但可在此基础上积极探索是否存在亲和力高、专一性针对WDR74的小分子抑制剂,以此减少药物脱靶带来的不良反应。
5 小结
综上所述,WDR74在多种肿瘤细胞和正常细胞间表达水平的显著差异使其有望成为诊断肿瘤的生物标志物。基于WDR74的生物学功能,进一步探究WDR74在人类肿瘤中的作用及作用机制十分必要。WDR74蛋白结构域中良好的药物结合口袋也使其在肿瘤靶向药物开发中具有良好的应用前景。总之,WDR74作为一种潜在的肿瘤诊疗靶点,对其进行深入研究对临床肿瘤诊疗具有积极意义。
