高迁移率族蛋白B1单抗对大鼠脑出血术后脑水肿的作用研究
2022-02-19曾以勒蔡圣煜蔡风景
曾以勒,蔡圣煜,蔡风景
脑出血是由多种原因导致脑血管破裂而引起的脑实质出血,属于临床常见病、多发病[1]。而脑水肿作为脑出血后必出现的病理生理过程,为非独立疾病,其临床表现多变,是导致颅内压增高、脑疝、脑循环障碍、神经元坏死等脑出血后二次脑损伤的最重要原因[2-3]。有研究指出,脑出血术中清除血肿、减少血肿的占位效应对改善颅内压具有重要意义,但术后血肿周围组织存在明显水肿,而血肿周围组织水肿及其继发性神经元损伤可严重威胁患者预后,因此对脑出血术后脑水肿的多视角、全方位的研究成为近年临床研究的热点[4-5]。近年随着临床研究的深入,发现炎性反应在脑出血术后脑水肿中仍发挥着主导作用,而高迁移率族蛋白B1(HMGB1)或参与了脑卒中早期炎症病理过程。动物实验表明,细胞外HMGB1在激活小胶质细胞、促进神经炎症中具有重要作用[6-7]。基于此,本研究采用HMGB1单抗处理的大鼠脑出血手术模型,用以明确HMGB1对脑出血术后炎症水肿的抑制作用,以期为HMGB1抑制剂治疗脑水肿提供科学依据。
1 材料与方法
1.1 实验动物 选取健康雄性成年SD大鼠40只,体质量210~262(236±22)g,由福建医科大学提供,实验动物许可证号:SYXK(闽)2020-0005。饲养环境:温度为(23±2)℃下,相对湿度为42%~50%,12 h明暗循环,自由饮食和饮水。实验动物处置严格遵守实验动物管理与保护的有关规定,本实验内容经福建医科大学附属第二医院动物伦理委员会审核批准。
1.2 主要试剂及仪器 CT(西门子双源CT),酶标仪(型号iMark,Bio-RAD公司生产),HMGB1 ELISA试剂盒(日本SHINO. TEST公司生产),白介素6(IL-6)、肿瘤坏死因子α(TNF-α)ELISA试剂盒(R&D Systems,Minneapolis公司生产)。
1.3 动物模型建立与治疗
1.3.1 脑出血术后脑血肿模型建立 将40只健康雄性成年SD大鼠进行处理,采用改良Miller法建立脑出血术后脑血肿大鼠模型,具体步骤为:在有机玻璃容器内使用3%异氟烷进行诱导麻醉,麻醉成功后改用2%异氟烷0.6 L/min维持麻醉,而后以聚乙烯导管对大鼠右侧股动脉和静脉进行插管,以进行血压监测,采血;使用加热毯维持大鼠体温为(37.0±0.2)℃,同时使用生理监测仪监测其呼吸频率,维持动脉血二氧化碳分压(PaCO2)为35~41 mmHg(1 mmHg=0.133 kPa);使用动物立体定向仪架上固定大鼠头部,剃毛后沿正中线切开头皮,在冠状缝前2 mm、右侧中线旁开5 mm处右侧钻一直径为1 mm的骨孔,在显微镜下借助高速牙科钻切开硬膜,将针头刺入脑皮质下约5 mm,自股静脉内抽取不含肝素的静脉血50 μl,用微量注射泵缓慢注入脑内,速度50 μl/min,注射完毕后,用骨蜡封闭骨孔,持续监测大鼠血压并观察其呼吸情况。2 h后去除骨蜡,借助高速牙科钻将原骨孔扩大至5 mm,切开硬膜,沿原皮质穿刺点撑开,彻底清除脑血肿,反复冲水确认血肿腔无出血,缝合硬膜,骨孔用骨蜡封闭,缝合头皮。术后24 h,行颅脑CT检查,若术区无明显高密度即为建模成功。
1.3.2 分组及处理 将40只大鼠分为实验组和对照组,各20只,分别于术后48、96、144 h对2组大鼠进行腹腔注药,其中实验组给予HMGB1单抗200 μg/只,对照组仅给予等体积0.9%氯化钠溶液。
1.4 观察指标
1.4.1 脑水肿体积测定 分别于术后72、120、168 h将2组大鼠麻醉制动后进行颅脑CT薄层三维扫描,厚度为2 mm,采用PACS系统三维测量方法并使用多田公式计算大鼠脑水肿体积,脑水肿体积=病灶体积-血肿体积。
1.4.2 HMGB1、IL-6、TNF-α水平测定 分别于术后72、120、168 h抽取大鼠静脉血3 ml,3 h内高速离心15 min,分离上清;采用双抗体夹心ELISA测定血清HMGB1、IL-6、TNF-α水平,设置酶标板空白孔、标准孔、待测样品孔,依次加入50 μl/孔的样品稀释液、标准品、待测样片液,混匀,覆膜,室温孵育;而后弃孔内液体,甩干,清洗反应板。加入ANCA检测液100 μl/孔,覆膜,常温孵育60 min,弃液体,甩干,洗涤反应板,加入100 μl/孔的底物溶液,遮光显色0.5 h,加入终止液,轻弹酶标板终止反应;酶标仪450 nm处测定吸光值,由高资历的检验科医生严格遵循试剂盒说明书进行操作。
1.4.3 水通道蛋白4(AQP-4)和基质金属蛋白酶9(MMP-9)表达水平测定 采用断头法处死大鼠,平行正中线剖开大鼠脑血肿处的组织,留取血肿腔周边脑组织做连续冠状冰冻切片,置于4%多聚甲醛中浸泡固定,24 h后脱水处理,石蜡包埋,切成4 μm的切片,使用枸橼酸钠抗原修复液微波修复10 min,焖30 min后室温晾凉;使用疏水笔描绘样品分布轮廓,将玻片置于湿盒内,滴加适量0.3% Triton,恒温孵育20 min,PBST重复洗涤,再滴加3% H2O2溶液于玻片上,室温避光孵育30 min,PBST重复洗涤,再滴加3% BSA均匀覆盖组织,37 ℃环境下封闭30 min,轻甩封闭液(勿洗),于玻片上滴加一抗(Aqp4∶PBS为1∶200),平放于湿盒内4 ℃孵育2 d(保湿盒内加少量水,防止抗体蒸发),PBST重复洗涤,滴加二抗[Fluorescein(FITC)-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)∶PBS为1∶200],37 ℃环境下避光孵育60 min,PBST重复洗涤,晾干,抗荧光衰减封片剂封片。(1)AQP-4表达水平测定:取大鼠待测血肿周边组织切片,采用免疫组化染色二步法测定AQP-4表达水平,具体步骤:常规脱蜡水化,3% H2O2室温下孵育10 min,阻断内源性过氧化物酶,将切片浸入0.01 mol/L枸橼酸缓冲液进行抗原修复,封闭非特异性抗原结合位点,滴加兔抗大鼠AQP-4抗体(浓度为1∶100),室温湿盒孵育1.5 h,阴性对照组滴加PBS,其余步骤同前。生物素标记的羊抗兔IgG工作液,室温孵育30 min;DAB显色5 min,显色后光镜观察。采用Motic Med 6.0数码医学图像分析系统(北京麦克奥迪图像技术有限公司生产)对染色深浅程度进行定量分析,以细胞平均吸光度(A)值表示AQP-4阳性表达的强弱。(2)MMP-9表达水平测定:取大鼠待测血肿周边组织切片,利用免疫组化SABC法测定MMP-9表达水平,具体步骤:将石蜡切片脱水、PBS漂洗、3% H2O2与甲醇混合液浸泡10 min,超纯水漂洗、抗原、修复、PBS漂洗后,加入一抗,常温孵育2 h,PBS漂洗5 min,加入二抗,常温孵育40 min,PBS漂洗5 min,DAB室温显色20~30 min,清洗、封片,光镜下观察细胞中MMP-9表达情况。采用DAKO公司的试剂盒进行操作。采用Kontron IBAS 2.5全自动图象分析系统观察MMP-9阳性反应产物灰度级和面积、测试区域的灰度级和背景面积。

2 结 果
2.1 脑水肿体积比较 术后72 h对照组与实验组大鼠脑水肿体积比较,差异无统计学意义(P>0.05);术后120、168 h,实验组大鼠脑水肿体积小于对照组(P<0.01),见表1。

表1 对照组与实验组大鼠术后不同时点脑水肿体积比较
2.2 血清HMGB1、IL-6、TNF-α水平比较 术后72 h对照组与实验组大鼠血清HMGB1、IL-6、TNF-α水平比较,差异无统计学意义(P>0.05);术后120、168 h,实验组大鼠血清HMGB1、IL-6、TNF-α水平均低于对照组(P<0.01),见表2。
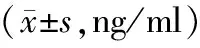
表2 对照组与实验组术后不同时间血清HMGB1、IL-6、TNF-α水平比较
2.3 脑组织AQP-4、MMP-9表达水平比较 术后72、120、168 h,实验组大鼠脑组织AQP-4、MMP-9表达水平低于对照组(P<0.01),见表3。
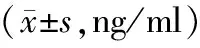
表3 对照组与实验组大鼠术后不同时间脑组织AQP-4、MMP-9表达水平比较
3 讨 论
脑水肿是不同致病因素共同作用促使脑组织中水分异常增多的病理状态,血—脑脊液屏障受损、缺血缺氧、血肿分解释放出多种有毒活性物质、炎性因子等均参与了脑水肿的形成[8-9]。手术作为血肿清除的有效手段,可有效解决因血肿机械性压迫及后期血肿液化吸收所产生的损伤,由此认定血—脑脊液屏障受损及炎性反应在脑出血术后脑水肿演变过程中发挥着主导作用[10]。
研究指出,脑出血发病早期,血肿周围存在活化小胶质细胞浸润及大量中性粒细胞和巨噬细胞聚集,通过释放多种炎性因子引发炎性反应[11]。炎性因子在炎性反应中具有重要作用,而核因子κB通路参与多个炎性因子的表达,脑出血后聚集的炎性因子,如肿瘤坏死因子及白介素可诱导核因子κB活化,通过调控、活化核因子κB转录,而增加炎性因子产生及释放增多,致使炎症加重,从而介导脑损伤[12-13]。研究指出,另外各类炎性因子间存在线性依存关系,相互反应、促进,对诱导炎症发生、加重脑损伤具有促进作用[14]。相关研究证实,IL-6、TNF-α在脑水肿患者中存在异常表达,通过药物干预可有效降低其水平,减轻脑水肿损伤[15]。本研究结果显示,对脑出血术后脑水肿大鼠给予HMGB1单抗处理的实验组血清TNF-α、IL-6水平低于仅给予0.9%氯化钠溶液处理的对照组,术后120、168 h实验组大鼠脑水肿体积小于对照组,证实HMGB1单抗可通过降低炎性因子水平而减轻脑出血大鼠术后脑水肿损伤。
本研究通过分析AQP-4、MMP-9在脑出血术后脑水肿演变过程中存在异常表达,推测AQP-4、MMP-9在脑出血术后脑水肿演变过程中的作用机制。研究指出,AQP-4是大脑水代谢及中枢神经系统水平衡的重要调节因子,其作为一种介导细胞内外水转运的膜蛋白,在星形胶质细胞表面呈高表达,与脑水肿形成及消除存在密切关联;而MMP-9在中枢神经系统中发挥主要作用,当脑出血发生后血—脑脊液屏障功能受损,诱发脑水肿[16]。动物实验表明,AQP-4降低后,大鼠脑水肿得以改善,而MMP-9的激活及高表达则会对血管结构的完整性造成破坏,加重血管源性水肿,甚至引发再出血[17]。本研究结果显示,实验组大鼠脑组织AQP-4、MMP-9表达水平低于对照组,提示HMGB1单抗对调节AQP-4、MMP-9表达,稳定血—脑脊液屏障结构,减轻继发性脑损伤具有重要意义,是脑出血后防治血管源性水肿发生发展的一个新的潜在治疗靶点。
综上所述,HMGB1单抗可有效控制脑出血术后大鼠脑水肿,抑制机体炎性反应,调控AQP-4、MMP-9表达,进而减轻脑损伤,进一步证实了HMGB1在脑出血后脑水肿发生发展中具有重要作用,通过降低其表达水平、抑制其功能或有效抑制脑水肿进展,可有效减轻炎症水肿所致的二次脑损伤,改善预后。
利益冲突:所有作者声明无利益冲突。
