肝细胞特异性Sirt1缺失加重小鼠肝脏炎性反应
2022-02-19杨佳卉解相宏李春美刘晓军
杨佳卉,赵 微,解相宏,李春美,刘晓军,姚 红*
(1.山西医科大学 基础医学院 微生物学与免疫学教研室, 山西 太原 030001; 2.中国医学科学院基础医学研究所北京协和医学院基础学院 医学分子生物学国点重点实验室, 北京 100005)
沉默信息调节因子1 (Sirtuin type 1, Sirt1)是一种在肝脏等代谢组织中高水平表达的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的III型组蛋白脱乙酰酶和单ADP核糖基转移酶,Sirt1可使组蛋白(H1、H3、H4)和非组蛋白脱乙酰化,广泛参与机体的代谢、衰老、转录、DNA损伤修复、细胞凋亡、细胞周期调控、炎性反应和肿瘤等多种生理和病理过程[2]。在肝脏中,Sirt1也参与众多细胞生理功能, 包括肝脏葡萄糖和脂肪酸代谢、线粒体功能、肝糖异生等,对于葡萄糖、脂质和胆固醇稳态是至关重要的[1]。为了探究肝细胞特异性Sirt1缺失在肝脏炎性反应中的作用,选取了肝特异性Sirt1敲除小鼠进行研究。
1 材料与方法
1.1 材料
1.1.1 动物:实验室保存肝脏特异性Sirt1敲除(Sirt1-LKO)雄鼠,野生型(wild type,WT)C57BL/6J雄性小鼠(SPF级,中国医学科学院基础医学研究所实验动物中心),饲养环境清洁级。
1.1.2 主要试剂:Trizol(Invitrogen公司);SYBR Green Ⅰ Q-PCR kit(Promega公司);蛋白酶抑制剂Cocktail,LPS(Sigma Aldrich公司);Tris,SDS,甘氨酸(AMRESCO公司);RIPA裂解液,PMSF(碧云天生物技术有限公司);NF-κB抗体(Abclonal公司);Tubulin抗体(Abmart公司);胎牛血清,RPMI-1640培养基(Gibco公司);高脂饲料(Research Diets公司)。
1.2 方法
1.2.1 体质量的监测:每周固定时间进行体质量秤量并记录。
1.2.2 小鼠原代肝细胞的分离及培养:用3%戊巴比妥钠麻醉小鼠(0.15 mL/10 g),乙醇擦拭皮肤消毒,呈U字型剪开皮肤,打开腹腔,分离门静脉,迅速将套管针置入门静脉,退出套管,留置导管,立即注入肝素,迅速打开胸腔,剪开下腔静脉,将门静脉的导管与注射器相连,灌流液I灌流2 min。连通灌流液II灌流5 min至肝脏出现皲裂或水泡。用400目滤网筛选肝细胞,清洗细胞2次,弃上清,接种细胞。详细操作请见参考文献[1]。
1.2.3 Western blot检测蛋白表达:倒掉培养液,用4 ℃预冷PBS清洗2遍,加入适量RIPA裂解液和蛋白酶抑制剂Cocktail,PMSF的混合液,在4 ℃下旋转孵育1 h,在 4 ℃预冷的离心机中以12 000 r/min离心15 min,将上清液转移至放置在冰上新的1.5 mL Eppendorf(EP)管中, 取20 μL上清用于测定蛋白浓度,其余上清加入等体积的5×上样缓冲液,100 ℃加热10 min,提前制备凝胶,将蛋白样品依次加入加样孔,样品两侧均加5 μL预染蛋白标记,设置电压为80 V,待蛋白样品压成一条线,调节电压为110 V,至溴酚蓝达到胶的末端附近可停止电泳,然后用湿转法,在300 mA的电流下将其转至聚偏二氟乙烯膜上,电转结束后,在室温条件下用5%的脱脂牛奶封闭1 h,4 °C旋转摇床孵育一抗过夜,用TBST洗膜3次,每次15 min,室温孵育二抗1 h后再次洗膜,用ECL发光显影液在天能化学发光仪中进行曝光。实验详细操作请见参考文献[1]。
1.2.4 RT-qPCR检测mRNA:倒掉培养液,用4 ℃预冷PBS清洗2遍,用Trizol试剂来提取总RNA,定量2 μg的总RNA来配置20 μL的反应体系。反转录为cDNA并在PCR扩增仪上进行扩增反应,定量1 μL的cDNA模板,选用SYBR GreenIQ-PCR kit的20 μL反应体系。于Bio-Rad CFX96 real-time system上进行扩增和实时荧光的定量检测,所检测基因的表达均以β-actin进行均一化的处理。β-actin上游引物: 5′-CCAGCCTTCCTTCTTGGGTAT-3′,下游引物:5′-TGCTGGAAGGT GGACAGTGAG-3′; Tnfα上游引物:5′-CGTCAGCCGATTTGCTATCT-3′,下游引物:5′-CGGACTCCGCAAAGTC-3′;IL6上游引物:5′-CCCAGGAGAAGATTCCAAAGATGTA-3′;下游引物:5′-GTCGAGGATGTACCGAATTTGTTT G-3′。
1.3 统计学分析
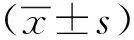
2 结果
2.1 Sirt1-LKO鼠体质量下降趋势
首先检测了高脂喂养条件下小鼠体质量的变化情况,与对照组相比,Sirt1-LKO鼠也显示体质量下降趋势(P<0.05)(图1)。

图1 Sirt1-LKO鼠显示体质量下降趋势Fig 1 Sirt1-LKO mice showed a tendency to lose
2.2 Sirt1-LKO鼠显示出对LPS刺激的低敏感性
生存曲线结果显示,与WT小鼠相比,Sirt1-LKO鼠对脂多糖(lipopolysaccharide, LPS)刺激表现低敏感 (图2)。

图2 Sirt1-LKO鼠对LPS刺激表现低敏感Fig 2 Sirt1-LKO mice showed low sensitivity to LPS
2.3 Sirt1-LKO鼠原代肝细胞中NF-κB表达增高
Western blot检测结果显示,与对照组相比,Sirt1-LKO鼠原代肝细胞中核因子κB(nuclear factor kappa-B,NF-κB)表达增高(P<0.05)(图3)。

*P<0.05 compared with WT control图3 Sirt1-LKO鼠原代肝细胞中NF-κB表达增高Fig 3 Increased expression of NF-κB in Primary hepatocytes of Sirt1-LKO mice n=6)
2.4 Sirt1-LKO鼠原代肝细胞Tnfα和IL6表达增高
结果显示,WT小鼠原代肝细胞中肿瘤坏死因子α(tumor necrosis factor α,TNFα)和白细胞介素-6(interleukin-6,IL-6)的转录水平明显低于Sirt1-LKO组(图4)。

*P<0.05 compared with WT control图4 Sirt1-LKO鼠原代肝细胞Tnfα和IL6表达增高Fig 4 Sirt1-LKO mice primary hepatocytes Tnfα and IL6 expression increased n=6)
3 讨论
炎性反应是指具有血管系统的活体组织对生物、物理、化学等损伤因子刺激所产生的一系列防御反应。 近年来, 随着对炎性反应的认识越发全面, 炎性反应途径已经被认定是许多慢性疾病发生和发展的关键分子基础[3]。
LPS是革兰阴性细菌细胞壁外壁的组成成分,其可以通过与细胞表面的模式识别受体结合,从而产生多种促炎细胞因子来启动固有免疫应答[5]。LPS主要是以细胞膜表面的Toll样受体(Toll-like receptors, TLR)4为媒介,激活下游NF-κB[8],从而激活部分炎性反应。NF-κB被认为是炎性反应的主要调节因子,它能够调节免疫和炎性反应基因的转录。NF-κB的激活引发脂肪变性,从而产生Tnfα、IL6、IL1等促炎细胞因子,这些细胞因子的产生会触发影响炎性反应的免疫系统细胞的募集和活化[6]。本研究中,Sirt1敲除会增加NF-κB的表达,促进Tnfα,IL6等炎性因子的分泌及表达,并对LPS刺激表现低敏感,表明Sirt1介导了LPS对NF-κB的作用。NF-κB和Sirt1信号通路都是进化上保守的维持体内平衡的机制,它们的相互作用使机体处于平衡,但NF-κB和Sirt1信号通路的相互作用是拮抗的[7]。
适度的Sirt1过度表达产生了对高脂肪诱导的肝脂肪变性和葡萄糖耐受不良的保护作用[9]。这就提示Sirt1的药理活化可能是治疗肝脏炎性反应肥胖相关代谢疾病的一种有效抗炎治疗策略。但由于Sirt1在急性或慢性肝损害中引发的作用不一致,需要进一步研究在具体情况下使用Sirt1激活剂/抑制剂可能产生的益处/危害。
