干扰ADAM17抑制人宫颈癌细胞系HeLa细胞增殖
2022-02-19张春利齐结华吴守乐蔡徐山
张春利,齐结华,宦 宇,吴守乐,蔡徐山
(上海市嘉定区妇幼保健院 检验科, 上海 201821)
宫颈癌(cervical cancer)是女性常见的恶性肿瘤之一,发病率仅次于乳腺癌,给女性的身心健康和生命安全带来了严重威胁,且近年来发病趋于年轻化,病死率也一直居高不下。尽管宫颈癌筛查方法和治疗技术已逐步优化,但仍有大部分患者被确诊时已处于晚期,治疗方案较为有限,且副作用严重[1]。因此,有必要从分子生物学层面探索宫颈癌发生发展的机制,从而寻找有效的治疗靶标。
去整合素-金属蛋白酶17(a disintegrin and metalloproteinase 17, ADAM17)是一种锌依赖性跨膜蛋白, 在人类的生长发育、炎性反应和肿瘤等过程中发挥了重要作用[2]。研究发现,ADAM17在正常组织和细胞中表达量较低,但在多种恶性肿瘤中表达量升高,且促进了肿瘤的发生发展[3-5]。已有研究表明,ADAM17 在宫颈癌组织中呈异常高表达,且与宫颈癌的临床分期和淋巴结转移密切相关[6]。然而,关于ADAM17在宫颈癌发生发展中的生物学功能及作用机制目前尚未见相应报道。因此,本研究旨在探讨ADAM17对宫颈癌细胞增殖的影响,并对其机制进行初步研究,为以ADAM17为靶点的宫颈癌治疗提供实验依据。
1 材料与方法
1.1 材料
人宫颈癌细胞HeLa(中科院上海细胞库)。sh-ADAM17为本课题前期构建而成。DMEM培养基、PBS、胰蛋白酶(Hyclone公司);胎牛血清FBS(Gibco公司);转染试剂脂质体2000(lipo2000)(Invitrogen公司);兔抗人-ADAM17、-β-actin、-PCNA、-EGFR、-p-ERK及-ERK抗体(Cell Signaling公司);羊抗兔二抗、羊抗鼠二抗(Sigma Aldrich公司);Transwell小室(Corning公司);CCK-8试剂、反转录试剂盒和实时荧光定量PCR试剂(Promega公司)。
1.2 方法
1.2.1 细胞的培养与分组处理:将细胞培养于含有10% FBS的DMEM培养基中,置于37 ℃、5% CO2培养箱中常规培养,隔天当细胞汇合度为90%左右时传代。将对数增殖期的细胞铺于6孔板中,第2天当细胞汇合度达60%~70%时,更换为无血清无双抗培养基,分对照组和实验组,按照lipo2000说明书将质粒和脂质体按1∶2.5的质量体积比混合,室温静置20 min后进行转染,5 h后更换为完全培养基,继续培养。
1.2.2 荧光定量PCR(RT-qPCR)检测ADAM17的表达:提取细胞总RNA,按照反转录试剂盒说明书反转录得到cDNA,荧光定量PCR检测ADAM17 mRNA的表达水平。每组3个复孔。ADAM17上游引物序列: 5′-AGAGCTGACCCAGATCCCAT-3′,下游引物序列: 5′-TACTCTCTTCCCCTCTGCCC-3′;内参GAPDH上游引物序列: 5′-TGGGGAAGGTGAAGG TCGG-3′,下游引物序列: 5′-CTGGAAGATGGTGATG GGA-3′。
1.2.3 划痕实验检测细胞的迁移:将细胞接种于6孔板,待汇合度达90%时,用无菌枪头划线,PBS清洗3次后,加入无血清培养基继续培养,分别于0、48 h观察并固定位置拍照,实验重复3次。
1.2.4 Transwell小室法检测细胞的迁移和侵袭:迁移实验是将已转染的细胞用无血清培养基重悬为单细胞悬液,计数并调整为5×105个/mL,在Transwell嵌套下室加入650 μL含10% 胎牛血清的完全培养基,上室加入已制备好的细胞悬液100 μL,在细胞培养箱中培养24 h。用棉签轻轻擦去上室细胞,浸入甲醛固定30 min,0.1%结晶紫染液染色30 min,PBS洗涤3次,拍照并计数细胞,每组实验重复3次,取均值进行比较。侵袭实验:Transwell上室预先包被基质胶,其余步骤均同Transwell迁移实验。
1.2.5 CCK-8法检测细胞的增殖:将实验组和对照组细胞分别接种于96孔板,2×103/孔,每组设4个复孔,并同时设置空白对照组,分别于24、48 和72 h加入10 μL CCK-8溶液,继续在培养箱中培养2 h后,检测各孔在490 nm处的吸光度(A值),根据检测结果绘制增殖曲线。
1.2.6 Western blot检测细胞中相关蛋白的表达: 各组细胞转染48 h后,加入适量的含有蛋白酶抑制剂、磷酸酶抑制剂的RIPA裂解液,充分混匀后于冰上裂解20 min,4 ℃,13 000 r/min离心10 min,BCA法测蛋白浓度,煮沸变性,经SDS-PAGE分离,转至PVDF膜,5%脱脂奶粉封闭1 h 后,加入一抗4 ℃孵育过夜;用已配制好的TBST洗膜3次,加入二抗,室温孵育1 h,再用TBST洗膜3次,ECL化学发光法显影分析。
1.3 统计学分析
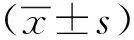
2 结果
2.1 宫颈癌HeLa细胞中ADAM17干扰效率验证
与对照组相比,干扰组ADAM17表达水平降低了58% (P<0.05)(图1A)。干扰组ADAM17的蛋白表达量也明显降低(P<0.05)(图1B,C)。

A.expressions of ADAM17 mRNA in HeLa cells transfected by sh-ADAM17; B.expressions of ADAM17 protein in HeLa cells transfected by sh-ADAM17; C.relative protein levels of ADAM17 detected by densitometry; *P<0.05 compared with sh-control group图1 sh-ADAM17介导的HeLa细胞ADAM17表达降低的验证Fig 1 Verification of sh-ADAM17 mediated ADAM17 expression decrease in HeLa cells
2.2 干扰ADAM17对HeLa细胞迁移及侵袭能力的影响
与对照组相比,干扰组细胞迁移能力和侵袭能力无明显变化。
2.3 干扰ADAM17对HeLa细胞增殖能力的影响
与对照组相比ADAM17干扰组细胞的增殖能力减弱(P<0.05)(图2)。

*P<0.05 compared with sh-control group图2 下调ADAM17基因表达对HeLa细胞增殖能力的影响Fig 2 The effect of knockdown of ADAM17 gene on the proliferation of HeLa cells
2.4 干扰ADAM17对相关蛋白表达的影响
与对照组相比,ADAM17干扰组 PCNA、p-EGFR和p-ERK表达水平也明显降低(P<0.05)(图3A,B)。

A.expression of PCNA and proteins related to EGFR/ERK pathway in HeLa cells transfected by sh-ADAM17; B.relative levels of proteins detected by densitometry; *P<0.05 compared with sh-control group图3 干扰ADAM17对PCNA、EGFR/ERK通路相关蛋白表达水平的影响Fig 3 Effect of knockdown of ADAM17 gene on the protein expression of PCNA and EGFR/ERK pathway
3 讨论
宫颈癌的传统治疗方法主要为手术切除和放射、化学药物治疗,但不同患者对放、化疗的敏感性差异较大,且不良反应明显;一些新型的免疫疗法虽然初步展现出较好的前景,但仍需更深层次的探究才能真正应用于临床治疗[7-8]。所以,对宫颈癌发生、发展的分子机制进行探索很有必要。
去整合素-金属蛋白酶家族参与了包括生育、黏附、迁移、炎性反应、蛋白水解及细胞传导等在内的多种生物学功能,作为该家族的重要一员,ADAM17在多种恶性肿瘤中显著高表达[9]。与正常肝组织相比,肝癌组织中ADAM17表达明显升高,且与肝癌患者的不良预后显著相关[3]。ADAM17在胃癌组织及细胞中表达显著升高,并和淋巴结转移呈正相关,可作为胃癌患者预后的独立预测因子[5]。已有研究表明,ADAM17在宫颈癌组织中异常高表达,且与宫颈癌的临床分期和淋巴结转移密切相关[6]。为进一步研究ADAM17在宫颈癌中的作用, 本研究将干扰ADAM17的质粒转染于人宫颈癌HeLa细胞中,结果表明,ADAM17不影响宫颈癌细胞的迁移及侵袭,但干扰ADAM17可显著抑制宫颈癌细胞增殖。
表皮生长因子受体(epidermal growth factor receptor,EGFR)为受体酪氨酸激酶家族中的重要成员之一,它参与人体多种生物学过程。已经证实,EGFR在多种人类肿瘤中都异常活化,促进肿瘤细胞的增殖、侵袭、抗凋亡及血管新生等[10]。而ADAM17可以水解EGFR 配体的前体,从而激活 EGFR 通路,进一步激活其下游信号通路,包括细胞外相关激酶(extracellular related kinase,ERK)、磷脂酰肌醇三激酶(phosphoinositide 3-kinase, PI3K)和AKT通路[11]。在转染ADAM17-shRNA 的 MCF-7 乳腺癌裸鼠移植瘤模型中,随着 ADAM17 表达下降,转染组肿瘤组织中p-EGFR和p-ERK表达水平也降低,说明ADAM17通过EGFR/ERK 信号通路调控了乳腺癌细胞裸鼠移植瘤的生长[12]。本研究结果表明,在宫颈癌HeLa细胞中干扰ADAM17表达也可使EGFR和ERK磷酸化水平降低。说明ADAM17可能是通过EGFR/ERK信号通路影响宫颈癌细胞增殖。
综上所述,干扰ADAM17基因可抑制宫颈癌HeLa细胞增殖,这可能是通过调控EGFR/ERK信号通路来实现的。本研究为以ADAM17为靶点的宫颈癌治疗提供了实验依据,但具体分子机制尚需要进一步探索。
