牛樟芝的分离鉴定及最适谷物皿培基质的筛选
2022-02-18王玲芝余锦欣章文贤
白 雪,王玲芝,余锦欣,章文贤
(福建师范大学生命科学学院, 福建 福州 350117)
牛樟芝Antrodiacamphorata素有“森林红宝石”美誉,是一种产于我国台湾地区的珍稀食药用丝状真菌。野生牛樟芝仅生长于中国台湾山区海拔600~2 000 m特有树种——牛樟树Cinnamomumkanehirae的中空内壁。牛樟芝提取物中有许多活性成分,主要包括三萜类化合物、苯酸类化合物、木脂素、多糖、超氧歧化酶、马来酸和琥珀酸及其衍生物等[1-3],其中牛樟芝中的三萜类化合物含量是普通灵芝的30倍以上[4-5],且未发现亚急性毒性和基因毒性,有极高的药用价值[6-7]。近年来,牛樟芝在抗炎、保肝、抗癌和抗氧化等领域的研究成果均表明出极大的开发潜力[8-12]。但是,由于牛樟芝寄主专一性强、生长缓慢,早期不法滥采造成野生牛樟芝资源稀缺,致使市场价格居高不下,因此牛樟芝的人工栽培技术受到广泛的关注。
目前牛樟芝人工培养方式主要包括椴木培养法、深层液体发酵培养法和固体培养法3种[13]。椴木培养虽然能获得与野生牛樟芝中所含的活性物质十分相似的牛樟芝子实体,但培养时间长达2~3年,生产成本较高,不适合大规模工业化生产。深层液体发酵培养生产周期短,但获得的菌丝体中所含三萜类生理活性物质成分较少,药用价值和经济效益有限[14]。固体培养不因牛樟树稀有而受到限制,其代谢产物种类与樟芝子实体相似,能获得更多生理活性物质,已成为主流的牛樟芝人工培养技术。固体培养可分为太空包固态发酵培养、皿式培养和锥形瓶培养3种。近年来皿式培养法由于总体培养时间较短、菌体易于基质分离、质控容易以及所得牛樟芝子实体中含有的活性成分与野生牛樟芝相似,已经成为牛樟芝人工培养的最佳方式[15]。然而目前皿培均采用琼脂培养基,将谷物置于培养皿中进行谷物皿培兼具基质天然营养丰富和通风良好的优势,有望得到生长迅速、活性成分产量高的牛樟芝。目前该培养方式尚未见报道。
本研究从野生牛樟芝子实体上分离得到菌株,经过培养、鉴定和系统发育树分析确定为牛樟芝后,再以生长速率和总三萜含量为指标确定最佳牛樟芝谷物皿培基质,为进一步大规模培养牛樟芝及合成三萜类物质,研究其药用价值提供参考。
1 材料与方法
1.1 试验菌株
菌株由中国台湾牛樟芝子实体分离得到,命名为BX1119.1。
1.2 仪器和试剂
HS-840超净工作台:苏州安泰空气技术有限公司;GI54高压灭菌锅:上海富士工器有限公司;SPX-250B生化培养箱:上海力辰仪器科技有限公司;KQ-500E超声波清洗器:昆山市超声仪器有限公司;101型电热鼓风干燥箱:北京永光明医疗仪器有限公司;CP214电子天平:奥豪斯仪器(上海)有限公司;DL9700 PCR扩增仪:北京东林昌盛生物科技有限责任公司;Mini Gel电泳槽:美国Thermo Scientific;GelDoc2000凝胶成像系统:美国BIO-RAD公司。
PrimeSTAR HS (Premix)、DL2000 DNA Marker、Gold View核酸染料,均购自宝日医生物技术(北京)有限公司,引物合成由北京鼎国昌盛生物技术有限责任公司完成,其他试剂均为国产分析纯或化学纯。
1.3 培养基
水琼脂培养基(w/v):琼脂2%,去离子水补齐,pH自然。马铃薯葡萄糖琼脂培养基(w/v):新鲜去皮土豆(煮汁)20%,葡萄糖2%,琼脂2%,去离子水补齐,pH自然。谷物皿式培养基:用研磨机分别研磨麸皮、黄米、莜麦、玉米、大米、荞麦后过20目筛作为固态基质保存备用。基于麸皮的基本成分,以单麸皮、麸皮与5种碳源谷物基质黄米粉、莜麦粉、玉米粉、大米粉、荞麦粉按1∶1(w/w)分别组成6种培养基,依次编号为CK、A、B、C、D、E。高压蒸气灭菌:103.4 kPa、121℃、20 min。
1.4 试验方法
1.4.1菌株分离 无菌手术刀切下牛樟木表面的牛樟芝子实体,75%乙醇中浸泡1 min后,无菌水清洗5次去除酒精残留,灭菌滤纸吸干水分,接种至水琼脂培养基上培养,1周后转接至PDA培养基,待其长出菌丝后划线分离,挑取单菌落保种。
1.4.2菌株鉴定 (1)形态学特征。牛樟芝菌种接种于PDA培养基上,28℃培养,每日观察其菌落形态。(2)rDNA ITS序列分析。按DNA试剂盒说明书步骤提取牛樟芝菌丝DNA,以SanTaqPlus PCR Mix试剂盒(生工生物工程上海股份有限公司)以牛樟芝基因组DNA为模板,以真菌通用引物序列:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′- TCCTCCGCTTATTGATATGC-3′(北京鼎国昌盛生物技术有限责任公司合成)对菌株rDNA ITS进行PCR扩增。PCR反应体系为25 μL,体系内含PrimeSTAR HS(Premix)12.5 μL、Rnase-freeWater9.5 μL、引物各0.5 μL(10 μmol·L-1)、模板DNA 2 μL。扩增程序为94℃预变性5 min;94℃变性30 s;54℃退火(引物与模板结合)30 s;72℃延伸90 s,35个循环;最后72℃延伸10 min,4℃保存。收集产物进行2%琼脂糖凝胶电泳,胶回收产物送至北京鼎国昌盛生物技术有限责任公司测序分析。使用CodonCode Aligner 5软件对测序峰图进行拼接校对,将所获得的ITS序列在NCBI数据库进行同源性比对分析。(3)系统发育树构建。测序得到的ITS序列与NCBI上的牛樟芝序列比对后,从数据库中选择相似度评分最高的且序列全长接近待鉴定菌株长度的物种对应的核酸序列,同时选取侧耳科香菇属的香菇(Lentinulaedodes)作为外类群,下载保存成FASTA格式。运行MEGA软件进行多重序列比对,完成比对后,截齐两端,选择最大似然法(Maximum likelihood method,ML),执行参数为Bootstrap method,重复1 000次,构建系统发育树[16]。
1.4.3菌株的培养 (1)斜面保种。接种环挑取平皿上的单菌落,划线接种于PDA斜面。(2)牛樟芝平板培养。将保藏在PDA斜面试管中的牛樟芝用接种铲接种表面积为1 cm2的菌块于PDA培养皿正中间,28℃培养箱暗培养。
1.4.4牛樟芝谷物皿培法 PDA平板培养基28℃培养20 d后,使用直径10 mm的灭菌打孔器在牛樟芝新生菌丝上打孔,转移至固体培养基的中部,28℃培养箱培养。
1.4.5牛樟芝生物量测定 采用干重法。将发酵后的菌体60℃烘干至恒重,研磨后过80目筛,收集菌粉并称重记录。
1.4.6牛樟芝生长速度测定 分别测量接种第5、8、11、14、17、20 d的菌丝生长直径。
1.4.7齐墩果酸标准曲线的制作 采用高氯酸-香草醛显色法进行测定。过程如下:准确称取10 mg齐墩果酸标准品,95%乙醇定容至25 mL,振荡均匀。分别吸取0、0.05、0.1、0.15、0.2、0.25、0.3 mL到试管中,100℃水浴加热挥发干溶剂,再向试管中加入0.3 mL现配的5%香草醛-冰醋酸溶液和1 mL高氯酸,60℃恒温水浴20 min,水浴结束后,立即冰浴冷却试管内混合液体,再向每个试管中加入5 mL冰醋酸稀释后摇匀。在波长550 nm处,测定吸光值并绘制标准曲线[17]。
1.4.8牛樟芝三萜总量测定 采用高氯酸-香草醛显色法进行测定。过程如下:称0.1 g干菌粉于10 mL离心管中,加入5 mL95%乙醇水溶液,50℃恒温水浴1 h后超声90 min,过滤,取0.1 mL滤液于试管中,100℃水浴加热挥发干溶剂,再加入0.3 mL现配的5%香草醛-冰醋酸溶液和1 mL高氯酸,60℃恒温水浴20 min后,冰浴冷却,再向每支试管中加入5 mL冰醋酸稀释后摇匀,检测并记录波长550 nm的吸光值。将吸光值代入标准曲线,得到三萜类化合物的含量[17]。
1.5 数据处理
试验数据统计分析与作图采用Excel 2003完成。
2 结果与分析
2.1 菌株的形态学特征分析
由图1A可知,在PDA培养基上,初期菌丝为白色,后经橘红色转变为黄色,菌丝茂密以辐射状短分支向周围延伸,菌落隆起,有一定厚度,且中间比边缘厚。图1B可知,背部呈黄色。有牛樟芝特有芳香气味。本实验室分离到的菌株与赖敏男[15]提到的皿式培养法的牛樟芝形态相似。

图1 BX1119.1样品在PDA培养基上生长情况(A为正面,B为背面)Fig.1 Growth of the BX1119.1 samples on PDA culture substrate (A for the front, B for the back)
2.2 菌株ITS测序及系统发育树的构建
将分离到的牛樟芝ITS序列以通用引物ITS1/ITS4进行PCR扩增,PCR产物进行2%琼脂糖凝胶电泳,得到电泳条带的大小约为680 bp,条带清晰且无拖尾,无杂带出现(图2),可进行胶回收,产物送至北京鼎国昌盛生物技术有限责任公司测序分析。

图2 BX1119.1 ITS序列电泳结果Fig.2 Electropherogram of ITS sequence of BX1119.1
将测得的序列进行Blast检索比对,共筛选出10个序列(含1个外类群)进行系统发育树的构建。结果表明,BX1119.1与Taiwanofunguscamphoratus(KP054990.1)序列同源性最高,相似度达到99.7%,聚类在同一支,表明为同种牛樟芝,分类地位为真菌界Eumycetes、担子菌门Basidiomycota、伞菌纲Agaricomycetes、多孔菌目Polyporales、多孔菌科Polyporaceae、薄孔菌属Antrodia。

图3 BX1119.1及其参考菌株的ITS序列的系统发育树Fig.3 Phylogenetic tree of ITS sequences of BX1119.1 and its reference strains
2.3 不同谷物皿培基质对牛樟芝的生长的影响
由于琼脂块表面的菌丝长到培养基表面需要一定时间,所以本试验从接种第5 d开始记录数据。由图4可知,接种第5 d时,CK和其余5组试验组均长出白色的初生菌丝,B(麸皮+莜麦粉)、C(麸皮+玉米粉)、D(麸皮+大米粉)菌丝致密,而A(麸皮+黄米粉)菌丝疏松;第8 d时CK(麸皮)菌落仍为白色,A(麸皮+黄米粉)为浅橘色,较疏松,其他4组均变为橘红色,菌落紧密;第14 d时,CK(麸皮)变成浅黄色,菌落很薄,A(麸皮+黄米粉)变成橘红色,但与其他实验组颜色深浅不同;第20 d时,CK(麸皮)浅黄色程度加深,但仍然很薄,其他5组试验组均为橘红色,菌落致密,颜色由深至浅为D(麸皮+大米粉)>C(麸皮+玉米粉)>B(麸皮+莜麦粉)>E(麸皮+荞麦粉)>A(麸皮+黄米粉)。
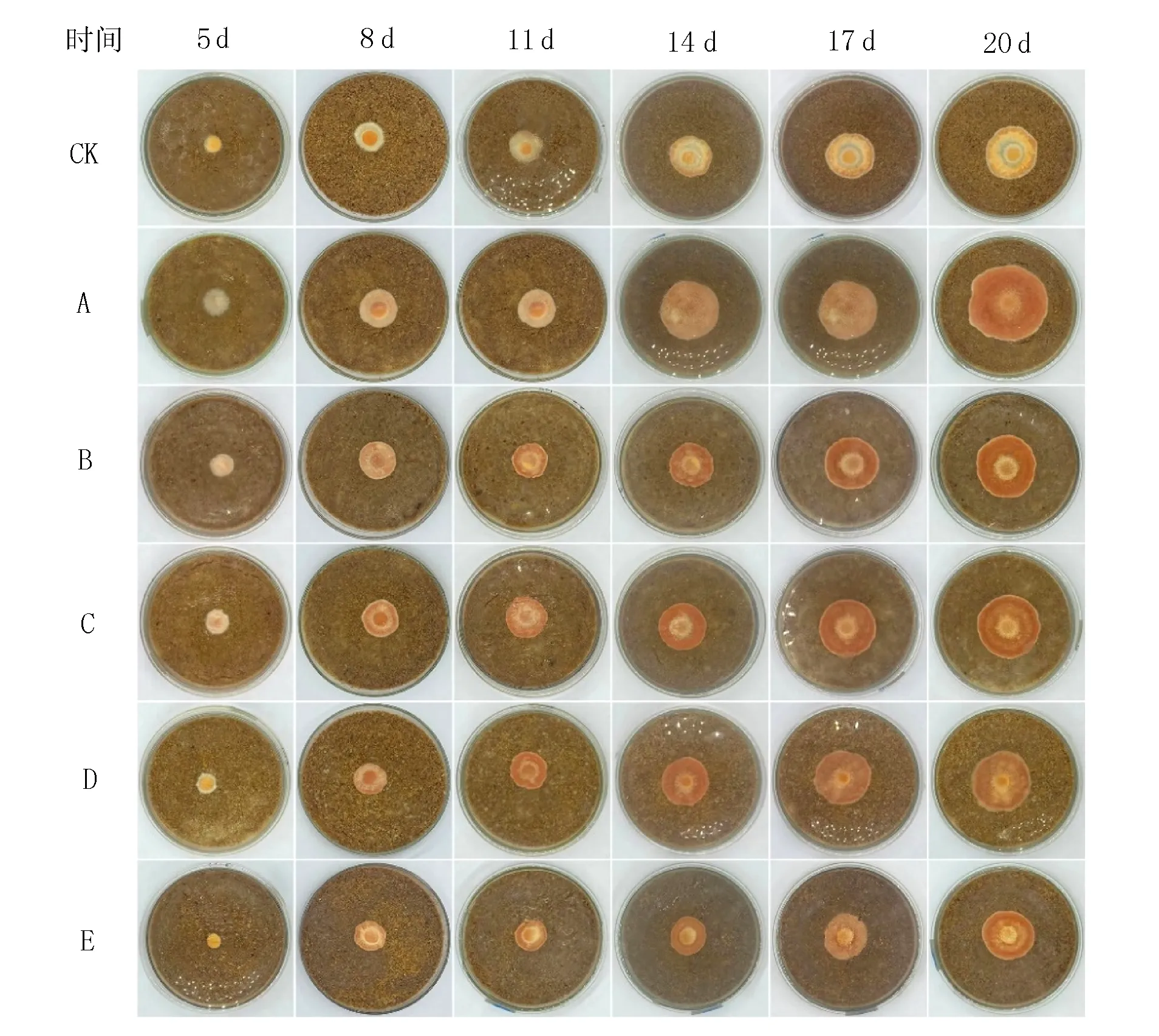
图4 牛樟芝菌株在不同谷物培养基质上的生长情况Fig.4 Growth of Antrodia camphorata strains on different grain culture substrates
由图5可知,接种第5 d时,A(麸皮+黄米粉)菌丝直径最大,B(麸皮+莜麦粉)和C(麸皮+玉米粉)直径基本一致,E(麸皮+荞麦粉)菌丝直径最小。第8 d时,CK(麸皮)和E(麸皮+荞麦粉)菌丝直径接近,A(麸皮+黄米粉)菌丝直径仍然最大。第11 d时,A(麸皮+黄米粉)直径最大,生长速度是CK(麸皮)的2.5倍。第14 d时,A(麸皮+黄米粉)直径最大,D(麸皮+大米粉)生长速度最快是CK(麸皮)的1.41倍。第17 d时,C(麸皮+玉米粉)生长速度变慢与D(麸皮+大米粉)直径接近。第20 d时,A(麸皮+黄米粉)直径最大且生长速度最快是A(麸皮)的2.64倍。

图5 牛樟芝菌株在不同谷物培养基质上的生长速度Fig.5 Growth rate of Antrodia camphorata strains on different grain culture substrates
由图6可知,在接种第20 d时,A(麸皮+黄米粉)干重最大,为(47.69 mg·g-1培养基质),是CK(麸皮)的4.27倍。结合图4可知,E(麸皮+荞麦粉)比A(麸皮)菌落厚,所以在E(麸皮+荞麦粉)的直径比CK(麸皮)小的情况下,E(麸皮+荞麦粉)的干重仍然比对照组CK(麸皮)大。

图6 不同谷物培养基质对牛樟芝菌丝体生物量的影响Fig.6 Effects of different grain culture substrates on the mycelial biomass of Antrodia camphorata
2.4 不同固态培养基质对牛樟芝三萜合成的影响
由图7A可知,在接种第20 d时,B(麸皮+莜麦粉)的三萜含量最大(2.89 mg·dg-1干重),CK(麸皮)的最小(0.89 mg·dg-1干重)。B(麸皮+莜麦粉)的三萜含量是E(麸皮+荞麦粉)的1.45 倍,是CK(麸皮)的3.21 倍。A(麸皮+黄米粉)直径最大,但三萜含量比B(麸皮+莜麦粉)低(0.13 mg·dg-1干重)。由图7B可知,在接种第20 d时,A(麸皮+黄米粉)的三萜产量最高达到(1.315 mg·g-1谷物培养基质),是对照组CK(麸皮)的13倍。虽然B(麸皮+莜麦粉)三萜含量比A(麸皮+黄米粉)高,由于A(麸皮+黄米粉)干重比B(麸皮+莜麦粉)大得多,所以A(麸皮+黄米粉)的产量最高,且是B(麸皮+莜麦粉)的1.55倍。
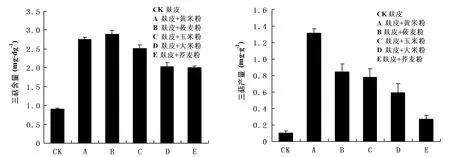
注:A为不同谷物培养基质对菌丝体三萜含量的影响;B为不同谷物培养基质对菌丝体三萜产量的影响图7 不同谷物培养基质对牛樟芝菌株三萜合成的影响Fig.7 Effects of different gain culture substrates on the biosynthesis of triterpenes in the strains of Antrodia camphorata
3 讨论
本研究在菌种鉴定过程中,分离得到1种菌株,命名为BX1119.1,结合形态特征和ITS测序,确定该菌种为牛樟芝。采用谷物皿式培养法培育牛樟芝,探究了以麸皮为基本成分与其他5种不同谷物为辅料组合配方的固体基质对牛樟芝菌丝体生长情况、生物量和三萜化合物合成的影响。牛樟芝在以麸皮为基本成分、不同辅料配方的固体培养基上均能生长出形态基本相似的菌丝,然而生长速度和干重有较大差异。在麸皮与黄米粉基质中生长菌丝干重最大,与琼脂皿培法中牛樟芝菌丝干重最适碳源山梨醇相比,是它的4.25倍,生长速度是它的1.54倍[18]。三萜类化合物作为牛樟芝的主要生理活性物质,在不同谷物基质培养基中测得的含量也明显不同。本试验麸皮与莜麦粉做培养基质时三萜含量最高,为(2.758±0.04)mg·dg-1DW,是使用大豆壳锥形瓶固态发酵牛樟芝的3.45倍[19]。数据表明,谷物皿培法相较传统固态发酵法确实有一定的优势。与锥形瓶固态培养相比,谷物皿培通风良好,基质天然,且黄米粉中钾含量较高、莜麦粉中蛋白质和硫胺素含量较高,推测以上原因共同促进了牛樟芝菌丝生长和三萜化合物的高效合成。
本研究旨在通过对牛樟芝人工培养条件中固态基质配方的探索,获得能替代昂贵牛樟芝子实体的新型谷物皿式培养物质。从结果来看,利用麸皮与黄米粉按比例混合的固体培养基,颜色接近野生子实体,且三萜类物质产量高。后续可通过优化发酵条件进一步提高三萜产量,为牛樟芝的应用提供参考。
