1种高效增强氨基糖苷类抗生素杀灭创伤弧菌的方法
2022-02-18邢亚芹冯荆城黄炜雅高媛媛
邢亚芹,冯荆城,黄炜雅,高媛媛
(细胞逆境响应与代谢调控福建省高校重点实验室/福建师范大学生命科学学院,福建 福州 350108)
弧菌是造成水产品细菌感染性疾病的主要原因之一,其中创伤弧菌是常见的危害较大的一种致病弧菌[1],其可引发多种水产动物患病,导致水产经济损失严重。感染者由于误食和接触感染创伤弧菌,往往发病急、病情重[2],该菌致死率可高达50%以上,是致死率最高的海洋致病弧菌[3-4]。长期以来渔业生产中抗生素等药物的使用,会引发创伤弧菌耐药性问题[5]。我国多省市水产品中创伤弧菌均有较高检出率,且多重耐药频发[6-9]。耐药创伤弧菌常使某些药物失效,临床治疗变得更加困难。
若不积极采取手段控制,创伤弧菌等水产病原菌的耐药现象会愈演愈烈,逐渐构成严重威胁。为了解决创伤弧菌等水产病原菌的耐药性问题,目前相关研究主要从以下方面展开:一是开发新的药物来替代现有抗生素,如抗菌肽。有学者开发了一种多肽,对创伤弧菌有很好的杀菌效果[10];也有研究从链霉菌发酵物中提取的抗菌肽对创伤弧菌有抗菌作用[11]。但目前抗菌肽在应用上存在一定的弊端,比如:稳定性差,合成或提取成本高,作用机制并不是特别清楚等[12]。二是创伤弧菌相关疫苗的开发,最新进展停留在荚膜四糖重复片段的合成及相关糖蛋白免疫活性研究[13-14],实际应用还需要较长的周期。此外,通过一些物理方法如快速冷冻[15]、加热[16],或者化学方法如外源添加佐剂(例如正丁醇[17]、1,2-丁二醇[18]、5-甲基吲哚[19]等)的方式来增强现有抗生素的杀菌效果,也是目前减少细菌耐药性的有效途径。但这些研究尚未涉及水产病原菌。本实验室研究发现,低离子休克(指环境中离子数量很少,物质主要为分子形式存在,例如超纯水介质)可以增强氨基糖苷类抗生素对嗜水气单胞菌等水产病原菌的杀灭效果,且庆大霉素在低离子条件下可以快速有效杀灭斑马鱼皮肤感染模型中的嗜水气单胞菌[20]。与对数期细菌相比,平台期细菌由于生长代谢缓慢,对抗生素更加耐受[21]。本试验拟探讨低离子休克是否可以促进氨基糖苷类抗生素快速杀灭平台期创伤弧菌。
氨基糖苷类抗生素因具有良好的抗菌活性,所以被广泛应用于水产、畜牧等行业[22]。本试验首先测试平台期创伤弧菌的敏感性,发现4种氨基糖苷类抗生素处理菌液2 h后难以杀灭。初步研究发现,介质为可提供低离子环境的超纯水时,可提高4种氨基糖苷类抗生素对创伤弧菌的杀灭效果;为探究低离子环境适宜的杀菌条件,设置了不同的抗生素处理浓度和时间,以确定其杀菌效果是否会受到浓度和时间的影响;为确定低离子促进杀菌是否与抗生素摄取有关,测定低离子处理组和生理渗透压对照组创伤弧菌对抗生素摄取量,以确定杀菌机制是否为增加抗生素的摄取。此研究从表型到机制的纵向思路,拟为生产、生活中创伤弧菌的杀灭提供新策略,期望有助于遏制创伤弧菌耐药现象的进一步恶化。
1 材料与方法
1.1 试验材料
实验室保藏的创伤弧菌Vibriovulnificu、大肠杆菌Escherichiacoli。
1.2 试剂与溶液
培养基:含3%NaCl的LB液体培养基(1 L蒸馏水中:10 g蛋白胨、30 g氯化钠、5 g酵母粉),3%NaCl的LB固体培养基(1 L蒸馏水中:10 g蛋白胨、30 g氯化钠、5 g酵母粉,15 g琼脂)。含1%NaCl的LB液体培养基(1 L蒸馏水中:10 g蛋白胨、10 g氯化钠、5 g酵母粉),1%NaCl的LB固体培养基(1 L蒸馏水中:10 g蛋白胨、10 g氯化钠、5 g酵母粉,15 g琼脂)。缓冲液:0.01 mol·L-1PBS溶液(1 L蒸馏水中:8 g氯化钠、0.2 g氯化钾、1.44 g磷酸氢二钠、0.24 g磷酸二氢钠)、3%NaCl、超纯水,上述溶液均经过高压灭菌锅121℃,20 min高压蒸汽灭菌。LB固体培养基灭菌完成后,倒入一次性无菌培养皿中待其凝固。4种氨基糖苷类抗生素储液:庆大霉素(Genta):25 mg·mL-1、妥布霉(Tob):25 mg·mL-1、新霉素(Neo):50 mg·mL-1、链霉素(Strep):100 mg·mL-1。用灭过菌的超纯水加粉末状固体药物进行配置,后用0.22 μm滤膜过滤以除去杂菌,-20℃冰箱储存。裂解液:100 mg·mL-1溶菌酶: 30 mmol·L-1Tris-HCl混合 1 mmol·L-1EDTA-Na2缓冲液(pH=8)配置。
1.3 4种氨基糖苷类抗生素对平台期创伤弧菌处理后敏感性测试
取-80℃冰箱中20%甘油保存的菌种,1∶1 000接种至3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h。过夜活化的细菌取40 μL至20 mL3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h至平台期。吸取菌液100 μL至1.5 mL圆EP管中,加入4种氨基糖苷类抗生素溶液至相应的浓度,庆大霉素和妥布霉素为100 μg·mL-1,链霉素和新霉素为500 μg·mL-1。后置于30℃、220 r·min-1摇床中处理2 h,对照组不加抗生素。13 000 r·min-1离心2 min,弃去上清,加入200 μL 0.01 mol·L-1PBS,重悬后静置5 min以洗掉残留的抗生素。再次13 000 r·min-1离心2 min,弃去上清,加入100 μL 0.01 mol·L-1PBS重悬。每次稀释10倍,稀释5次,每次取4 μL加至3%LB固体培养基,30℃培养箱过夜培养12 h,扫描仪扫描获取图像,并统计3次独立试验细菌存活情况。
1.4 不同浓度的氨基糖苷类抗生素对创伤弧菌杀灭效果的测试
取-80℃冰箱中20%甘油保存的创伤弧菌菌种,1∶1 000接种至20 mL3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h。过夜活化的细菌取40 μL接菌至20 mL3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h至平台期。吸取菌液100 μL至1.5 mL圆EP管中,13 000 r·min-1离心2 min,弃去上清。加入4种氨基糖苷类抗生素的超纯水溶液和生理等渗3%NaCl溶液重悬菌体,庆大霉素和妥布霉素浓度均为25 、50、100、200 μg·mL-1,链霉素和新霉素浓度均为25、50、100、200、500 μg·mL-1,处理时间5 min。接着13 000 r·min-1离心2 min,弃去上清,加入200 μL 0.01 mol·L-1PBS,重悬后静置5 min以洗掉残留的抗生素。再次13 000 r·min-1离心2 min,弃去上清,加入100 μL 0.01 mol·L-1PBS重悬。每次稀释10倍,稀释5次,每次取4 μL加至3%LB固体培养基,30℃培养箱过夜培养12 h,扫描仪扫描获取图像,并统计3次独立试验细菌存活情况。
1.5 氨基糖苷类抗生素不同处理时间对创伤弧菌杀灭效果的测试
取-80℃冰箱中20%甘油保存的菌种,1∶1 000接种至20 mL3%NaCl LB液体培养基中,于30℃,220 r·min-1摇床中过夜培养18 h。过夜活化的细菌取40 μL接菌至20 mL3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h至平台期。吸取菌液100 μL至1.5 mL圆EP管中,13 000 r·min-1离心2 min,弃去上清。加入4种氨基糖苷类抗生素的超纯水溶液和生理渗透压的3%NaCl溶液重悬菌体,庆大霉素和妥布霉素为100 μg·mL-1,链霉素和新霉素为500 μg·mL-1,处理时间为1、3、5、10 min。13 000 r·min-1离心2 min,弃去上清,加入200 μL0.01 mol·L-1PBS,重悬后静置5 min以洗掉残留的抗生素。再次13 000 r·min-1离心2 min,弃去上清,加入100 μL0.01 mol·L-1PBS重悬。每次稀释10倍,稀释5次,每次取4 μL加至3%LB固体培养基,30℃培养箱过夜培养12 h,扫描仪扫描获取图像,并统计3次独立试验细菌存活情况。
1.6 创伤弧菌对氨基糖苷类抗生素摄取量测定
选择妥布霉素作为试验中4种氨基糖苷类抗生素的代表,检测处理后样品中妥布霉素摄取量。取-80℃冰箱中20%甘油保存的菌种,1∶1 000接种至20 mL 3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h。过夜活化的细菌取40 μL接菌至20 mL3%NaCl LB液体培养基中,于30℃、220 r·min-1摇床中过夜培养18 h至平台期。
取大肠杆菌-80℃冰箱中20%甘油保存的大肠杆菌菌种,1∶1 000接种至1 mL 1%NaCl LB液体培养基中,于37℃、220 r·min-1摇床中过夜培养18 h。过夜活化的细菌取30 μL接菌至3 mL1%NaCl LB液体培养基中,于37℃、220 r·min-1摇床中培养至OD600为0.3~0.4。后吸取30 μL菌液加至1 mLPBS中,均匀涂抹于LB方形皿表面,于超净台吹干。
样品的制备:吸取平台期创伤弧菌菌液1 mL至1.5 mL圆EP管中,13 000 r·min-1离心2 min,弃去上清。加入100 μg·mL-1和200 μg·mL-1妥布霉素的超纯水溶液和生理等渗3%NaCl溶液重悬菌体,处理时间为5 min。13 000 r·min-1离心2 min,弃去上清,加入1 mL 0.01 mol·L-1PBS,重悬后静置5 min以洗掉残留的抗生素。洗涤2次。再次13 000 r·min-1离心2 min,弃去上清,加入1 mL 0.01 mol·L-1PBS重悬。13 000 r·min-1离心2 min,弃去上清,加入100 μL的终浓度为2 mg·mL-1溶菌酶,37℃、220 r·min-1摇床裂解2.5 h。裂解后,-80℃冰箱中冰冻4 min,共3次,每次冻完于常温水化冻。90℃加热10 min,13 000 r·min-1离心2 min,小心吸取上清获得低离子处理组和生理渗透压对照组的样品。
标准品的制备:吸取平台期创伤弧菌菌液1 mL至1.5 mL圆EP管中,13 000 r·min-1离心2 min,弃去上清。加入100 μL的2 mg·mL-1溶菌酶溶液,配置成妥布霉素浓度为0、20、40、60、80、100 μg·mL-1的溶液重悬菌体,37℃、220 r·min-1摇床裂解2.5 h。裂解后,-80℃冰箱中冰冻4 min,共3次,每次冻完于常温水化冻。90℃加热10 min,13 000 r·min-1离心2 min,吸取上清,获得标准品。
标准品和样品分别取5 μL点在涂有大肠杆菌的方形皿中,每组3个平行。37℃培养箱过夜培养12 h。扫描后得到图5结果,通过测定图5中标准品抑菌圈直径大小,得到抗生素摄取量与抑菌圈线性标准曲线。代入测定样品抑菌圈直径大小,计算出低离子处理组和生理渗透压对照组抗生素摄取量。
1.7 数据处理
数据统计采用Excel单因素方差分析并作图,数据取自3次独立试验。
2 结果与分析
2.1 4种氨基糖苷类抗生素对平台期创伤弧菌处理后敏感性测试结果
由图1可知,经过4种抗生素2 h的处理,与对照组相比,4种抗生素中庆大霉素、妥布霉素、新霉素对平台期创伤弧菌几乎没有杀灭效果,而链霉素仅仅杀灭1个数量级左右,说明平台期创伤弧菌对氨基糖苷类抗生素比较耐受。

图1 4种氨基糖苷类抗生素对平台期创伤弧菌处理后敏感性测试结果Fig.1 Test results of the sensitivity of Vibrio vulnificus at the plateau phase after treated with four kinds of aminoglycoside antibiotics
2.2 不同浓度的氨基糖苷类抗生素对创伤弧菌杀灭效果的测试结果
由图2可知,与创伤弧菌的生理渗透压环境相比,处理时间为5 min时,低离子环境会促进氨基糖苷类抗生素杀灭创伤弧菌,在庆大霉素和妥布霉素浓度为100 μg·mL-1时,能够杀灭3~5个数量级的细菌,随着浓度增加,杀灭效果增强,在浓度200 μg·mL-1时,能杀灭4~9个数量级的细菌,即杀灭99.99%及以上的细菌。在链霉素和新霉素浓度为200 μg·mL-1时,能够杀灭2~3个数量级的细菌,随着浓度增加,杀灭效果也增强,在浓度为500 μg·mL-1时可以杀灭3个数量级以上的细菌,即可以杀灭99.9%及以上的细菌。结果说明低离子处理促进多种氨基糖苷类抗生素杀灭平台期创伤弧菌都呈现一定的抗生素浓度依赖效应。
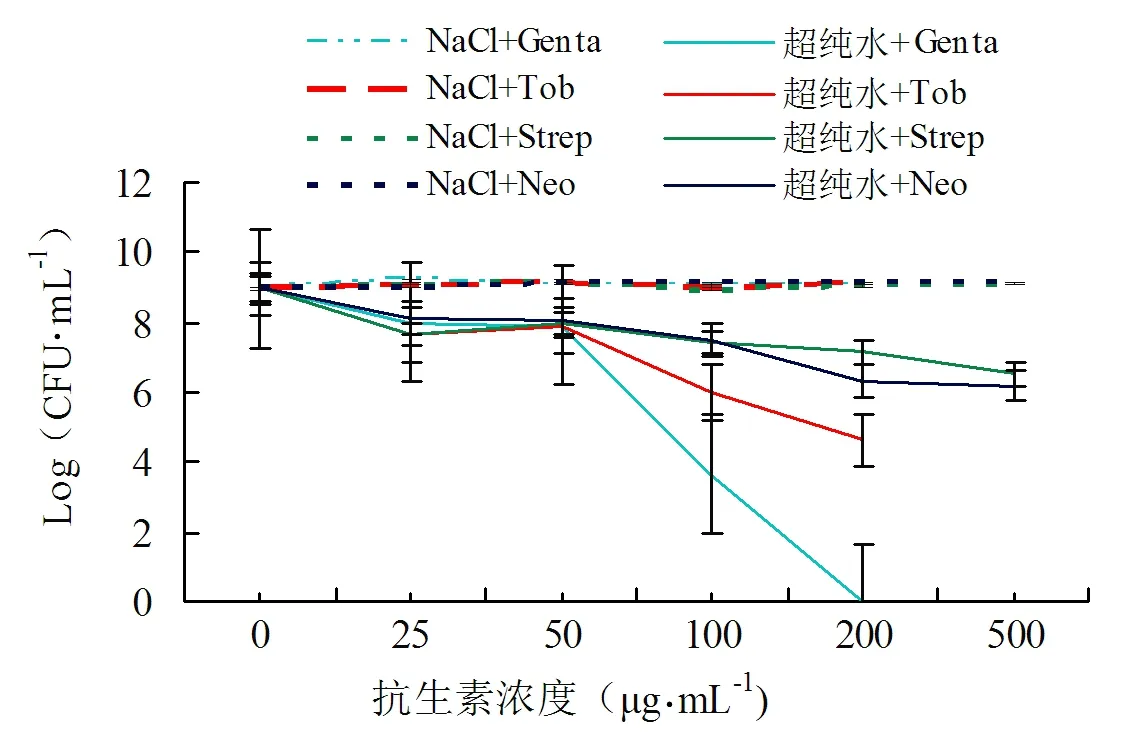
图2 不同浓度的氨基糖苷类抗生素对创伤弧菌杀灭效果的测试结果Fig.2 Measurement results of the killing efficacy of different concentrations of aminoglycoside antibiotics against Vibrio vulnificus
2.3 氨基糖苷类抗生素不同处理时间对创伤弧菌杀灭效果的测试结果
由图3可知,与创伤弧菌的生理渗透压环境相比,低离子环境会促进氨基糖苷类抗生素杀灭创伤弧菌,在庆大霉素和妥布霉素浓度为100 μg·mL-1,链霉素和新霉素浓度为500 μg·mL-1时,处理1 min,能够杀灭2~4个数量级的细菌,即99%及以上的细菌,随着时间增加,杀灭效果也逐渐增强。在3 min时能够杀灭3~5个数量级的细菌,即99.9%及以上的细菌。但是,庆大霉素处理组在延长至10 min时低离子促进杀菌效果会变差。结果说明低离子处理促进多种氨基糖苷类抗生素杀灭平台期创伤弧菌亦呈现一定的时间依赖效应。

图3 氨基糖苷类抗生素不同处理时间对创伤弧菌杀灭效果的测试结果Fig.3 Measurement results of the killing efficacy of aminoglycoside antibiotics against Vibrio vulnificus at different treatment time
2.4 创伤弧菌对氨基糖苷类抗生素摄取量测定结果
由图4、5可知,与生理渗透压对照组相比,低离子休克处理组妥布霉素摄取量显著增加。在妥布霉素浓度为100、200 μg·mL-1时,低离子环境下,妥布霉素的摄取量高于生理渗透压NaCl对照组,差异极显著。而且,随着两种介质中抗生素浓度的增加,抗生素摄取量也呈现增加的趋势。结果表明,低离子环境增强氨基糖苷类抗生素杀菌效果的机制是促进了创伤弧菌对抗生素的摄取。
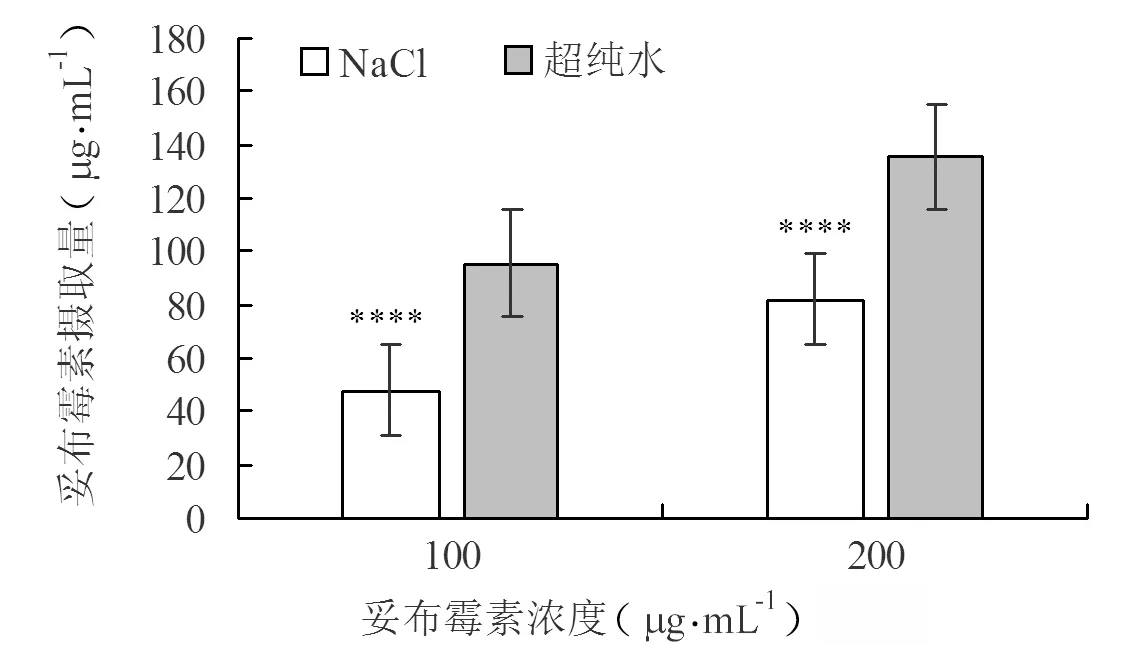
图4 创伤弧菌对氨基糖苷类抗生素摄取量测定结果Fig.4 Determination results of the intake of aminoglycoside antibiotics by Vibrio vulnificus
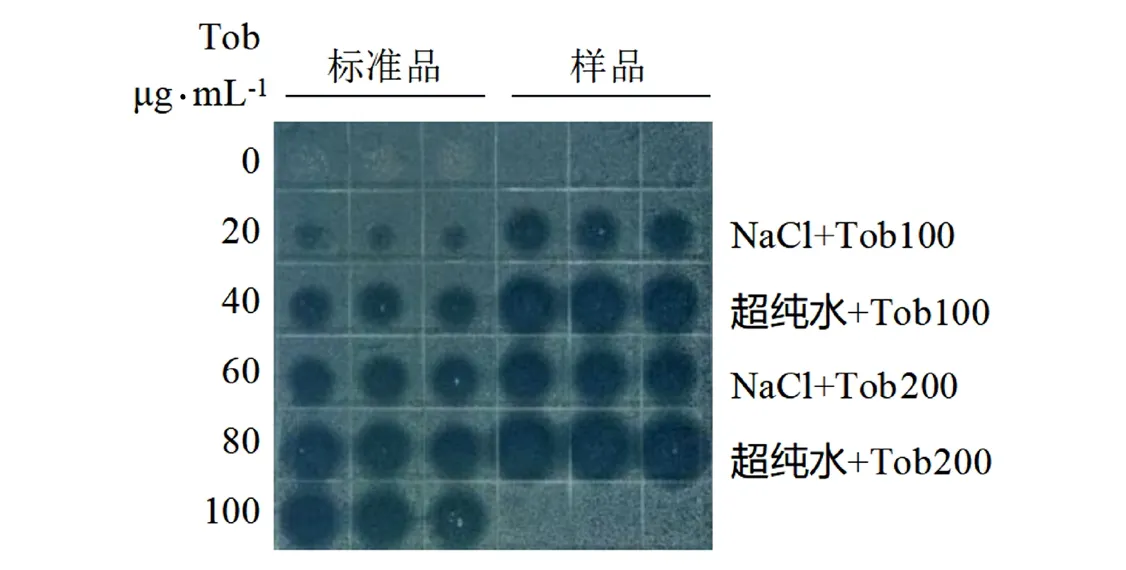
图5 创伤弧菌抑菌圈结果(妥布霉素)Fig.5 Results of the bacteriostatic ring of Vibrio vulnificus (tobramycin)
3 结论与讨论
之前有研究表明低离子休克可以增加氨基糖苷类抗生素对细菌的杀灭效果[20]。本研究在前人研究基础上,首次尝试将此方法应用于创伤弧菌,发现10 min以内的短时间处理同样可以发挥很好的杀菌效果,而相同抗生素浓度对创伤弧菌处理2 h,试验4种抗生素中只有链霉素能够杀灭1个数量级的创伤弧菌,而其他3种抗生素几乎不能杀死细菌。结果表明,低离子休克促进杀菌作用具有抗生素浓度和时间依赖效应,但庆大霉素延长时间后,促进杀菌效果先变强,后变弱,不同于其余3种抗生素随着时间延长杀菌效果持续增加,可能是由于不同种类的药物之间存在差异,这其中的机制还有待进一步研究。抗生素摄取试验表明,低离子休克促进抗生素杀灭创伤弧菌的分子机制在于促进细菌对抗生素的摄取。
新药的研发速度显然跟不上细菌耐药出现的速度,因此解决细菌耐药问题,增强现有抗生素杀菌效果的方法具有光明前景。本研究在低离子环境下,采用较低抗生素浓度、更短处理时间,发现低离子休克可以增加氨基糖苷类抗生素杀灭创伤弧菌的效果。如果将此方法应用于水产养殖,可以减少抗生素用量和作用时间,有效降低抗生素残留量和毒性,理论上是一种减缓创伤弧菌耐药现象出现的方式。虽然进一步的应用有待深入开展研究,但体外试验已经证明,低离子休克可以有效促进抗生素杀灭耐受性强的平台期创伤弧菌。
