基于16sRNA扩增子测序分析患烂皮病棘胸蛙皮肤的细菌多样性
2022-02-18张雪萍符宏高陈美玲黄其锻陆永树耿宝荣陈友铃
张雪萍,徐 莉,符宏高,陈美玲,黄其锻,陆永树,耿宝荣,陈友铃*,黄 镇*
(1.福建师范大学生命科学学院/福建省发育与神经生物学重点实验室, 福建 福州 350117; 2.福建省健丰生物科技有限公司, 福建 泉州 362500; 3.福建省石冻王生物技术研发中心有限公司, 福建 泉州 362500; 4.福建省南平市政和县天富盈农业专业合作社, 福建 南平 353602)
棘胸蛙Quasipaaspinosa是我国南方的大型食用蛙,因其具有食药用价值而受到人们的青睐,是我国近年来养殖蛙类中的主要品种之一。由于市场需求的增加和栖息地的破坏,野生棘胸蛙的数量急剧下降[1]。人工养殖是满足市场需求和保护野生棘胸蛙的最佳途径[2]。然而,在养殖过程中,由于养殖饵料的投喂、养殖密度大等因素,导致棘胸蛙在养殖过程中频发疾病,严重制约了棘胸蛙产业的发展。棘胸蛙养殖过程中,常见的疾病有:红腿病、白内障、腹水病、歪头病等[3],其中烂皮病是棘胸蛙养殖过程中较为常见的病害之一,其症状发病初期表现为食欲减退,表皮无光泽,然后表皮脱落并开始溃烂,出现白斑,甚至指骨和颌骨外露。该病传染性强,死亡率很高,严重影响棘胸蛙养殖经济效益[4-6]。
前期研究发现多种病菌会引起棘胸蛙的烂皮病,例如王瑞君等[4]对患烂皮病的棘胸蛙进行致病菌分离,经鉴定该致病菌株为奇异变形杆菌。胡霭臻等[5]从病死的烂皮病棘胸蛙头部、腿部和肝部分离得到3株病原菌,分别命名为LJ10201、LJ10202、LJ10203,经鉴定,确认LJ10201、LJ10203菌株为弗氏柠檬酸杆菌,LJ10202菌株为布氏柠檬酸杆菌。吕耀平等[6]从患烂皮病的棘胸蛙中分离并筛选出3株致病菌BS1、BS2和BS3,经鉴定上述3株菌均为蜡样芽孢杆菌。郑荣泉等[7]从患病濒死的棘胸蛙烂皮部位深层皮肤及肝脏组织分离病原菌,发现不动杆菌在患病棘胸蛙中占主导地位。肖波[8]从患腐皮病的棘胸蛙成蛙皮肤病灶、肌肉组织和肝脏中分离病原菌,发现嗜水气单胞菌是棘胸蛙腐皮病的主要病原。由这些研究结果可知,棘胸蛙烂皮病的细菌病原呈现多样性,容易受到环境因子的影响,在不同的地区、不同的养殖环境各不相同。因此,在不同的地区开展棘胸蛙烂皮病的监测,对于棘胸蛙病害防治有着积极的作用。
常规的细菌性疾病检测方法为培养法,该方法是将发生疾病的组织取出匀浆后,在营养琼脂培养基上进行培养,然后分离出单菌落进行鉴定。该方法只能针对可培养的细菌进行鉴定,对于整个组织的细菌群落结构解析不够全面[9]。16sRNA扩增子测序技术是鉴定非培养的或难以鉴定的细菌的有用工具,大大提高了分析复杂微生物种群组成的能力,并为研究人员提供更精确的分类信息。16sRNA基因由于其分子大小适中、突变率小而成为细菌系统分类研究中最常用的标记[10]。本研究通过细菌16sRNA片段高通量测序技术和生物信息学分析手段,对人工养殖的患烂皮病棘胸蛙的健康皮肤和溃烂皮肤菌群进行比较分析,有助于了解棘胸蛙皮肤的菌群结构及潜在致病菌,为棘胸蛙的健康养殖以及病害防治提供理论基础。
1 材料与方法
1.1 样本来源
3只患烂皮病的棘胸蛙活体取自三明市三元区众源棘胸蛙养殖专业合作社。根据外观诊断,棘胸蛙身上的皮肤存在局部溃烂。为了减少试验误差,在患病棘胸蛙背部选择直径1.0~1.5 cm的健康和溃烂部位的皮肤作为取样点(图1)。每只棘胸蛙用无菌蒸馏水清洗2次,以减少暂时性表面细菌。在无菌超净工作台内,从枕骨大孔插针快速处死,解剖。分别迅速取其健康皮肤样本和溃烂皮肤样本。健康皮肤样本编号为HS1、HS2和HS3,组成健康皮肤组(Healthy Skin)。溃烂皮肤样本编号为RS1、RS2和RS3,组成溃烂皮肤组(Rotten Skin)。样品液氮速冻后置于-80℃保存待用。
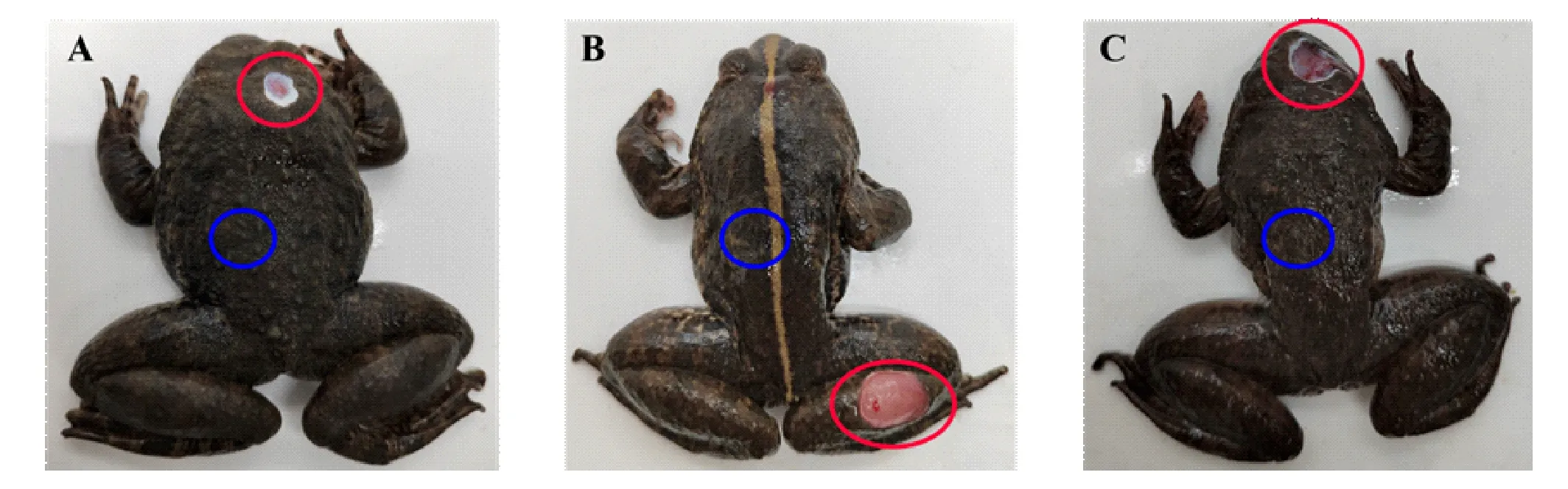
注:A、B、C为3只患烂皮病的棘胸蛙活体。红圈为溃烂部位皮肤;蓝圈为健康部位皮肤。图1 患烂皮病的棘胸蛙皮肤Fig.1 Skin of Quasipaa spinosa affected with the rotten-skin disease
1.2 样品总DNA提取、PCR扩增及高通量测序
在冰上用组织匀浆机将棘胸蛙皮肤样品匀浆后,根据说明书用Soil DNA Kit试剂盒(Omega Bio-Tek,USA)提取细菌总DNA。通过在2%的琼脂糖凝胶中电泳分析总DNA质量和完整性,并使用NanoDrop(ND2000,Thermo Scientific)对DNA浓度进行定量分析。用细菌特异性引物:341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)对16sRNA基因可变区(V3~V4区)进行PCR扩增。PCR产物用2%的琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司进行基于IlluminaHiSeq测序平台的高通量测序。
1.3 测序处理和质控
根据PE reads之间的overlap关系,使用cutadapt 1.18去除Read1 3′端测序引物接头AGATCGGAAGAGCACACGTCTGAACTCCAGTCA和Read2 3′端测序引物接头AGATCGGAAGAGCGTCGTGTAGGGAAAGAGTGT后,用PEAR 0.9.8将成对的reads拼接(merge)成一条序列;然后按照barcode标签序列识别并区分样品得到各样本数据,同时校正序列方向;最后用PRINSEQ 0.20.4对各样本数据的质量进行质控过滤,切除reads尾部质量值20以下的碱基,设置10 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后的含N序列和短序列,最终过滤掉低复杂度的序列,得到各样本有效数据。
通过聚类操作,用Usearch 11.0.667将序列按照彼此的相似性分归为许多小组,1个小组就是1个OTU(可操纵分类单元,Operational Taxonomic Units)。根据不同的相似度水平,对所有序列进行OTU划分,通常对97%及以上相似水平的OTU进行生物信息统计分析。
1.4 数据分析
使用mothur 1.43.0软件计算群落丰富度指数(Chao指数、Ace指数)、群落多样性指数(Shannon 指数、Simpson指数)和样品覆盖率;使用R软件v3.6.0绘制稀释曲线和等级分布曲线并进行结构分析及聚类分析;使用STAMP v1.1进行显著性分析;通过对组间样本进行比较,在各分类水平上找出两组中具有显著差异的物种。
2 结果与分析
2.1 棘胸蛙皮肤样本16sRNA测序结果
由表1可知,棘胸蛙6个皮肤样本16sRNA的扩增和测序,共得到有效读长684 478条,平均每个样品114 080条。所有样品测序覆盖度均为100%,表明测序比较真实反映各样品的微生物组成。

表1 各样品OTUsTable 1 OTUs of each sample
2.2 棘胸蛙皮肤菌群多样性分析
对患烂皮病棘胸蛙的6个皮肤样本的测序数据经过OTU比对后,绘制了不同样品的稀释曲线,由图2A可知,所有的样品稀释曲线均随序列数量的增加而趋于平缓,表明所测的数据量已经可以反映微生物群落结构和多样性。同时,对样品绘制等级分布曲线,由图2B可知,在水平方向上,健康皮肤组的曲线在横轴上的跨度大于溃烂皮肤组,表明棘胸蛙健康皮肤的微生物物种数目高于溃烂皮肤,同时在垂直方向上健康皮肤组的曲线比溃烂皮肤组陡峭,表明棘胸蛙健康皮肤中存在相对丰度明显占优的细菌种类。
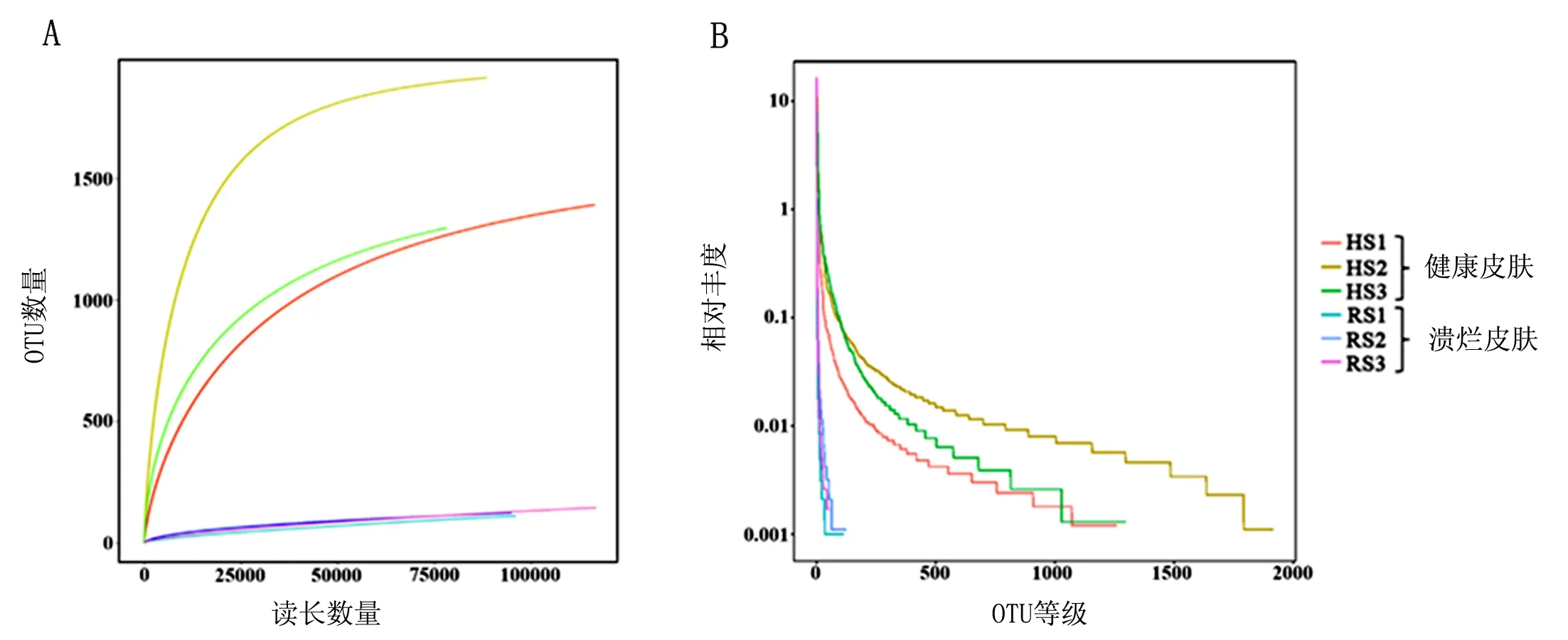
注:A为健康皮肤与溃烂皮肤样品的稀释度曲线;B为健康皮肤与溃烂皮肤样品细菌多样性的等级分布曲线。图2 健康皮肤与溃烂皮肤样品的稀释度曲线和等级分布曲线Fig.2 Curves of the rate of dilution and grade distribution for the samples of healthy skin and ulcerated skin
从表2可知,健康皮肤组微生物的ACE指数、Chao 1指数均高于溃烂皮肤组,表明患烂皮病棘胸蛙健康皮肤中微生物的物种数目高于溃烂皮肤。健康皮肤组微生物的Shannon指数高于溃烂皮肤组,并且Simpson指数低于溃烂皮肤组,表明在微生物多样性方面,棘胸蛙健康皮肤中微生物的菌群多样性高于溃烂皮肤。最后,所有6个样品的覆盖率均为1,表明了测序深度合理,能饱和覆盖到样品中的微生物种群。

表2 各样品高通量测序结果分析Table 2 Analysis of the high-throughput sequencing results of each sample
2.3 棘胸蛙皮肤菌群结构分析
首先从细菌分类的门水平上对健康皮肤组和溃烂皮肤组的细菌群落组成进行比较。由图3A可知,健康皮肤的优势菌门是蓝细菌门/叶绿体(Cyanobacteria Chloroplast,50.7%)、变形菌门(Proteobacteria,21.99%)、厚壁菌门(Firmicutes,7.88%)、拟杆菌门(Bacteroidetes,3.6%)、放线菌门(Actinobacteria,2.27%),其他门类占比不足1%。由图3B可知,溃烂皮肤的优势菌门是变形菌门(Proteobacteria,98.88%),其他门类占比不足1%。其中健康皮肤和溃烂皮肤的菌群结构存在显著差异。除变形菌门Proteobacteria为健康皮肤和溃烂皮肤的共有优势菌门之外,健康皮肤和溃烂皮肤的优势菌门均不相同。
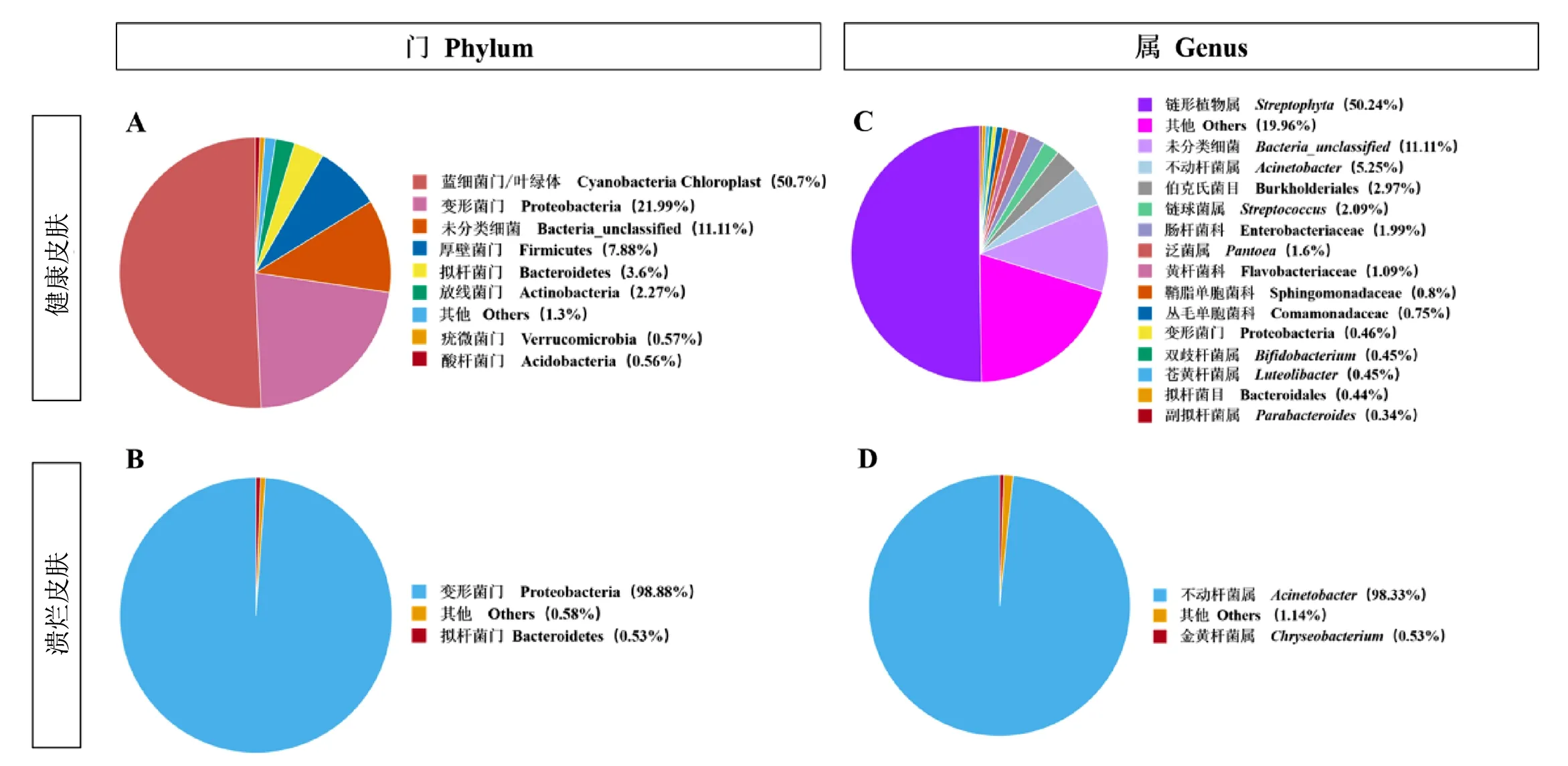
注:A为基于门水平的健康皮肤菌群相对丰度;B为基于门水平的溃烂皮肤菌群相对丰度;C为基于属水平的健康皮肤菌群相对丰度;D为基于属水平的溃烂皮肤菌群相对丰度。图3 健康皮肤与溃烂皮肤的菌群相对丰度(基于门和属水平)Fig.3 Relative abundance of the microflora in the healthy skin and ulcerated skin (based on the phylum and genus levels)
其次,在细菌分类的属水平上,共鉴定出15个主要属。由图3C可知,健康皮肤的主要优势菌属为链形植物属(Streptophyta,50.24%)、不动杆菌属(Acinetobacter,5.25%),其他菌属不足5%。由图3D可知,溃烂皮肤的主要优势菌属为不动杆菌属(Acinetobacter,98.33%),其他菌属不足5%。其中不动杆菌属为健康皮肤和溃烂皮肤的共有属,溃烂皮肤中的不动杆菌属的含量显著高于健康皮肤。链形植物属为健康皮肤特有的细菌种属。
2.4 棘胸蛙皮肤菌群结构差异分析
2.4.1样品聚类分析 根据OTU的类型将所有样品进行聚类分析,结果见图4。在细菌分类的门和属水平上,所有样品均明显聚成2大支,一支为健康皮肤组样品,另一支为溃烂皮肤组样品,表明2组样品之间存在明显的差异。
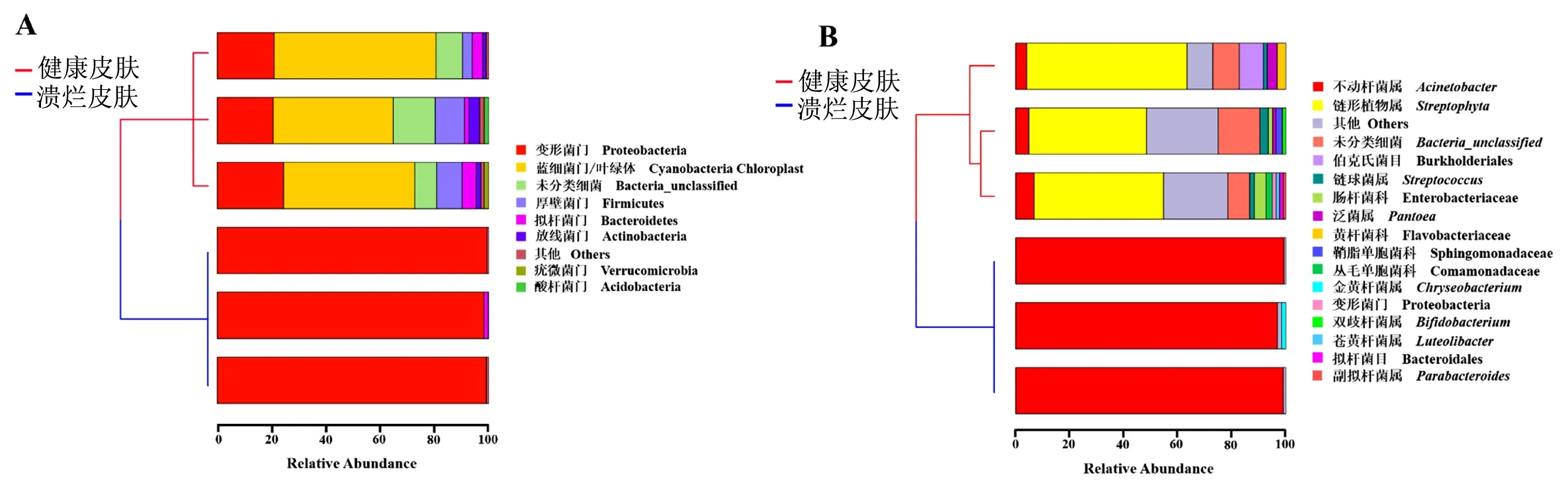
注:A为基于门水平的健康皮肤与溃烂皮肤菌群结构聚类分析;B为基于属水平的健康皮肤与溃烂皮肤菌群结构聚类分析。图4 聚类分析健康皮肤与溃烂皮肤的菌群结构(基于门和属水平) Fig.4 Cluster analysis of the microbial community structure of healthy skin and ulcerated skin (based on the phylum and genus levels)
2.4.2显著性差异分析 为了进一步解析棘胸蛙健康皮肤与溃烂皮肤在属水平上细菌群落结构的差异性,将两组样本利用STAMP 进行显著性差异分析。由图5可知,健康皮肤组与溃烂皮肤组的菌群存在显著差异,不动杆菌属在溃烂皮肤中大量存在。而链形植物属在健康皮肤中的细菌数高于溃烂皮肤。
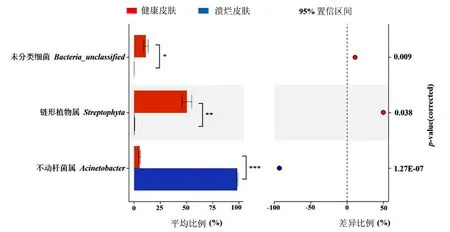
注:左栏为不同细菌菌群在两组样本中的比例情况,右栏为95%置信度区间内的差异比例,右栏纵轴为p值。图5 健康皮肤与溃烂皮肤的差异细菌菌群(基于属水平)Fig.5 Differential bacterial community between the healthy skin and the ulcerated skin (based on the genus level)
3 讨论与结论
疾病暴发是棘胸蛙养殖业健康发展的主要障碍。在养殖过程中,主要的疾病是体表有溃烂伤口的烂皮病。由于蛙没有毛皮或羽毛,不断地暴露在外部环境的影响下,生活在动物皮肤上的微生物群落被认为是疾病易感性的媒介,提供了抵御病原体的第一道防线[11-12]。尽管不同个体之间的水平传播(例如在交配期间)或垂直传播(即亲代传给后代,尽管不常见)也是潜在的病原菌来源,但是蛙类微生物组的主要来源是外部的水生和土壤环境,它们被认为是蛙皮微生物群的储存库。目前研究表明,蛙表皮的微生物组具有物种特异性,这些微生物组成受到季节性变化、采样个体、生命阶段、身体部位、饮食、捕获地点、栖息地、圈养、接触人为污染物和抗生素治疗的影响[13-15]。因此,在本研究中只考虑属于同一物种、同一发育阶段、同一地点的不同个体标本,同时还在同一个个体上分别分析了健康皮肤和溃烂皮肤的细菌多样性,目的是将皮肤感染性疾病的存在与构成皮肤微生物区系的其他因素隔离开来。
本试验结果也证实16sRNA片段高通量测序与其他依赖培养或不依赖培养的方法相比,可以更深入地检查皮肤细菌群落的组成。Woodhams等[9]从黄腿蛙Ranamuscosa的皮肤中培养出40个独特的细菌分离物,仅属于3个不同的门类。本研究中所有健康皮肤样本的细菌群落由有限的门类主导,即蓝细菌门/叶绿体(50.7%)、变形菌门(21.99%)、厚壁菌门(7.88%)、拟杆菌门(3.6%)和放线菌门(2.27%),这些门类与类似研究中发现的主导门类基本相同[12, 16-18]。而棘胸蛙溃烂皮肤中细菌群落的优势菌门只有变形菌门(98.88%),变形菌门在溃烂皮肤中高度富集。这些结果与Federici等[12]的研究结果不同,他们在健康和患病的意大利河蛙Ranaitalica中观察到相似的细菌门类丰度,但细菌门类不同。而Hu等[19]在健康和患病的虎纹蛙Hoplobatrachusrugulosus中观察到相似的细菌门类,但细菌门类丰度不同。在属水平上,健康皮肤中细菌群落的主要优势菌属为链形植物属(50.24%)、不动杆菌属(5.25%)。溃烂皮肤中细菌群落的优势菌属为不动杆菌属(98.33%)。这些结果与Federici等[12]的研究结果不同,并未有与本研究相同的优势菌属。而Hu等[19]在虎纹蛙的研究中,除不动杆菌为健康和患病虎纹蛙皮肤菌群的共有优势菌属、并且溃烂皮肤中的不动杆菌属含量明显高于健康皮肤之外,其他优势均属均不相同。
不动杆菌是一种专性需氧细菌,它普遍存在于皮肤以及土壤、水和植物根际[20]。不动杆菌的功能在以前的几个研究中是相互矛盾的。一方面,据广泛报道,不动杆菌在医院和其他医疗机构引起感染和流行传播,对医疗系统构成巨大威胁[21]。另一方面,它们对于生物膜的形成是必要的,并有助于构建和保护其他生物系统中的微生物群落[22]。在本研究中,溃烂皮肤中的不动杆菌属丰度明显高于健康皮肤。这一结果与先前对虎纹蛙皮肤的细菌微生物组评估结果一致[19]。可以得出,本研究中棘胸蛙溃烂皮肤上发现的不动杆菌丰度剧增对于棘胸蛙的健康状态是有害的。
本研究中发现,健康皮肤和溃烂皮肤菌群多样性及结构存在显著差异。相比于溃烂皮肤,健康皮肤的细菌多样性更高,根据多样性抗性假说,微生物群落越多样化,寄主越有可能抵抗病原菌入侵[23]。这一结果与意大利河蛙的结果相似,健康皮肤样本的微生物群多样性明显较高[12]。相反,在虎纹蛙的研究中,没有发现蛙个体的健康皮肤和溃烂皮肤的菌群多样性存在显著差异,健康皮肤和溃烂的蛙的皮肤微生物丰富度和均匀度是相似的[19]。因此利用菌群多样性来评估宿主健康是有限的。同时,健康皮肤和溃烂皮肤的细菌群落结构明显不同,表明细菌群落与棘胸蛙烂皮病的感染发病之间可能存在一定的关系。有研究发现,当蛙的皮肤处于健康状态时,健康的皮肤也寄生着大量的致病菌,这些菌群在皮肤表面相互作用形成微生态平衡[18, 24],健康皮肤上的共生微生物占据了广泛的生态位,并有效地保护个体免受病原体的侵害[25]。而这种平衡一旦被打破,皮肤微生物群的改变可能会导致病原菌的增加。病原菌的入侵破坏了健康皮肤菌群的组成,皮肤微生物群失调可能会导致宿主的疾病易感性[13, 18, 26-30]。
此外,研究人员广泛研究了两栖动物皮肤微生物组的致病细菌和有益细菌[31-32]。益生菌在水产动物生产中越来越多地被用作添加剂,以提高动物的生长、免疫和抗病能力,并作为水质调节剂改善水质[33],但非宿主来源的益生菌在使用过程中存在潜在风险,因此更值得关注和探索宿主来源的益生菌。本研究中,发现双歧杆菌Bifidobacterium等潜在益生菌存在于棘胸蛙健康皮肤中。而链球菌Streptococcus、泛菌Pantoea、副拟杆菌Parabacteroides、肠杆菌科Enterobacteriaceae、黄杆菌科Flavobacteriaceae、鞘脂单胞菌科Sphingomonadacea、金黄杆菌属Chryseobacterium等水生动物常见的条件致病菌均有发现,这些发现为棘胸蛙益生菌的开发和细菌性疾病的防控提供了参考。
总之,皮肤菌群与动物皮肤的免疫功能密切相关,建立良好的宿主皮肤-微生物生态系统对维护宿主健康非常必要。本研究结果表明,棘胸蛙健康皮肤和溃烂皮肤的菌群多样性和结构存在显著差异。蓝细菌门/叶绿体、变形菌门、厚壁菌门是棘胸蛙健康皮肤微生物的优势菌门,变形菌门中的不动杆菌属在棘胸蛙溃烂皮肤中高度富集,这说明健康皮肤状况与棘胸蛙的皮肤菌群结构密切相关。然而本研究在棘胸蛙的健康皮肤和溃烂皮肤中检测到的明显不同的菌属如何参与皮肤的免疫功能,都是值得进一步开展研究的。
