原位肝移植术后早期肝功能不全的相关危险因素分析
2022-02-18苏洋丁佑铭汪斌陈辰赵凯亮吴英珂熊豪
苏洋,丁佑铭,汪斌,陈辰,赵凯亮,吴英珂,熊豪
武汉大学人民医院肝胆腔镜外科,湖北 武汉 430060
肝移植是目前治疗各种终末期肝病最有效的治疗手段。由于移植术后病人体内诸多剧烈的病理生理学变化,导致肝移植早期并发症的发生率居高不下[1]。而早期肝功能不全(early allograft dysfunction, EAD)作为肝移植术后常见的并发症之一,严重影响术后移植物的功能和病人的生存。据相关文献报道,肝移植术后EAD的发生率为14%~40.8%不等[2-3]。EAD的发生与多种因素有关,如供者、受者及手术相关因素。目前许多研究证实了一些EAD的供者相关危险因素,例如供者年龄、供者体质量指数、供肝脂肪变性、供者术前高钠血症以及冷热缺血时间等[3-4]。因此,本次研究旨在分析武汉大学人民医院完成的74例原位肝移植病人的临床资料,研究移植术后EAD的发生情况,并探讨EAD发生的危险因素,从而有助于临床医生识别高危病人、积极预防,以期减少病人术后EAD的发生,改善病人术后生存率。
资料与方法
一、研究对象
回顾性收集2016年1月至2020年12月间武汉大学人民医院实施的74例肝移植受者资料。手术方式采用脑死亡供肝的经典原位肝移植术或背驮式原位肝移植术。术后均使用他克莫司联合吗替麦考酚酯抗术后排斥。纳入标准:(1)年龄≥18岁;(2)行首次原位肝移植;(3)供肝来源为脑死亡器官捐献。排除标准:(1)临床资料不完整;(2)行联合器官移植;(3)术中或术后24 h内死亡的病人。
二、临床指标收集
(1)一般资料:性别、年龄、原发疾病、术前合并疾病等。(2)术前血液指标:总胆红素(TBIL)、血清肌酐(Scr)、中性粒细胞与淋巴细胞比值(NLR)、血小板计数(PLT)、血红蛋白(Hb)、血清白蛋白(ALB)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转移酶(GGT)、血清钾离子(K+)、血清钠离子(Na+)、国际标准化比值(INR)、凝血酶原时间等。(3)手术指标:术中的失血量、术中血浆输入量、术中红细胞输入量、无肝期时间、手术时间等;依据指南对病人进行终末期肝病模型(MELD)评分、Child-Pugh分级、美国麻醉医师协会(ASA)评分。
三、术后EAD的诊断标准及分组
目前对于肝移植术后EAD的诊断尚无统一的标准,本文采用Olthoff等[5]的标准:(1)术后第7天TBIL≥171 μmol/L;(2)术后第7天INR≥1.6;(3)术后7 d内AST或ALT>2 000 U/L,以上有1种或以上情况出现即视为EAD。根据术后是否发生EAD,将74例受者分成EAD组和正常组。
四、统计学处理

结 果
一、一般资料
本研究共纳入74例行同种异体原位肝移植术病人,其中受者男性65例,女性9例;年龄(50.9±9.3)岁,年龄范围26~74岁;术前诊断为原发性肝癌39例、乙型肝炎肝硬化失代偿14例、慢性肝衰竭8例、急性肝衰竭3例、药物性肝衰竭2例、酒精性肝硬化5例、自身免疫性肝炎2例、多囊肝1例。在74例肝移植病人中术后共有27例(36.5%)病人发生EAD。
二、单因素分析
(一)受者因素
EAD组(27例)和正常组(47例)受者的一般情况指标和血液指标详见表1及表2。两组受者在性别、年龄、原发疾病、ASA分级、术前PLT、术前Hb、术前血清ALB、术前ALP、术前GGT、术前Scr、术前血清Na+、术前血清K+、术前住院时间、术后ICU时间、机械通气时间方面比较差异均无统计学意义(均P>0.05)。两组受者术前TBIL(P=0.002)、术前NLR(P<0.001)、术前肝功能Child-Pugh分级C级(P<0.001)、术前MELD评分≥18分(P<0.001)及移植术后出现胆道及血管并发症(P=0.011)比较差异有统计学意义。
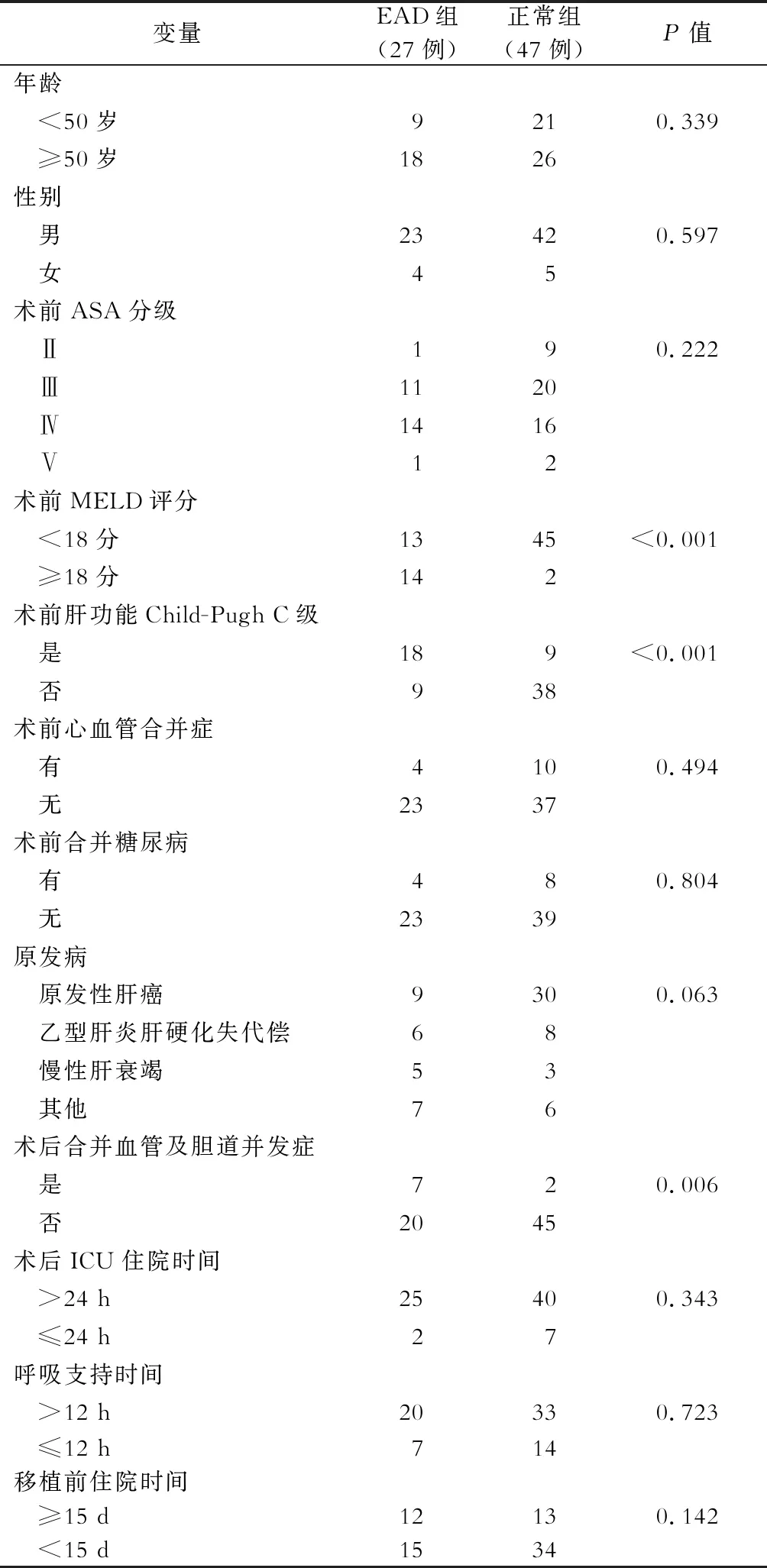
表1 早期肝功能不全(EAD)危险因素单因素分析(受者一般情况指标,例)
(二)手术因素
EAD组和正常组的手术指标见表3。
两组在手术时间、术中血浆输入量、术中红细胞输入量及无肝期时间比较差异均无统计学意义(均P>0.05)。术中失血量比较差异有统计学意义(P=0.014)。
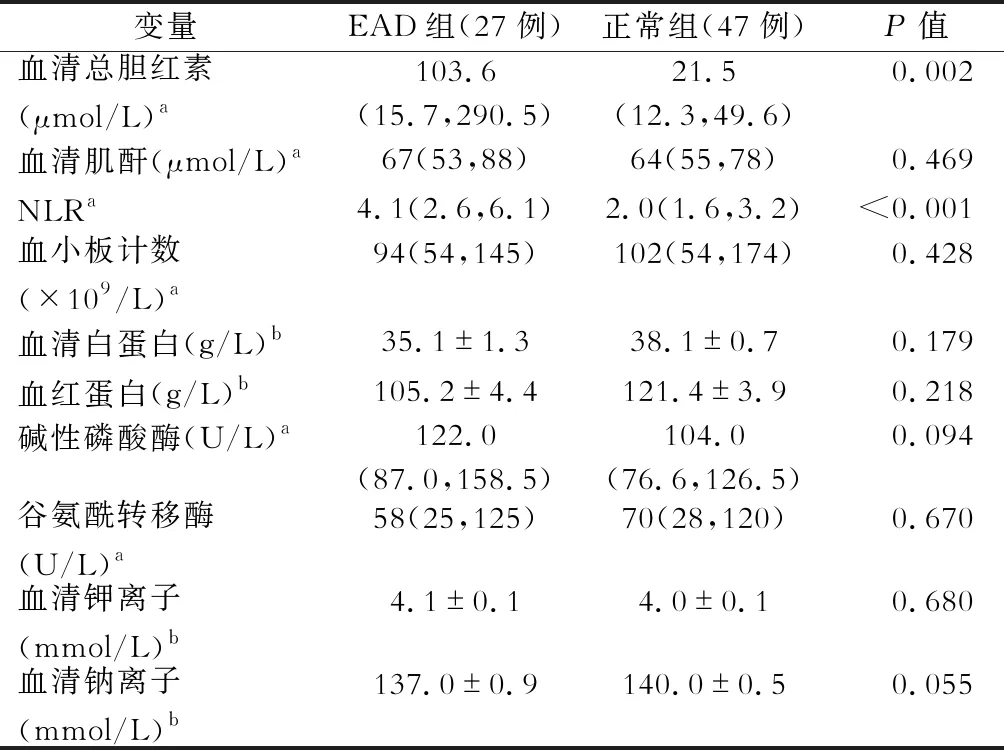
表2 早期肝功能不全(EAD)危险因素单因素分析(受者术前血液指标)
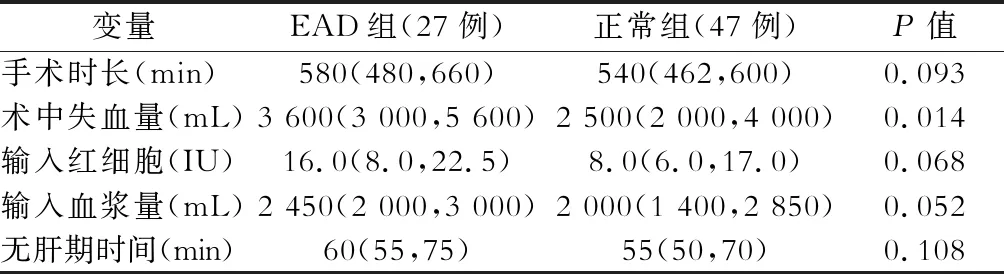
表3 早期肝功能不全(EAD)危险因素(手术指标)单因素分析[中位数(P25,P75)]
三、多因素分析
结果详见表4。多因素Logistic回归分析结果提示:术前MELD评分≥18分[OR=0.045,95%CI(0.003,0.605),P=0.045]及术后出现胆管及血管并发症[OR=0.061,95%CI(0.009.0.419),P=0.004]是影响肝移植术后EAD独立危险因素。其他因素包括术前NLR、术前TBIL、术前肝功能Child-Pugh分级C级及术中失血量在多因素分析中差异无统计学意义。
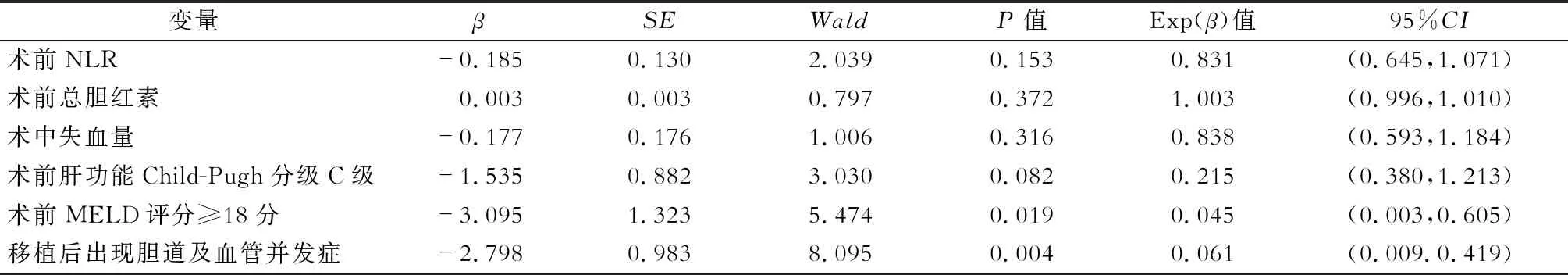
表4 多因素Logistic回归分析结果
讨 论
EAD是肝移植术后常见且严重的并发症,与受者的预后密切相关;而肝移植术后EAD是多因素作用的结果,主要与供者、受者及手术因素有关。到目前为止,有关肝移植术后EAD的相关危险因素研究较少,并且研究结果有差异,这可能与受试者人群不同、医生手术技术的差异及EAD定义标准不同有关。
肝缺血再灌注损伤(IRI)是肝移植术后EAD发生的公认病理生理机制[6]。中性粒细胞是参与缺血再灌注损伤过程最主要的炎症介质,中性粒细胞浸润及细胞因子和趋化因子激活引起的炎症反应导致氧自由基的大量释放。此外,中性粒细胞通过阻塞小毛细血管,导致肝血管的回流受阻,从而影响移植肝的再灌注过程并加剧肝损伤[6]。受者术前NLR是反应全身炎症状态的生物指标,反映了先天性和适应性免疫功能之间的平衡。已有研究指出,术前NLR的水平是胃癌[7]、肝癌[8]、乳腺癌[9]等恶性肿瘤预后的重要危险因素。Nylec等[10]对134例肝移植病人的数据分析发现,受者术前NLR≥5.48 是肝移植术后 1 年移植物丢失和受者死亡的独立预测因素(P=0.008)。另外,Kwon等[11]报道,术前NLR≥2.85是肝移植术后EAD的有效预测指标,并且肝移植术后1年内移植肝衰竭和受者死亡率更高。本研究中NLR对肝移植术后EAD的发生具有一定的预测价值,但并不是EAD发生的独立危险因素,可能是因为该研究样本量较小或血液中淋巴细胞及中性粒细胞不稳定,易受多种因素干扰。
终末期肝病病人往往伴随着肝功能异常,肝脏处理胆红素的能力下降,此时胆红素的肠肝循环受损,病人可能会出现血清胆红素水平居高不下。Pomposelli等[12]对631例肝移植受者临床资料分析发现,术前高胆红素血症与肝移植术后EAD的发生有关。病人术中失血量过多往往需要大量输血,通常会导致凝血病、体温过低、酸中毒和电解质异常。术中大量出血及输血均会增加移植术后受者死亡的风险[13]。Ko等[14]研究发现术中失血量超过2 902 mL的可显著预测移植术后EAD的发生。肝功能Child-Pugh分级标准是临床上最常见的评估肝脏储备能力的指标之一。当病人肝功能处于Child-Pugh分级C级时,则证明病人肝功能比较差。蔡振兴等[15]把术前肝功能Child-Pugh分级C级归为EAD发生的独立危险因素。本研究中亦显示血清总胆红素水平较高、术中失血量过多、术前肝功能Child-Pugh分级C级是肝移植术后EAD发生的潜在危险因素。仍需更多大样本研究以进一步探讨其预测价值。
在全球大多数肝脏移植中心,MELD评分常常被用作确定肝移植器官分配优先权的标准,它是应用血清胆红素、凝血酶原时间国际标准化比值和血清肌酐指标来评价终末期肝病病人的系统,它可有效预测肝移植前病人等待供肝期间的死亡率及预测病人移植术后的死亡率,并且还可以反映移植物功能和病人的状况[16]。王婷婷等[17]报道,术前MELD评分≥20分是肝移植病人术后EAD发生的独立的危险因素。本研究中我们亦发现术前MELD评分≥18分是原位肝移植术后发生EAD的独立危险因素。
由于肝移植外科技术的复杂性,移植术后可能出现胆道及血管并发症,较为常见的是胆管狭窄及肝动脉血栓。本研究中,肝移植术后出现了肝动脉血栓3例、胆管狭窄5例、门静脉血栓1例,这些受者术后均出现EAD。当受者出现胆道及血管并发症时,病人肝功能可能急剧受损。到目前为止,关于肝移植术后合并胆道及血管并发症与肝移植术后EAD的关系研究较少。本研究发现,肝移植术后合并胆道及血管并发症是肝移植术后EAD的独立危险因素。
综上所述,术前MELD评分≥18分及移植术后出现胆道及血管并发症是肝移植术后发生EAD的独立危险因素,同时受者术前中性粒细胞与淋巴细胞比值、无肝期时间过长、术中失血量过多及术前肝功能Child-Pugh分级C级是肝移植术后发生EAD的潜在危险因素。临床上应该通过改善受者术前较差的肝功能和提高临床医师手术技巧来降低EAD的发生率。
利益冲突所有作者均声明不存在利益冲突
