BCLC 0~A期肝细胞癌病人R0切除术后肝外转移风险预测列线图的构建
2022-02-18陈姚张万广陈孝平陈义发
陈姚,张万广,陈孝平,陈义发
华中科技大学同济医学院附属同济医院肝脏外科,湖北 武汉 430030
2018年世界卫生组织全球癌症报告显示:肝癌在癌症新发人数中排名第6位,在癌症相关死亡中排名第4位。整体而言,肝癌的5年生存率仅为12.1%~18%[1-2],长期预后不能令人满意[3]。虽然肝细胞癌(hepatocellular carcinoma,HCC)肝外转移的发病率相对较低(13.5%~25.8%),但是其治疗选择及效果相对有限,因此病人获得良好预后的概率也很低[4-6]。目前,尚缺少有效的评估工具用于预测肝切除术后HCC病人发生肝外转移的风险。因此,本研究的目的是构建术前预测巴塞罗那临床肝癌分期系统(BCLC)0~A期HCC病人肝切除术后肝外转移风险预测列线图。它可能有助于术者对肝外转移情况进行预估判断和提前干预。
资料与方法
一、病人选择
收集2014年1月1日至2016年12月31日在华中科技大学同济医学院附属同济医院肝脏外科就诊且符合纳入标准的HCC病人临床资料,并进行回顾性分析。纳入标准:(1)病人无其他手术禁忌证;(2)经实验室检验、影像学检查和(或)病理结果证实为HCC;(3)手术前未接受其他抗肿瘤治疗,如手术、经动脉化疗栓塞、局部消融或其他分子靶向药物治疗等;(4)无其他恶性肿瘤病史;(5)HCC分期处于BCLC 0期或A期;(6)手术根治程度符合R0切除标准;(7)肝切除术后恢复良好,顺利出院;(8)出院后规律随访,且病史资料完整。根据肝切除术后首次复发部位是否包含肝脏以外其他器官,病人被分为肝外转移组与非肝外转移组。本研究获得了医院医学伦理委员会的批准。
二、临床资料以及相关定义、方法
术前相关临床资料见表1。病毒性肝炎包括乙型及丙型病毒性肝炎。肿瘤包膜及肿瘤内部坏死通过典型影像学表现进行判断(肿瘤边缘清楚及边缘不同强化表现的环形区等;瘤内出现液性无回声、低密度或低信号表现等)。门静脉高压症:胃镜检查发现食管胃底静脉曲张,或脾大且血小板计数(PLT)<100×109/L[7-8]。白蛋白-胆红素(ALBI)评分=0.66×log10[胆红素(μmol/L)]-0.085×[白蛋白(g/L)][9]。终末期肝病模型(MELD)评分=3.8×ln[胆红素(mg/dL)]+11.2×ln[国际标准化比值]+9.6×ln[肌酐(mg/dL)]+6.4×[病因:0.胆汁淤积或酒精,1.其他][10]。R0切除标准:肉眼可见的肿瘤被完全切除且标本切缘在显微镜下未见癌细胞[11]。
随访程序:每次随访时间间隔不超过3个月,随访内容主要包括实验室检验[甲胎蛋白(AFP),肝功能,血常规,必要时进行肝炎病毒定量测定]和上腹部超声检查(必要时进行超声造影,CT增强或磁共振扫描等)。肝外转移主要通过AFP、影像学检查(两种及以上)和(或)病理学检查综合判断,并详细记录复发肿瘤的大小、数目、转移部位和时间等信息。随访截止日期为2019年1月。
三、统计分析

结 果
一、一般临床资料特征
本研究共纳入了351例病人,包含肝外转移组36例(10.3%)和非肝外转移组315例(89.7%)。详见表1。

表1 351例病人基本临床资料特征
二、肝外转移风险预测模型的构建与预测表现的评估
术前相关临床资料Logistic回归分析并构建肝外转移风险预测模型,详见表2。肝外转移的独立危险因素包括:AFP分级[比值比(OR)=1.580, 95%置信区间(CI):(1.182,2.144),P=0.002],肿瘤直径[OR=1.103, 95%CI(1.002,1.209),P=0.039],瘤内坏死(是)[OR=2.379,95%CI(1.042,5.222),P=0.034]。
肝外转移风险预测模型预测能力评价:AUC的值为0.740,95%CI(0.663,0.816)。TNM分期、BCLC分期和日本综合分期系统(JISS)AUC的值分别为0.616,95%CI(0.513,0.719);0.502,95%CI(0.402,0.602);0.606,95%CI(0.504,0.708)。与TNM、BCLC、JISS分期相比,肝外转移风险预测模型AUC的值更大,且差异具有统计学意义(TNM分期P=0.041,BCLC分期P<0.001,JISS分期P=0.037,图1)。此外,该模型通过了H-L拟合优度检验(P=0.653),这反映了该模型预测风险与实际发生风险具有较好的一致性。

注:TNM.肿瘤-淋巴结-远处转移;BCLC.巴塞罗那临床肝癌分期系统;JISS.日本综合分期系统。图1 肝外转移风险预测模型的曲线下面积
三、肝外转移风险预测列线图的构建及预测表现的评估
为了更直观和方便应用,我们在风险预测模型的基础上构建了风险预测列线图(图2)。通过观察肝外转移风险预测列线图校准曲线,我们发现在大部分范围内列线图的校准曲线与理想曲线贴近,预测表现较好(图3)。
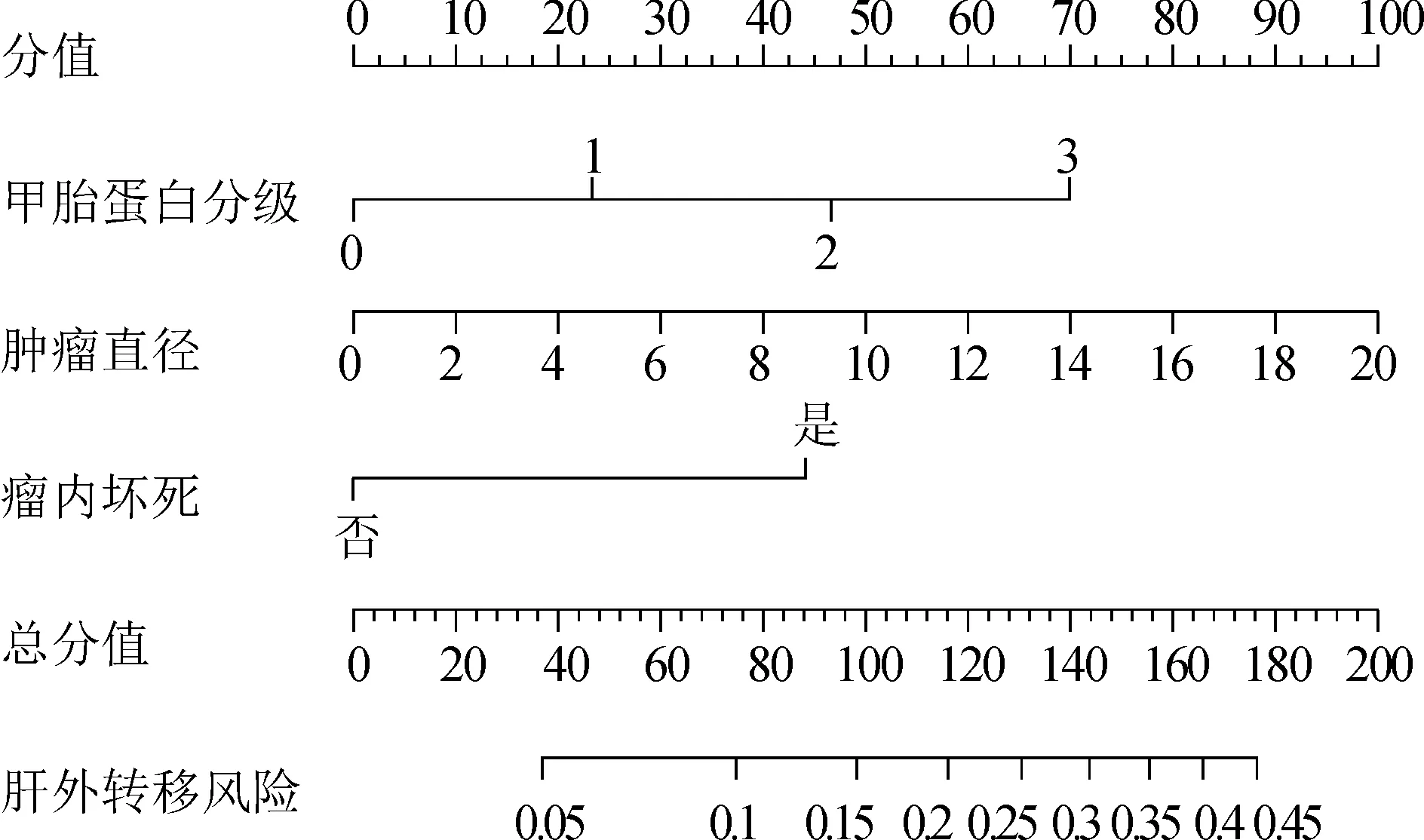
图2 肝外转移风险预测列线图
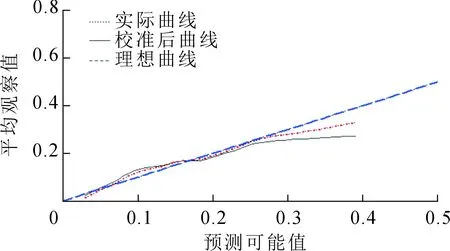
图3 肝外转移风险预测列线图的校准曲线
四、肝外转移风险预测模型临床应用价值评价
我们应用临床决策曲线来评估肝外转移风险预测模型、TNM分期、BCLC分期和JISS分期在预测肝外转移风险方面的临床应用价值。通过观察肝外转移风险模型的临床决策曲线,我们发现在大部分风险阈值范围内,肝外转移风险预测模型在预测肝外转移风险方面,比TNM分期、BCLC分期和JISS分期获得了更多的净收益,临床应用价值更大(图4)。

注:TNM.肿瘤-淋巴结-远处转移;BCLC.巴塞罗那临床肝癌分期系统;JISS.日本综合分期系统。图4 肝外转移风险预测模型的临床决策曲线
讨 论
在全球范围内,肝癌是新发癌症的主要类型之一,也是癌症相关死亡常见的原因之一。虽然,随着治疗技术及方法的不断更新,HCC的治疗效果取得了长足的进步。但是,HCC肝外转移的治疗选择及效果不尽如人意[4-6]。此外,尚无有效的工具用于肝外转移风险的评估。因此,构建HCC病人肝切除术后肝外转移风险预测模型是有必要的。
本研究的结果表明,与现有临床应用的HCC分期相比,包括TNM分期、BCLC分期和JISS分期,我们构建的肝外转移风险预测模型(包括AFP分级、肿瘤直径以及瘤内坏死3个独立危险因素)对于肝外转移风险预测表现出了更好的能力。目前,有效的辅助治疗或新辅助治疗手段仍是缺少的,对于那些符合手术标准但处于高转移或高复发风险的人群来说,早期识别他们具有重要的临床意义[12]。对于这部分病人而言,可能选择更进一步的治疗措施有机会改善他们的预后,例如:在初次手术时扩大肝切除范围或者进入肝移植候选名单。同时,更密集地随访监测也可被采纳实施。值得一提的是,我们纳入模型的因素均能很便利地在术前获得,便于对个体进行术前评估。
已发表的研究认为血清AFP水平与HCC病人预后相关,AFP水平越高可能代表着病人的预后越差;通常而言,血清AFP浓度超过400 μg/L表示病人预后较差[13]。目前,相关研究显示AFP可以通过上调转移相关蛋白的表达,在促进肝癌细胞的侵袭和转移中起关键作用,因此,AFP可能成为治疗HCC的一个新的治疗靶点[14]。Ohba和他的同事认为高血清水平的AFP可作为HCC肝外转移的预测因子[15]。在本研究中,我们通过Logistic回归分析得到了血清AFP水平是肝外转移的独立危险因素,这与之前的相关研究结论一致。
肿瘤直径作为肝癌病人预后的关键因素已被各个版本的肝癌分期广泛采纳。同时,肿瘤直径也已经被应用于肝移植病人术后复发及转移风险的评估[16],研究结果显示肝移植后复发的风险随着肿瘤直径增大、数目的增加而增加。同样,传统观点认为随着肿瘤体积的增大出现微血管侵犯、卫星结节、大血管侵犯,甚至远处转移的概率也会随之增加。此外,相关研究显示肿瘤直径也被认为是肝外转移的独立危险因素[17-18]。这与本研究结果一致。
肿瘤内部出现坏死常与原发性肝脏恶性肿瘤病人较差的预后相关[19-20]。一般而言,HCC是一种高度血管化的实体肿瘤,具有丰富的血供,而出现瘤内坏死的原因可能与肿瘤生长旺盛,氧输送受损以及肿瘤微环境中炎症因子的增加相关[21-23]。现有数据显示肿瘤坏死对HCC病人的整体生存期、无肿瘤生存期以及术后复发转移均有负面影响;虽然肿瘤坏死的发生率随肿瘤大小而变化,但不论肿瘤大小,瘤内坏死均与整体生存降低相关[24]。其他一些研究认为,瘤内坏死部位新生血管系统的结构和功能异常,会导致肿瘤转移风险增加[25]。这些也均与我们的研究结果一致。
本研究也存在一定的局限性。首先,这是一项来自单个中心的回顾性研究,也是一项较小样本量的研究。其次,我们所构建的肝外转移风险预测模型只进行了内部验证,虽然表现出了较好的预测能力,但是仍需要进行外部验证以评估模型预测能力的可靠性。最后,由于本研究是回顾性的,一些重要的并且可能会影响肝外转移的临床因素由于没有被记录而无法进一步分析。
综上所述,BCLC 0~A期HCC病人R0切除术后肝外转移的独立危险因素包括AFP分级、肿瘤直径以及瘤内坏死。我们根据术前相关临床因素构建的肝外转移风险预测模型在识别这些高危病人方面表现出了较好的能力。在它的帮助下,对肝外转移高风险病人积极地采取相关干预措施,可能会进一步提高病人的预后。
利益冲突所有作者均声明不存在利益冲突
