合并感染并发症坏死性胰腺炎病人的致病菌微生物学特点及应对策略
2022-02-18卢炯地丁乙轩郑智郭玉霖曹锋李非
卢炯地,丁乙轩,郑智,郭玉霖,曹锋,李非
首都医科大学宣武医院普通外科 首都医科大学急性胰腺炎诊疗中心,北京100053
急性胰腺炎(acute pancreatitis,AP)是一种常见的外科急腹症,且其发病率呈逐年升高趋势,虽然绝大多数的AP属于轻型、自限性疾病,病死率极低,但随着病情的进展,约有20%的AP发展为坏死性胰腺炎(necrotizing pancreatitis, NP)[1-2],且有40%~70%的NP病人合并感染性并发症,通常预示着更差的预后,是NP病人病情复杂化的重要标志[1-5]。目前关于胰腺感染的研究主要集中于胰腺及胰周感染,对于胰外感染及共同感染的研究较少见。因此,我们收集并分析了2014年1月至2020年12月就诊于我院的NP病人的临床资料,分析其中存在感染性并发症病人的感染时间、感染部位及感染菌种,以期对合并感染的NP病人治疗策略有所帮助。
资料与方法
一、一般资料与纳入排除标准
回顾性收集2014年1月至2020年12月就诊于我院的NP病人的临床资料。纳入标准:增强CT或MRI检查结果符合NP表现的病人。排除标准:(1)既往有慢性胰腺炎急性发作史;(2)因胰腺炎近期有过腹部探查手术史;(3)因腹部手术造成的胰腺炎;(4)其他如内脏器官穿孔、出血、腹腔间隔室综合征等。
根据纳入和排除标准,本研究共纳入295例NP病人。男性198例,女性97例,年龄(49.5±15.4)岁,年龄范围为11~90岁。NP病人的病因分布:胆源性149例,高脂血症性93例,病因不明17例,经内镜逆行胰胆管造影术后14例,酒精性13例,复发8例,创伤后1例。本研究经首都医科大学宣武医院伦理委员会批准(〔2017〕036号)。
二、定义
1.AP 符合以下三项中两项的病人即可确诊为AP[1-2]:(1)急性发作的上腹部疼痛,向腰背部放射;(2)血淀粉酶和(或)脂肪酶高于正常值3倍及以上;(3)影像学检查(如腹部超声、增强CT、MRI)发现胰腺的典型病变。NP的定义为增强CT显示胰腺实质可见高低不同的密度影,在疾病早期多表现为胰腺实质无增强。根据Balthazar等[6]的研究结果将NP病人的胰腺坏死程度分为≤30%、>30%~50%、>50%。
2.感染性胰腺坏死(infected pancreatic necrosis, IPN) 符合以下任意一项的病人即怀疑存在IPN:(1)突发高热(≥38.5 ℃)或持续性发热(≥38.5 ℃)不退时;(2)白细胞计数及中性粒细胞百分比、炎症指标(C反应蛋白、白细胞介素6、降钙素原)显著上升;(3)新发器官功能衰竭或多器官功能衰竭等临床症状持续恶化。确诊方法:(1)增强CT提示“气泡征”;(2)穿刺或手术获取的胰腺坏死组织培养阳性。
3.胰外感染 出现AP病人胰腺以外部位的感染,常见的部位为血液、呼吸系统、泌尿系统、腹腔、胆道、手术切口[7-9]。当怀疑AP病人出现感染症状而在影像学上坏死胰腺组织内未见明确感染征象(气泡征),且坏死组织及脓液穿刺引流培养阴性时,可怀疑病人存在胰腺以外其他部位的感染,可通过多次、多部位的病原菌培养来确诊或排除[4-5,7-9]。
4.多重耐药菌 依据《多重耐药菌医院感染预防与控制中国专家共识》,指对常用的3类或3类以上抗菌药物同时呈现耐药的细菌。
三、病人管理
入院后,对确诊的NP病人(增强CT图像上可见高低密度影)常规给予禁食水、抑制胰酶分泌、液体复苏、镇痛、肠内(肠外)营养等支持治疗,病情危重的病人(如怀疑或确诊器官功能衰竭、感染症状)均入住监护室,并给予相关支持治疗(如机械通气、血液透析、升压药物持续性泵入等)。无菌性坏死病人多采用保守治疗的方式,对怀疑或确诊存在感染性并发症的NP病人,早期经验性应用抗菌药物控制感染(如碳青霉烯类或三代、四代头孢菌素),随后根据病人药物敏感试验结果选用合适抗菌药物。对NP病人的外科干预指征如下:(1)病人保守治疗后,临床症状无明显好转或持续恶化;(2)确诊病人存在胰腺感染灶;(3)病人无菌性坏死范围扩大,对周围器官产生压迫症状。多根据病人坏死部位选取不同的微创入路以清除坏死组织。
四、统计学方法
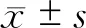
结 果
一、NP病人的基线资料
在295例NP病人中,出现感染性并发症215例(感染组),无菌性坏死80例(无菌组)。不同胰腺坏死程度的NP病人(感染组/无菌组)分别为:≤30%的病人164例(112/52),>30%~50%的病人77例(57/20),>50%的病人54例(46/8)。感染组和无菌组病人的计算机断层扫描严重程度指数(computer tomography severity index, CTSI)评分中位数均为6分(范围2~10分)。感染组病人转诊中位时间为30 d(范围1~300 d),无菌组病人转诊中位时间为14 d(范围1~120 d),差异有统计学意义(表1)。
二、感染的NP病人的病原菌菌谱
在215例已确诊存在感染性并发症的NP病人中,共培养出阳性菌种867株,其中172例病人存在IPN,共培养阳性菌株350株,较常见的革兰阴性菌为肺炎克雷伯菌、铜绿假单胞菌、大肠埃希菌及鲍曼不动杆菌(表2),较常见的革兰阳性菌为屎肠球菌、表皮葡萄球菌和人葡萄球菌,较常见的真菌感染为白色念珠菌(表2)。155例病人存在胰外感染,共培养阳性菌株517株,其中血液来源187株,呼吸道来源142株,泌尿道来源67株,静脉导管来源43株,腹腔来源37株,胆道来源32株,伤口来源9株。较常见的革兰阴性菌为鲍曼不动杆菌、铜绿假单胞菌、肺炎克雷伯菌及大肠埃希菌(表2),较常见的革兰阳性菌为屎肠球菌、表皮葡萄球菌和人葡萄球菌(表2),较常见的真菌感染为白色念珠菌(28株)。59例病人存在真菌感染(有混合感染),11例胰腺感染病人培养致病真菌11株,52例胰外感染病人(分别来源于血液20例、静脉导管3例、呼吸道2例、泌尿道27例)培养出88株致病真菌(表2)。
107例病人培养出多重耐药菌233株,其中胰腺来源128株,胰外感染105株,见表3、表4。
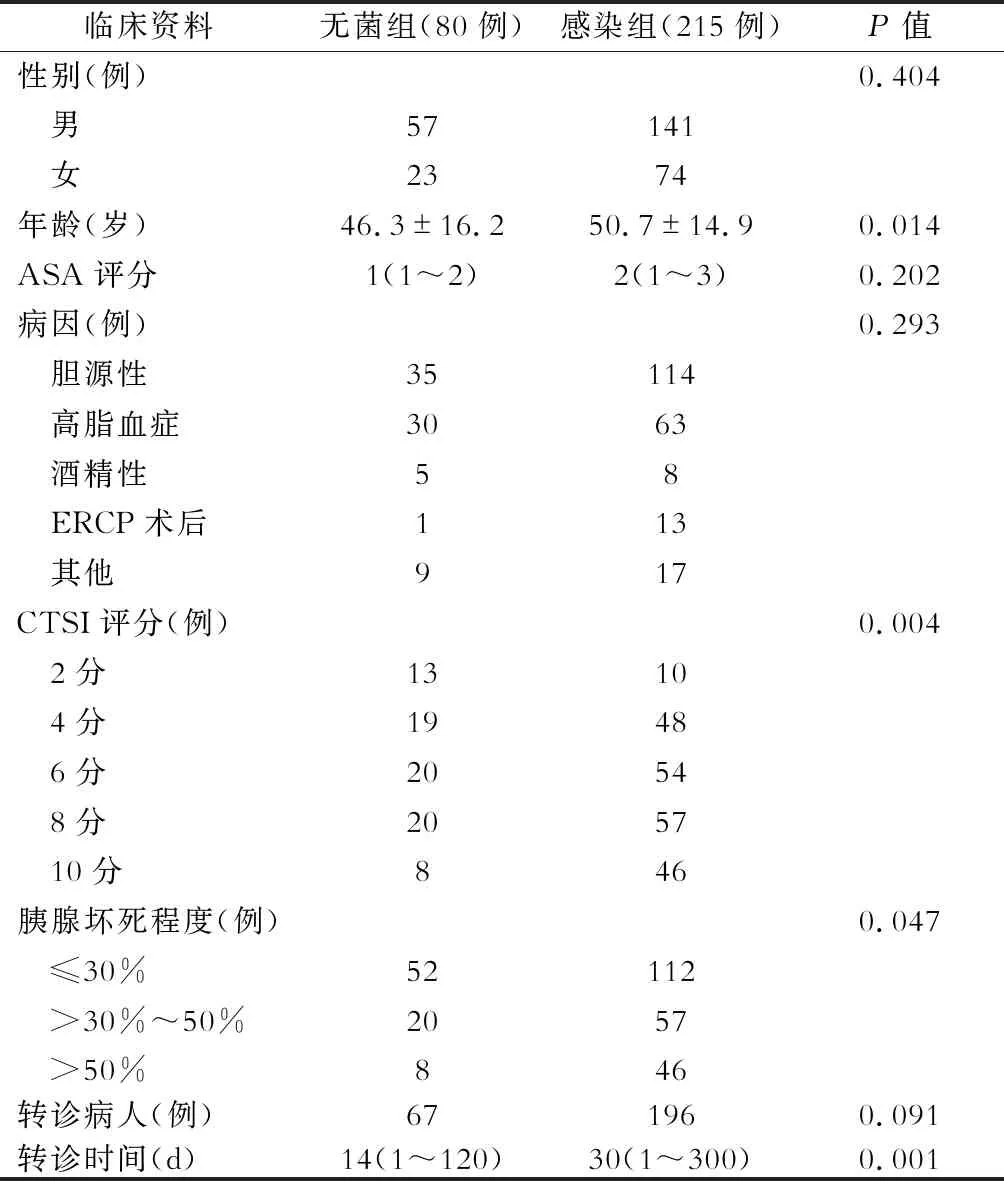
表1 无菌组与感染组坏死性胰腺炎病人临床资料的比较
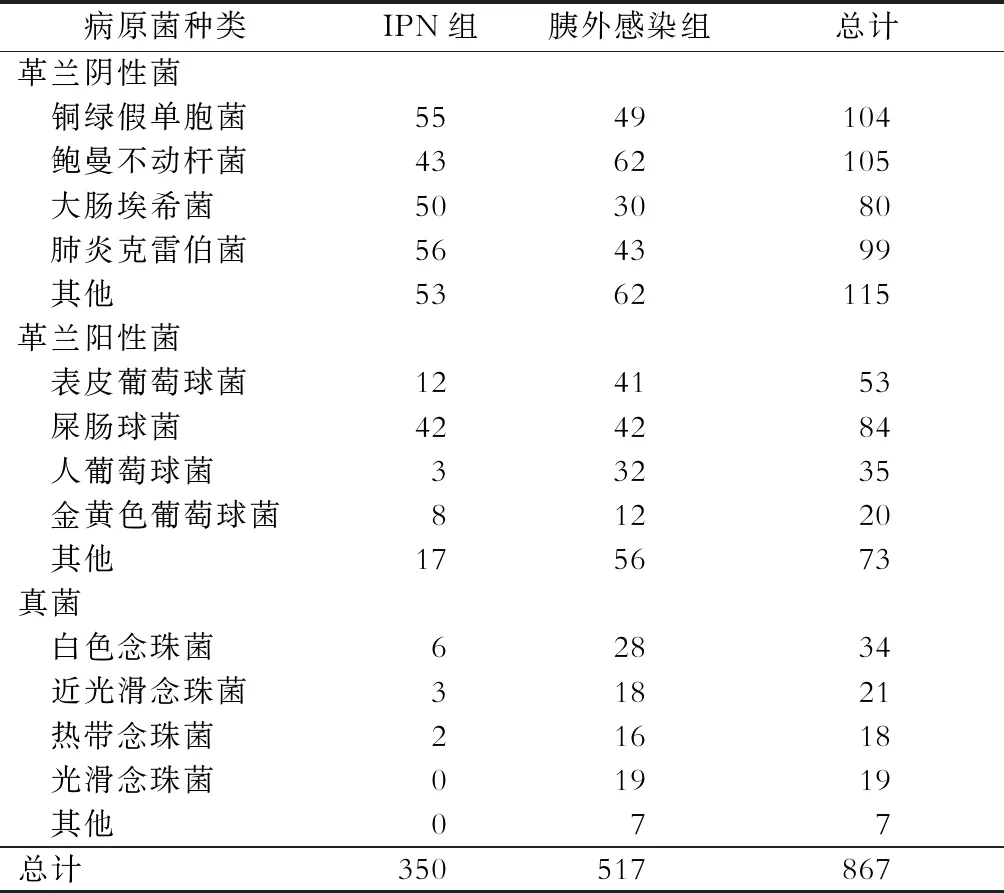
表2 合并感染性并发症的坏死性胰腺炎病人的病原菌菌谱(株)
三、感染的NP病人的病原菌药物敏感试验结果分析
(一)革兰阴性菌
胰腺组织来源中革兰阴性菌对一、二代头孢菌素及青霉素几乎全部耐药。较常见的大肠埃希菌对碳青酶烯、氨基糖苷类抗生素的敏感性较高;肺炎克雷伯菌和鲍曼不动杆菌对常用抗菌药物普遍耐药,对碳青霉烯类抗生素的耐药率亦超过50%,仅对四环素类、氨基糖苷类抗生素敏感性较高;铜绿假单胞菌对三、四代头孢菌素、加酶青霉素类抗生素敏感性较高。大肠埃希菌和肺炎克雷伯菌产超广谱β-内酰胺酶阳性菌株比例分别为54.0%(27/50)和37.5%(21/56)。胰外感染来源的革兰阴性致病菌的药物敏感性较低,以鲍曼不动杆菌、肺炎克雷伯菌多见,仅对四环素类、氨基糖苷类抗生素敏感性较高。大肠埃希菌及铜绿假单胞菌对三四代头孢菌素类、碳青霉烯类、氨基糖苷类抗菌药物敏感性尚可。其中大肠埃希菌和肺炎克雷伯菌产超广谱β-内酰胺酶阳性菌株分别为50.0%(15/30)和41.9%(18/43)。详见表3。
(二)革兰阳性菌
胰腺组织来源中的革兰阳性菌对四环素类、多肽类抗生素均敏感,但对其他抗生素耐药率较高,本研究组内病人未检出耐万古霉素肠球菌。除万古霉素、替加环素,较常见的屎肠球菌对大环内酯类敏感性较高,为85.7%(36/42)。金黄色葡萄球菌对喹诺酮类、青霉素类抗生素耐药性明显上升,对四环素类、多肽及大环内酯类抗生素高度敏感。本研究组内组病人未检出耐甲氧西林金黄色葡萄球菌。其中表皮葡萄球菌、金黄色葡萄球菌和人葡萄球菌产超广谱β-内酰胺酶阳性菌株分别占41.7%(5/12)、37.5%(3/8)、33.3%(1/3)。胰外感染来源的革兰阳性致病菌的敏感性略有差异,多数对大环内酯类、四环素类、多肽类抗菌药物高度敏感(>80%),其中表皮葡萄球菌、金黄色葡萄球菌和人葡萄球菌产超广谱β-内酰胺酶阳性菌株分别为36.6%(15/41)、50.0%(6/12)、59.4%(19/32)。详见表4。
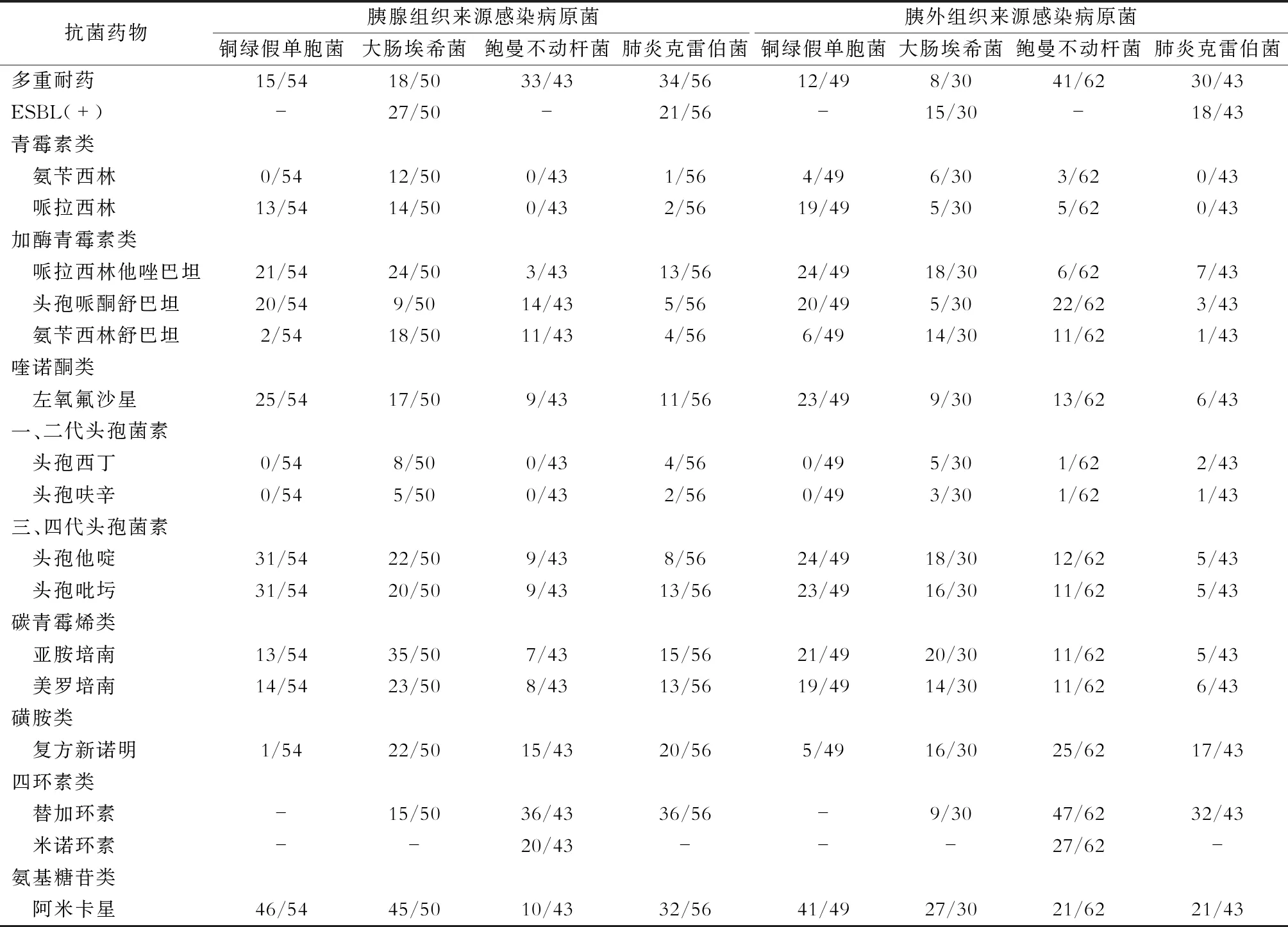
表3 感染病人的革兰阴性致病菌敏感药物分布表(敏感株数/总株数)
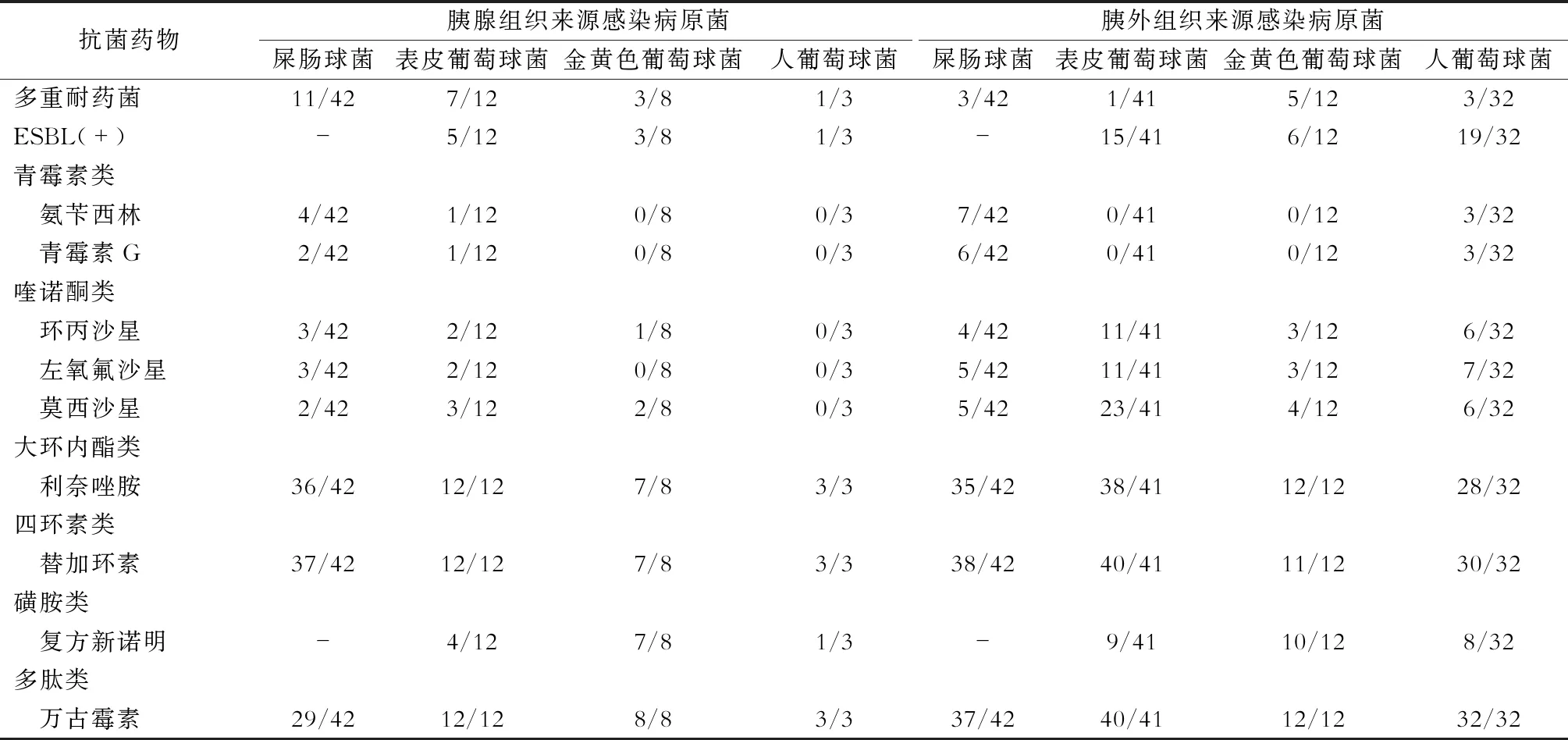
表4 感染病人革兰阳性致病菌敏感药物的分布(敏感株数/总株数)
(三)真菌感染
由NP病人的药敏结果可知,无论胰腺或胰外感染来源的致病真菌主要为白色念珠菌,对目前临床使用的抗真菌药物(如5-氟胞嘧啶、两性霉素B、氟康唑等)均敏感,见表5。
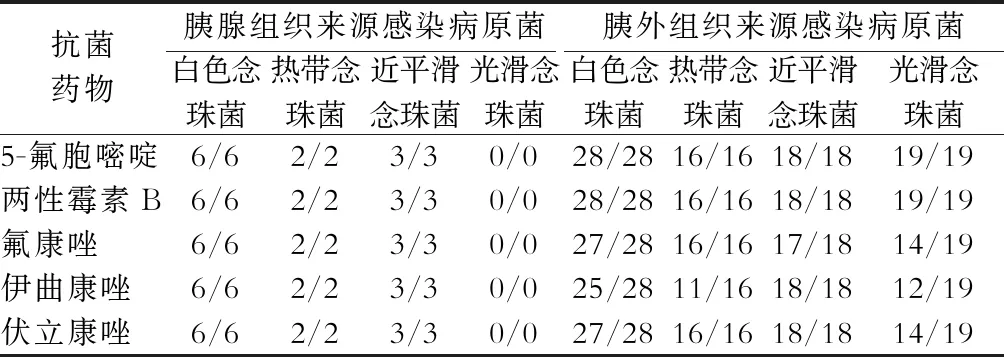
表5 感染病人的真菌敏感药物分布表(敏感株数/总株数)
(四)多重耐药菌
胰腺感染来源的常见革兰阴性杆菌的多重耐药率分别为:铜绿假单胞菌27.8%(15/54)、肺炎克雷伯菌60.7%(34/56)、大肠埃希菌36.0%(18/50)、鲍曼不动杆菌76.7%(33/43)。常见革兰阳性球菌多重耐药率为:屎肠球菌26.2%(11/42)。胰外感染来源的常见革兰阴性杆菌的多重耐药率分别为:铜绿假单胞菌24.5%(12/49)、肺炎克雷伯菌69.8%(30/43)、大肠埃希菌26.7%(8/30)、鲍曼不动杆菌77.3%(41/62)。常见革兰阳性球菌多重耐药率为:表皮葡萄球菌2.4%(1/41)、屎肠球菌7.1%(3/42)。详见表3、表4。
四、感染时间及部位
本研究中,胰外感染的感染时间为(9.8±9.0) d,胰腺感染时间为(14.6±13.5)d,差异有统计学意义(P<0.05)。在155例胰外感染的NP病人中,菌血症111例,肺部感染88例,泌尿系感染48例,导管相关性感染36例,腹腔感染31例,胆道感染17例,伤口感染6例。早期(≤14 d)NP病人胰外感染常见部位为血液、呼吸道,胰外感染常见类型以菌血症、呼吸道感染为主;晚期(>14 d)NP病人胰外感染常见部位为血液、静脉导管、泌尿道,胰外感染常见类型以菌血症、导管相关性感染、泌尿道感染为主。见图1。
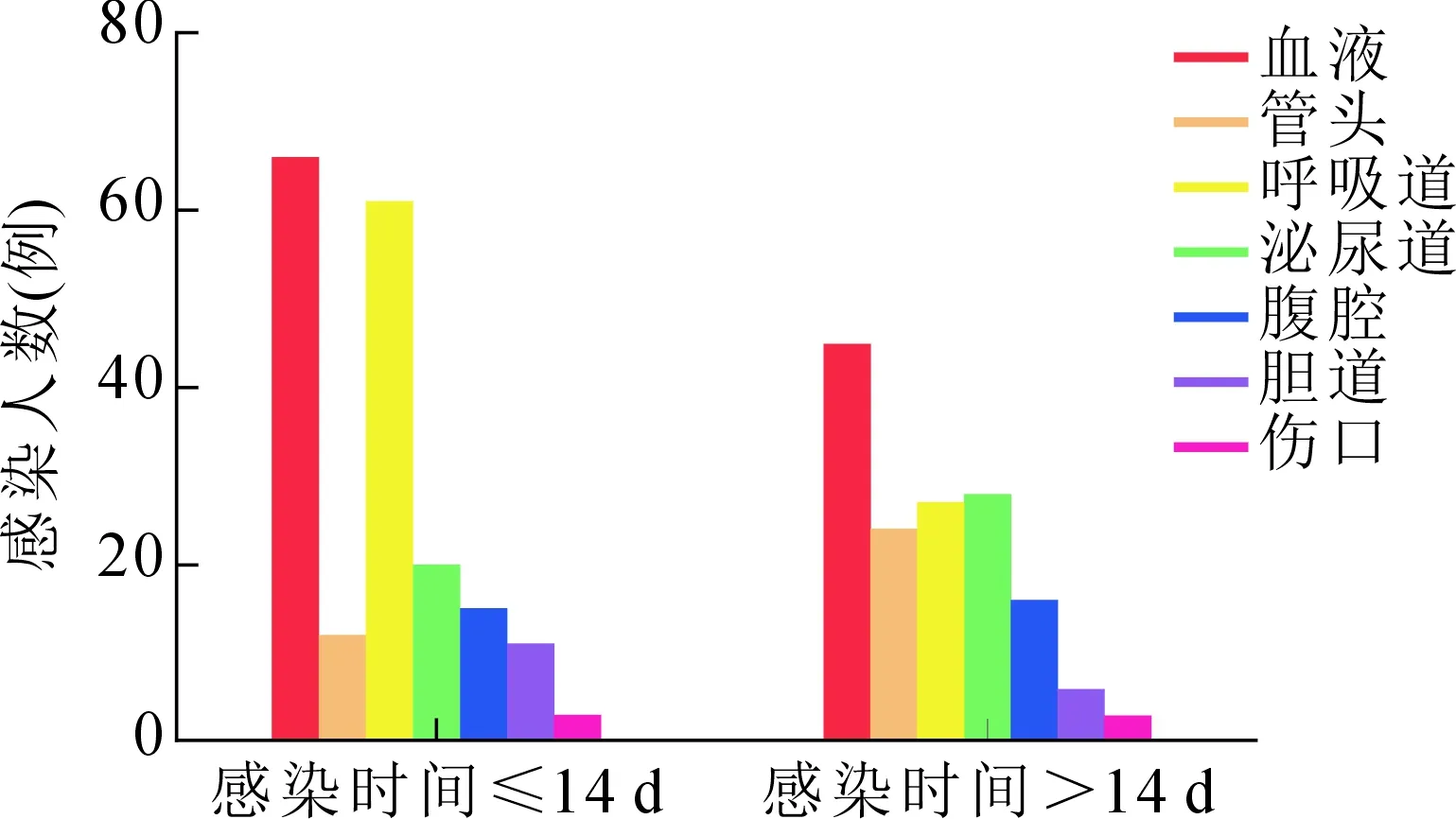
图1 胰外感染时间与部位分布图
五、NP病人的预后转归
80例无菌性NP病人中,52例病人接受保守治疗,28例病人行手术治疗,6例病人行经皮穿刺引流(percutaneous catheter drainage, PCD)治疗后好转,4例病人行囊肿内引流治疗,15例病人行视频辅助清创术(video assisted debridement,VAD)以清除坏死组织,3例病人因动脉出血介入栓塞治疗,共2例病人出现术后并发症(出血1例,消化道瘘1例)。215例感染病人中,49例病人仅接受抗感染等对症支持治疗,166例NP病人接受手术治疗,其中21例病人接受PCD及抗感染治疗后好转,余145例病人均接受VAD及抗感染治疗。37例病人术后出现并发症[出血17例(需介入治疗病人11例),消化道梗阻10例,消化道瘘9例,胰性脑病1例],与无菌性NP病人比较,差异有统计学意义(P<0.05)。见表6。
295例NP病人中,死亡32例,总体病死率为10.8%,无菌组病人病死率为3.8%,感染组病人病死率为13.5%(表6)。73例病人出现器官功能衰竭,其中无菌组7例,感染组66例,两组病人在病死率和持续性器官衰竭(POF)人数方面差异均有统计学意义(P<0.05)。详见表6。
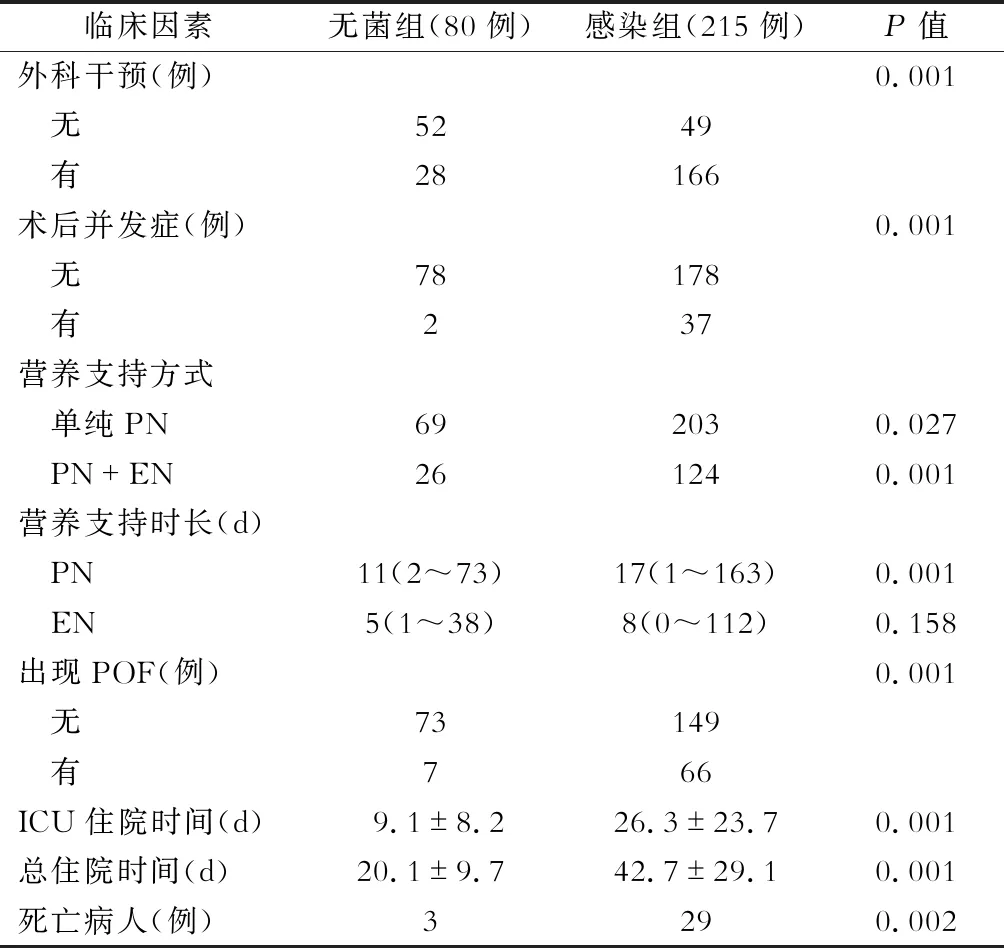
表6 无菌组与感染组坏死性胰腺炎病人临床转归的比较
讨 论
当前指南和研究指出[1-3,7-10],IPN是导致AP病人后期死亡的危险因素,亦是外科手术的指征。研究证明[11-15],“阶梯式微创”手术对NP病人在住院时间、术后并发症、花费等方面均优于“开腹清创手术”。我中心通过对怀疑或确诊IPN病人及时行“镇痛、液体复苏、抗感染、营养支持”等保守治疗以延缓病情进展,随后根据病人病情需要,在解剖学、影像学的指导下通过视频辅助清创以清除感染的坏死组织,进而降低病人病死率,并取得良好的效果。在大量临床实践中,我们认为对于出现感染性并发症的NP病人抗菌药物治疗选择,特别是在获得首次细菌培养的结果前仍较盲目。因此,了解出现感染症状的NP病人的病原菌菌谱及药物敏感试验,有助于临床有效、合理地使用抗生素,提高治疗效果,降低感染NP病人相关病死率。
在病原菌方面,通过对感染的NP病人的病原菌培养结果分析发现,胰腺及胰外感染的主要菌种均以革兰阴性菌为主,其中胰腺感染较常见的病原菌为肺炎克雷伯菌、铜绿假单胞菌,与多数关于感染病原菌的研究[7-8,10,16-22]一致,可能因早期NP病人的免疫抑制导致过度的全身炎症反应综合征增加了肠道黏膜的通透性、且损伤肠道固有微生物,引起肠道菌群移位,从而导致胰腺感染。而胰外感染的主要致病菌种与胰腺感染菌种存在差异,胰外感染中革兰阴性菌以铜绿假单胞菌、鲍曼不动杆菌居多,胰腺感染的革兰阴性菌则以肺炎克雷伯菌、铜绿假单胞菌为主,可能因胰腺感染菌种主要来源于肠道,故以肠道菌种多见,而胰外感染的菌种因感染部位不同而发生变化。
虽然目前指南及相关研究并不推荐对AP病人预防性应用抗菌药物[1-2,21],但随着AP病人病情进展,临床医师对于怀疑或确诊感染的NP病人应经验性选用抗菌药物治疗以延缓病情进展,对于经验性抗菌药物的使用,不同地区的研究结论存在差异。Moka等[8]的研究中,78%的IPN病人存在碳青霉烯类耐药现象,考虑与其多数入组病人存在外院抗感染治疗有关。Behrman等[18]的研究指出,多数胰腺感染病人对碳青霉烯类抗菌药物较为敏感。本研究中,根据感染的NP病人药敏试验结果显示,我中心常见革兰阴性致病菌和革兰阳性致病菌中的多重耐药菌亦呈上升趋势,考虑与病人长时间应用抗生素有关[21]。因此,需根据病人的药敏结果及时更换敏感抗生素以降低出现多重耐药菌的风险。本研究中,共59例病人出现真菌感染,均为混合感染,且真菌感染确诊时间晚于细菌感染确诊时间,可能与NP病人长期使用广谱抗菌药物及自身免疫力下降有关[22]。尽管多数研究[7-8,10,19,23-25]认为真菌感染是影响感染病人死亡的危险因素,但对怀疑或确诊感染的NP病人是否需预防性应用抗真菌药物,相关的文献报道尚存在争议。有研究认为预防性使用广谱抗菌药物或抗真菌治疗可能会增加细菌或真菌重叠感染的发病率[8,19];亦有研究提出预防性使用抗菌药物并未增加真菌感染的发生率,而且可能减少病人真菌感染的发生率,但需要进一步的研究来证明[23-24]。
在确诊感染时间方面,NP病人胰外感染确诊时间早于胰腺感染确诊时间,与其他研究[4-5,7-8]结论一致。其可能原因如下:(1)NP病人早期需肠内营养及肠外营养支持治疗,进而导致导管相关性感染(菌血症)的风险升高;(2)部分NP病人因病情危重(如:出血、感染性休克、器官衰竭、腹腔间隔室综合征、消化道瘘等)需行机械通气或长期卧床需留置导尿管,进而导致呼吸道、泌尿道感染的概率上升;(3)因对怀疑感染的NP病人长期应用广谱抗菌药物导致多重耐药菌出现频率增高,以及机体免疫功能受损等因素导致胰外感染。无论早期(≤14 d)或晚期(>14 d)胰外感染中,菌血症为常见的感染类型。早期可能因NP病人全身炎症反应综合征,严重抑制机体免疫功能进而导致菌血症的发生[5]。晚期可能与病人住院时间过长、多次手术、继发医源性感染或因长期肠外营养导致深静脉导管、导尿管留置时间过长相关[22]。
本研究中,多数感染组NP病人(196例)为外院转诊病人,入院时基本生命体征及免疫功能较差、且病程迁延不愈,导致器官衰竭、胰腺坏死程度加重等不良事件的发生率升高,进而需长期营养支持,甚至外科手术,使病人住院时间延长。因此,感染组病人的入院一般情况(胰腺坏死程度、CTSI评分、转诊时间等)较差,出现POF病人数、需外科干预治疗病人数、营养支持时长等方面均高于无菌组。
本研究存在的局限性在于:(1)多数病人存在外院治疗病史,且部分病人在外院已确诊IPN,但感染菌种无详细记录,病原菌菌株数存在一定偏差;(2)未分析感染病人术前、术后病原菌是否存在菌种变化;(3)对胰腺坏死和胰周坏死病人未进行分析;(4)对同时合并有两个及以上部位感染病人的病原菌种类未进行统计分析。
综上,通过对我院出现感染性并发症的NP病人的回顾性分析可知,NP病人的感染病原菌以革兰阴性菌为主,较常见的为肺炎克雷伯菌、铜绿假单胞菌,同时也发现多重耐药菌所占比例较大,预防性试验抗菌药物应慎重考虑。对怀疑感染的NP病人宜优先行胰外感染部位培养(如:血液、呼吸道和腹腔),经验性用药时可选用三代、四代头孢菌素或碳青霉烯类抗菌药物。
利益冲突所有作者均声明不存在利益冲突
