聚焦“高考评价体系” 彰显学科备考智慧
——2022年高三化学后期复习建议
2022-02-17颜建河
颜建河
《中国高考评价体系》成为高三复习的指路航标,这要求学生在复习进程中要依据学科要求,认真研读《中国高考评价体系》,把握命题方向,在掌握知识、技能和方法的基础上,聚焦考核目标与要求,结合化学学科体系和学科特点,从以下三个方面进行针对性复习。
建议一:有效梳理课本知识
在高三化学的后期复习中,一定要回归课本,重视教材,有效梳理课本知识,夯实基础,坚决杜绝偏题怪题和繁难试题。同时,落实好《中国高考评价体系》对每个知识点的层次要求,注重综合性、应用性与创新性。
例1.甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
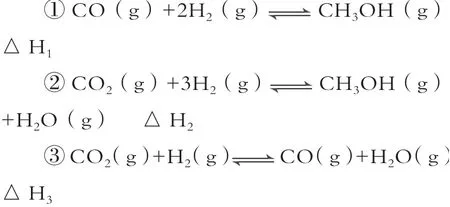
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
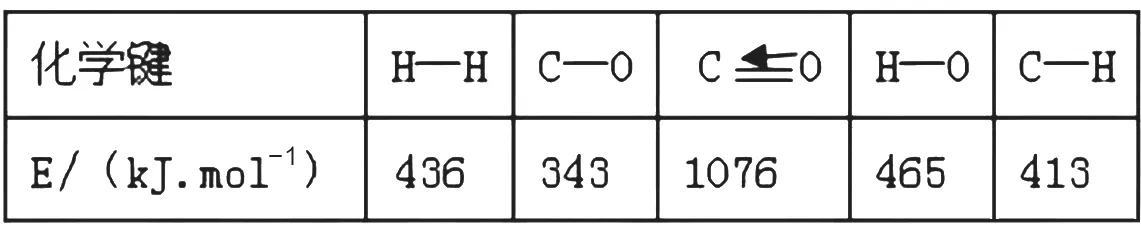
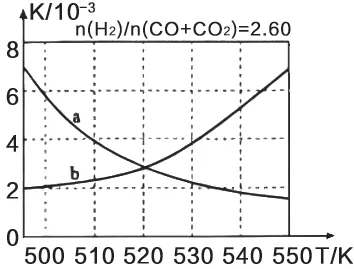
图1
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而(填“增大”或“减小”),其原因是图2中的压强由大到小为 ,其判断理由是
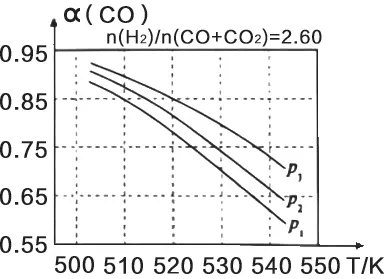
图2
解析:(1)从反应①中相关的化学键键能数据可知,∆H1=[E(C≡O)+2E(H-H)]-[3E(C-H)+E(C-O)+E(H-O)]=[1076 kJ·mol-1+2×436kJ·mol-1]-[3×413kJ·mol-1+343kJ·mol-1+465kJ·mol-1]=-99 kJ·mol-1;根据盖斯定律,由②式-①式可得反应③式,即∆H3=∆H2-∆H1=-58kJ·mol-1-(-99 kJ·mol-1)=+41kJ·mol-1。
(2)根据化学平衡常数概念,可直接写出反应①K的表达式;反应①是放热反应,升高温度,化学平衡向逆反应方向移动,化学平衡常数K减小,则曲线a符合。
(3)由图2可知,压强不变时,随着温度的升高,综合分析升温对①、③的影响,最终结果是α(CO)减小;反应③为气体分子数不变的反应,加压对其平衡无影响;反应①为气体分子数减小的反应,加压使α(CO)增大;由图2可知,固定温度(如530 K)时,p1→p2→p3,α(CO)增大,则综合分析可知:p3>p2>p1。
答案:(1)-99;+41。(2)K=c(CH3OH)/[c(CO)·c2(H2)];a;反应①为放热反应,升高温度使其平衡向逆反应方向移动,平衡常数K应减小。(3)减小;由图2可知,压强恒定时,随着温度的升高,α(CO)减小;p3>p2>p1;温度恒定时,反应①为气体分子数减小的反应,加压使平衡向正反应方向移动,α(CO)增大,而反应③为气体分子数不变的反应,加压对其平衡无影响,故增大压强时,有利于α(CO)增大。
建议二:强化核心考点复习
新高考命题强调由“能力立意”向“渗透学科核心素养考核”转变,学生要结合《中国高考评价体系》,领会“考点”的本质,做到能知其然更知其所以然,实现知识的再升华。例如,在核心考点的复习中,要依据教材特点和《中国高考评价体系》要求,抓住物质结构、氧化还原反应、离子反应、化学平衡、元素化合物知识、电化学、化学实验、化学基本计算等核心内容的精髓,从“基础性、综合性、应用性、创新性”深化理解,构建知识网络,学会运用必备知识和关键能力去解决实际问题。
例2.绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。
将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按下图连接好装置进行实验。
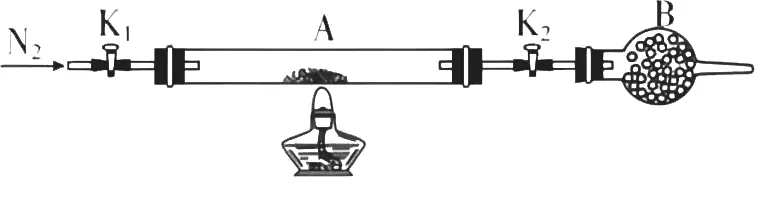
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却到室温
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
a.品红 b.NaOH c.BaCl2
d.Ba(NO3)2e.浓H2SO4
解析:(1)根据题意,取少量样品放入试管中,加适量水溶解,然后滴加KSCN溶液,溶液颜色无明显变化,说明硫酸亚铁与KSCN不反应;再向试管中通入空气,溶液逐渐变红,说明有Fe3+产生,即硫酸亚铁易被空气氧化为硫酸铁,Fe3+遇KSCN溶液显红色。
(2)①根据仪器装置图可知,B是干燥管;②由于装置中含有空气,空气能氧化硫酸亚铁,则加热前需要排尽装置中的空气,可利用氮气排出空气。为了使生成的水蒸气完全排除,应先熄灭酒精灯,再冷却,然后关闭K1和K2,最后称量,即正确的排序是dabfce。③依据题中条件,样品的质量是(m2-m1)g,加热后剩余固体是硫酸亚铁,根据绿矾失水后的反应方程式可得出:[(152+18х)/(m2-m1)]=[152/(m3-m1)],则有:х=[76(m2-m3)/9(m3-m1)];若实验时按a、d次序操作,在加热过程中硫酸亚铁被空气氧化为硫酸铁,则导致m3增加,使х偏小。
(3)从题给实验操作步骤可得出:①最终得到红色粉末,说明有氧化铁生成。即分解过程发生了氧化还原反应,依据化合价变化可知一定有SO2生成,说明硫酸亚铁分解生成氧化铁、二氧化硫和三氧化硫。三氧化硫溶于水生成硫酸,硫酸和Ba2+结合生成白色硫酸钡沉淀,由于硝酸钡在酸性溶液中有氧化性,能氧化SO2,则所选用试剂为BaCl2,检验SO2用品红溶液,所以C、D分别为BaCl2溶液和品红溶液,实验现象是C中溶液变浑浊,产生白色沉淀;D中品红溶液褪色。②从上述分析可知,硫酸亚铁高温分解的方程式为:
答案:(1)样品中没有Fe3+;硫酸亚铁(Fe2+)易被空气氧化为硫酸铁(Fe3+)。(2)①干燥管;② dabfce;③[76(m2-m3)/9(m3-m1)];偏小。(3)①c、a;生成白色沉淀、品红溶液褪色
建议三:扎实优化真题训练
新高考以“立德树人、服务选才、引导教学”为宗旨,这要求我们要对照《中国高考评价体系》,结合近年来的高考题进行训练,提高解题技巧和准确性,优化解题思路和方法。例如,对以能源、环境、化工生产、社会热点等为情境,结合图像、数据、图表、化学工艺流程(框图)、化学实验控制变量、新药、新的染料中间体、新型有机材料的合成等为信息载体的题目,要扎实训练,不放过任何一个过程(细节)。
例3.某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。
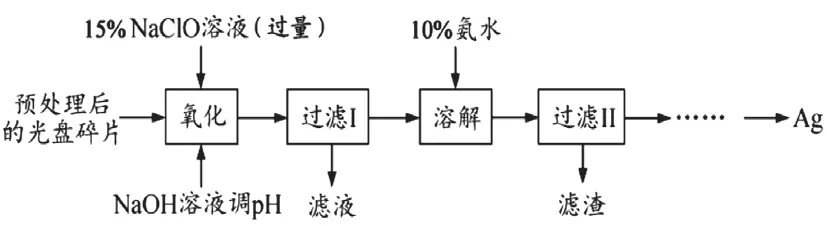
已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO=2NaCl+NaClO3
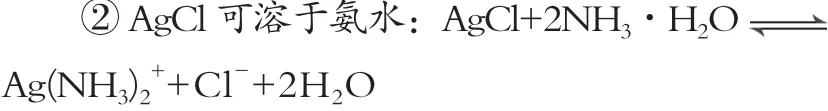
③常温时N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:4Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+ 4 NH4++4NH3↑+H2O
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2mol·L-1水合肼溶液,1mol·L-1H2SO4)。
解析:(1)根据题给信息,“氧化”阶段需在80℃条件下进行,由于加热温度低于水的沸点,则适宜的加热方式为水浴加热。
(2)依据题意知,NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,采用化合价升降法即可配平,配平后的化学方程式为:4Ag+4 NaClO+2H2O=4AgCl+4NaOH+O2↑。以HNO3代替NaClO的缺点是硝酸作氧化剂时,通常被还原为有毒的氮的氧化物(或 NO、NO2),造成环境污染。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,洗涤的目的是为了把滤渣表面残存的银氨配离子洗涤下来,并将洗涤后的滤液合并入过滤Ⅱ的滤液中。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为未过滤掉的溶液会稀释加入的氨水,氨水的浓度会变小,且其中含有一定浓度的Cl-,不利于AgCl与氨水发生反应,使得Ag的回收率变小。
(5)“过滤Ⅱ”后的滤液含有银氨配离子,依据题给信息,常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+,其反应方程式为:4Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+4NH4++4NH3↑+H2O,所以首先向该滤液中加入水合肼把银氨配离子充分还原,由于该反应所产生的气体中含有氨气,氨气有强烈的刺激性气味会污染空气,需要设计尾气处理措施,可以用题中提供的、要求必须使用的硫酸作尾气吸收剂。最后把反应混合物静置,过滤、洗涤,干燥即可得到回收的银。具体方案如下:向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1mol·L-1H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。
答案:(1)水浴加热。(2)4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑;会释放出氮氧化物(或 NO、NO2),造成环境污染。(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中。(4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应。(5)向滤液中滴加2mol·L-1水合肼溶液,搅拌使其充分反应,同时用1mol·L-1H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。
