丙泊酚麻醉对孕中期大鼠子代学习记忆功能及HDAC2-CREB-NR2B信号通路的影响*
2022-02-17徐桂萍
梅 静,马 琳,徐桂萍
(新疆维吾尔自治区人民医院麻醉科,新疆 乌鲁木齐 830001)
孕中期是胎儿中枢神经等功能组织形成的关键阶段,孕期手术会导致处于孕中期胎儿的中枢神经发育遭受不利影响的可能性增加[1]。更多的临床研究和动物研究均关注了孕中期手术中麻醉剂暴露对新生儿认知功能的影响及其内在作用机制[2−3]。孕中期使用麻醉剂对动物胎儿脑部发育及空间学习能力和记忆能力的影响至今尚无统一结论[4−5]。丙泊酚是外科手术中使用频率较高的静脉麻醉剂,可能对子代的长期行为产生影响,但结果仍存在不确定性[6]。研究表明,妊娠期暴露中高剂量的丙泊酚对子代空间学习与记忆能力的影响明显高于低剂量[7]。增强海马突触可塑性可通过增加神经营养和生长因子的水平介导神经发生,从而改善空间学习和记忆能力[8]。突触后密度蛋白95(PSD95)和生长相关蛋白43(GAP43)是突触形成和神经发育过程中必不可少的支架蛋白和促生长蛋白。组蛋白去乙酰化酶2(HDAC2)−环磷腺苷效应元件结合蛋白(CREB)介导天冬氨酸受体亚型(NR2B)信号在学习和记忆缺陷、抑郁、癫痫和阿尔茨海默病中起着关键作用[9],且NR2B的C末端可与PSD95蛋白PDZ域特异性结合。目前,丙泊酚暴露引发的子代学习和记忆缺失中HDAC2−CREB−NR2B信号通路扮演的角色仍不清楚。本研究中探讨了孕中期大鼠母体丙泊酚暴露对子代海马区HDAC2−CREB−NR2B信号通路的影响,以及该信号通路对子代空间学习和记忆能力的影响。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:XR−XM101型视频跟踪系统(上海移动数据有限公司);ECGenieTM型无创电遥测系统(美国Mouse Specifics公司)。
试药:GAP43(批号为20200102X),PSD95(批号为20180982B),HDAC2(批号为20190709X),磷酸化HDAC2(p−HDAC2,批号为20190904A),CREB(批号为20190315Y),磷 酸 化CREB(p−CREB,批 号 为20200992X),NR2B(批号为20190903B),内参蛋白磷酸甘油醛脱氢酶(GAPDH)的第一抗体(批号为20200476Y)和对应第二抗体羊抗兔免疫球蛋白G(IgG)H&L(HRP,批号为A2021030X1),均购于美国Abcam公司;中性红染色试剂盒(批号为19−3X−09−03),丙泊酚(批号为2012−02−12X),均购于美国Sigma Aldrich公司;罗米地辛(美国Selleck化学公司,批号为12R−C−03)。
动物:36只SPF级SD雌性大鼠,6周龄,体质量(150±10)g;12只雄性大鼠,6周龄,体质量(170±10)g,均购于新疆维吾尔自治区实验动物研究中心,生产许可证号为SYXK(新)2016−0001,动物合格证号为NO.65000200000364。所有动物均饲养于(24±1)℃的环境中,光照/黑暗周期为12 h/12 h,动物自由获得食物和水。所有实验程序和实验方案均获得我院实验动物伦理委员会批准,并按美国国立卫生研究院《实验动物的护理和使用指南》原则,使所用动物的总数及动物的痛苦最小化。
1.2 方法
1.2.1 孕鼠的麻醉剂暴露、剖腹探查术
前1 d的18:00,将3只雌鼠与1只随机选择的雄鼠关于一笼中[2],共12笼,自由交配,24 h后通过阴道涂片检测到雌鼠的阴道栓子或精子,认为雌鼠在孕0 d,以此推算并选择孕期为14 d的孕鼠36只。于自制透明塑料瓶中固定孕期为14 d的孕鼠,行颈静脉穿刺,放置静脉导管,并将孕鼠随机分为对照组和丙泊酚组,各18只。对照组经颈静脉注射生理盐水(2 mL/kg),丙泊酚组经颈静脉注射1.5%丙泊酚(2 mL/kg)行麻醉诱导,以20 mg/(kg·h)的速率持续静脉泵注丙泊酚,并行剖腹探查术,麻醉时间为4 h。
剖腹探查术:丙泊酚组大鼠麻醉诱导后剪去腹毛,暴露皮肤,使用75%乙醇消毒3遍,以0.125%布比卡因0.2 mL局部麻醉,行腹部3 cm纵切。无菌探查腹腔范围,包括膈肌(肝脏)、盆腔、膀胱、两侧腹中线水平(脾脏或肾脏)。用2 mL 37℃无菌生理盐水冲洗腹腔,吸净液体,用75%乙醇消毒切口,用4−0缝线间断缝合腹膜和肌层,用3−0缝线间断缝合皮肤并消毒,擦干切口血渍,于25 min内完成手术。大鼠苏醒后放回原笼,继续妊娠。
监测:丙泊酚组动物麻醉后用ECGenieTM心电图分析系统监测心电图、血压、血氧饱和度,麻醉结束后立即取母鼠髂外静脉行血气分析。质控:以翻正反射消失作为动物麻醉诱导成功的标准。孕鼠麻醉期间监测血氧饱和度、血压、心率,剔除血氧饱和度低于95%或平均动脉压超出或低于基础值20%的动物。最终从对照组和丙泊酚组中随机选择12只血氧饱和度、血压、心率均正常的孕中期大鼠,继续妊娠。
生殖发育参数:从孕0 d开始到子代出生后,统计两组大鼠的妊娠期,以及子代大鼠(简称子鼠)的性别比例、数量和体质量。
1.2.2 子鼠学习和记忆功能试验
子鼠出生后30 d,各组母鼠所产雄性子鼠进行学习和空间记忆检测(为排除发情周期对啮齿动物行为的影响,仅对雄性子鼠进行行为测试)。采用Morris水迷宫(MWM)系统检测子鼠的学习和记忆功能。MWM系统直径为1.6 m,深度为0.6 m,第Ⅱ象限中有可移动的圆柱形平台(直径为0.15 m),置固定的测试间内,每日8:00开始测试,水温(23±1)℃,第Ⅱ象限的平台在水下1 cm,每日训练1次。第1~5天(出生后30~34 d)观察子鼠的定位航行能力,从离平台最远的第Ⅲ象限选择一固定入水点将子鼠背对平台放入水中;若90 s内子鼠找到平台,则将其留在平台上20 s;若90 s内未能找到平台,将其引上平台同样停留20 s。记录子鼠寻找到平台的时间,即为逃避潜伏期;若90 s内未找到平台,按90 s计算。第6天(出生后35 d)行空间探索实验,撤去水中平台,于固定的进入点将子鼠放入水中,记录90 s内在第Ⅱ象限的停留时间及穿越原平台的次数,即为记忆潜伏期。以视频跟踪系统(上海移动数据有限公司)记录游泳速度和逃生潜伏期,每次实验后,大鼠毛发干燥后用热灯温暖5 min,放回常规笼。取同一母鼠所产所有子鼠成绩的平均值作为最终测定结果。
1.2.3 注射抑制剂子鼠学习和空间记忆测试
取丙泊酚组子鼠(出生后第36天,测试完成后1 d)6只,腹膜内注射2.5 mL HDAC2的特异性抑制剂Romidepsin 2.5 mg/kg,每日1次,持续7 d(出生后36~42 d),作为丙泊酚+Romidepsin组。取6只出生后36 d的丙泊酚组子鼠腹腔注射2.5 mL生理盐水,每日1次,持续7 d,作为丙泊酚+Saline组。出生后第43~48天,以MWM法检测子鼠的学习与记忆能力。
1.2.4 蛋白免疫印迹(Werstern blot)法分析
取对照组、丙泊酚组、丙泊酚+Romidepsin组及丙泊酚+Saline组子鼠,测试完成后用断头法处死,分离脑海马组织,匀浆,采用Werstern Blot法测定GAP43,PSD95,HDAC2,p−HDAC2,CREB,p−CREB,NR2B,GAPDH的表达水平。经过聚丙烯酰胺凝胶电泳(SDS−PAGE)分离,转移至聚偏氟乙烯膜上。将膜与GAP43(1∶600),PSD95(1∶500),HDAC2(1∶900),p−HDAC2(1∶500),CREB(1∶600),p−CREB(1∶800),NR2B(1∶1 000),GAPDH(1∶1 000)的一抗和对应的二抗孵育后。通过增强化学发光法使蛋白条带显色,并通过ImageJ软件进行定量,每组3只,重复3次。
1.2.5 中性红染色评估海马神经元丢失程度
随机选取丙泊酚+Romidepsin组及丙泊酚+Saline组子鼠,各3只,先后用盐水和4%多聚甲醛经心血灌流,取出脑组织,于4℃下以4%多聚甲醛固定,过夜。使用−20℃冷冻切片机将冷冻的脑组织切成30µm厚的冠状切片,于载玻片上风干,切片在1%中性红溶液中孵育1 min,检测细胞活力,评估海马神经元丢失程度。
1.3 统计学处理
采用SPSS 22.0统计学软件处理。计量资料(平台穿越次数、原平台所在象限停留时间、体质量、均出生总子鼠数、细胞丢失程度以及p−HDAC2,p−CREB,NR2B)两组间的差异以±s表示,采用单因素方差分析(one−way ANOVA),当one−way ANOVA分析有差异时,采用LSD−t进行多重比较;水迷宫逃避潜伏期数据采用重复测量两因素方差分析(RMtwo−way ANOVA),以种鼠或子鼠处理为主体间因素,MWM实验训练天数(时间)为主体内因素,当RMtwo−way ANOVA分析有差异时,采用PostHoctests(LSD−t)行多重比较。计数资料以率(%)表示,行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 对生殖和子代发育的影响
与对照组比较,丙泊酚组大鼠的妊娠期天数、产仔数量、雄/雌比、雄性子鼠的体质量差异均不显著(P>0.05),表明孕中期接触丙泊酚未对大鼠生殖及子代发育造成影响。详见表1。
表1 对照组和丙泊酚组大鼠生殖和发育参数(±s,n=12)Tab.1 Reproductive and developmental parameters of the rats in the control group and the propofol group(±s,n=12)
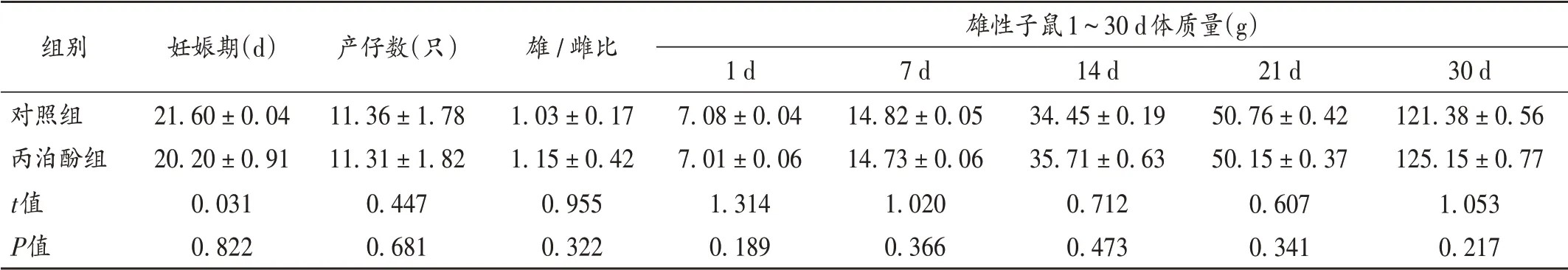
表1 对照组和丙泊酚组大鼠生殖和发育参数(±s,n=12)Tab.1 Reproductive and developmental parameters of the rats in the control group and the propofol group(±s,n=12)
组别对照组丙泊酚组t值P值妊娠期(d)21.60±0.04 20.20±0.91 0.031 0.822产仔数(只)11.36±1.78 11.31±1.82 0.447 0.681雄/雌比1.03±0.17 1.15±0.42 0.955 0.322雄性子鼠1~30 d体质量(g)1 d 7.08±0.04 7.01±0.06 1.314 0.189 7 d 14.82±0.05 14.73±0.06 1.020 0.366 14 d 34.45±0.19 35.71±0.63 0.712 0.473 21 d 50.76±0.42 50.15±0.37 0.607 0.341 30 d 121.38±0.56 125.15±0.77 1.053 0.217
2.2 对子代学习记忆的影响
与对照组比较,丙泊酚组子鼠的逃避潜伏期显著延长(P<0.05),平台穿越次数显著减少,第Ⅱ象限停留时间显著缩短(P<0.05)。详见图1至图3。

图1 对照组与丙泊酚组子鼠逃避潜伏期注:与对照组比较,*P<0.05,**P<0.01。图2至图3和表2同。Fig.1 Escape latency of the offspring rats in the control group and the propofol groupNote:Compared with those in the control group,*P<0.05,**P<0.01(for Fig.1−3 and Tab.2).
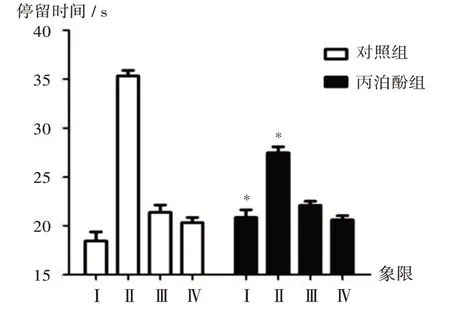
图3 对照组和丙泊酚组子鼠各象限停留时间Fig.3 Residence time in each quadrant of the offspring rats in the control group and the propofol group
2.3 对子代海马组织CREB信号通路的影响
与对照组比较,丙泊酚组子鼠的海马组织中HDAC2和p−HDAC2的蛋白表达显著上调,p−CREB和NR2B的蛋白表达显著下调(P<0.05)。详见图4和表2。
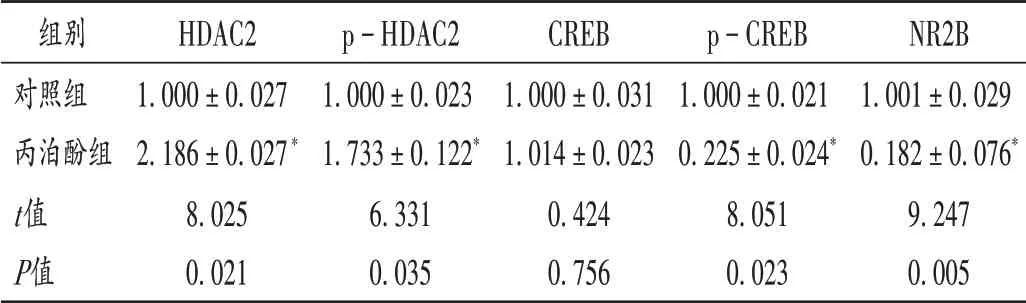
表2 对照组和丙泊酚组子鼠HDAC2,p-HDAC2,CREB,p-CREB,NR2B蛋白表达水平比较Tab.2 Comparison of the expression levels of HDAC2,p-HDAC2,CREB,p-CREB and NR2B protein of the offspring rats in the control group and the propofol group
2.4 Romidepsin通过调节HDAC2-CREB-NR2B信号通路影响孕中期丙泊酚暴露后子代的学习与记忆能力
与丙泊酚+Saline组比较,丙泊酚+Romidepsin组子鼠的逃避潜伏期缩短,第Ⅱ象限停留时长和平台穿越次数显著增加(P<0.05)。详见图5和表3。与丙泊酚+Saline组比较,丙泊酚+Romidepsin组子鼠海马组织中的p−HDAC2的蛋白表达显著下调(P<0.05),p−CREB,NR2B,GAP43,PSD95的蛋白表达均显著上调(P<0.05)。详见图6和表4。与丙泊酚+Saline组比较,丙泊酚+Romidepsin组子鼠缺失的海马神经元部分恢复,但未达到健康组大鼠的神经元数量。详见图7。
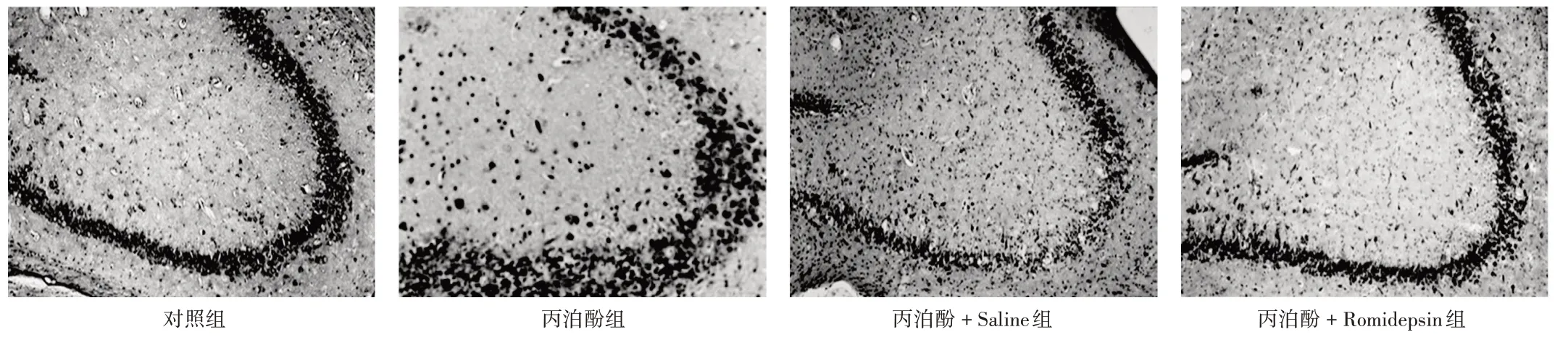
图7 中性红染色观察各组子鼠海马组织神经元细胞缺失程度(×200)Fig.7 Comparison of the neuronal loss extent in the hippocampus of the offspring rats in each group(Neutral red staining,×200)
表3 各组子鼠Morris水迷宫测试结果(±s)Tab.3 Results of MWM test for the offspring rats in each group(±s)
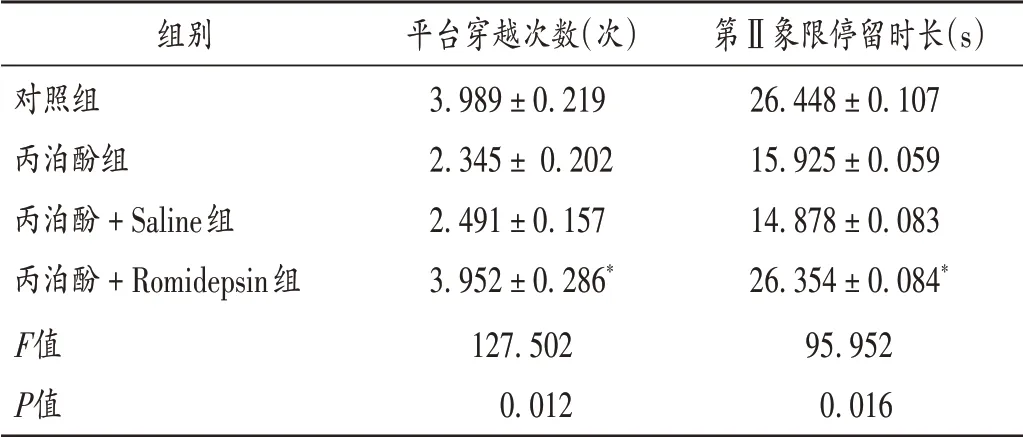
表3 各组子鼠Morris水迷宫测试结果(±s)Tab.3 Results of MWM test for the offspring rats in each group(±s)
组别对照组丙泊酚组丙泊酚+Saline组丙泊酚+Romidepsin组F值P值平台穿越次数(次)3.989±0.219 2.345±0.202 2.491±0.157 3.952±0.286*127.502 0.012第Ⅱ象限停留时长(s)26.448±0.107 15.925±0.059 14.878±0.083 26.354±0.084*95.952 0.016
表4 各组子鼠HDAC2,p-HDAC2,CREB,p-CREB,NR2B,PSD95,GAP43蛋白表达水平比较(±s)Tab.4 Comparison of expression levels of HDAC2,p-HDAC2,CREB,p-CREB,NR2B PSD95 and GAP43 protein of the offspring rats in each group(±s)
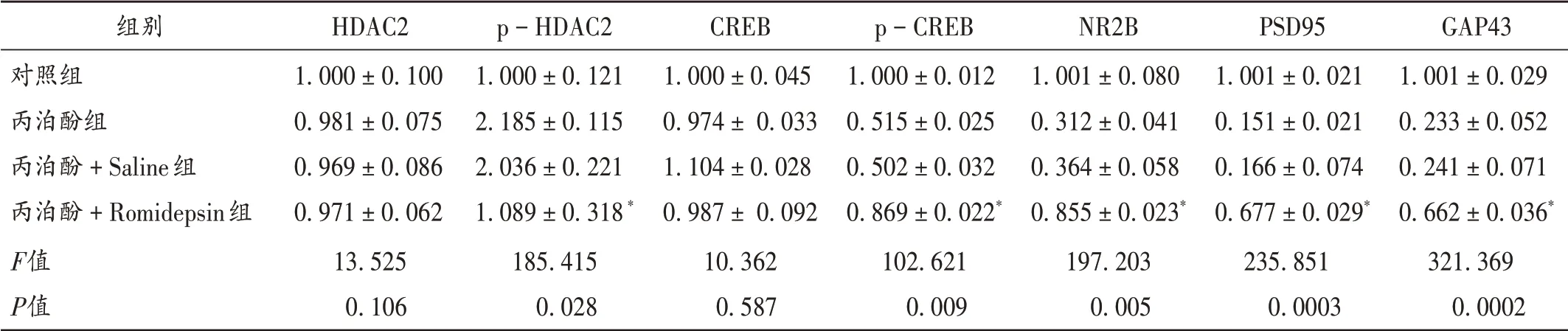
表4 各组子鼠HDAC2,p-HDAC2,CREB,p-CREB,NR2B,PSD95,GAP43蛋白表达水平比较(±s)Tab.4 Comparison of expression levels of HDAC2,p-HDAC2,CREB,p-CREB,NR2B PSD95 and GAP43 protein of the offspring rats in each group(±s)
组别对照组丙泊酚组丙泊酚+Saline组丙泊酚+Romidepsin组F值P值HDAC2 1.000±0.100 0.981±0.075 0.969±0.086 0.971±0.062 13.525 0.106 p−HDAC2 1.000±0.121 2.185±0.115 2.036±0.221 1.089±0.318*185.415 0.028 CREB 1.000±0.045 0.974±0.033 1.104±0.028 0.987±0.092 10.362 0.587 p−CREB 1.000±0.012 0.515±0.025 0.502±0.032 0.869±0.022*102.621 0.009 NR2B 1.001±0.080 0.312±0.041 0.364±0.058 0.855±0.023*197.203 0.005 PSD95 1.001±0.021 0.151±0.021 0.166±0.074 0.677±0.029*235.851 0.0003 GAP43 1.001±0.029 0.233±0.052 0.241±0.071 0.662±0.036*321.369 0.0002
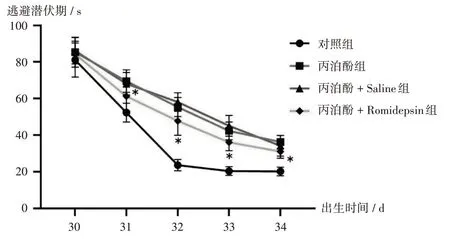
图5 各组子鼠逃避潜伏期测试结果注:与丙泊酚+Saline组比较,*P<0.05。表3和表4同。Fig.5 Results of escape latency test for the offspring rats in each groupNote:Compared with those in the propofol+Saline group,*P<0.05(for Fig.5 and Tab.3−4).
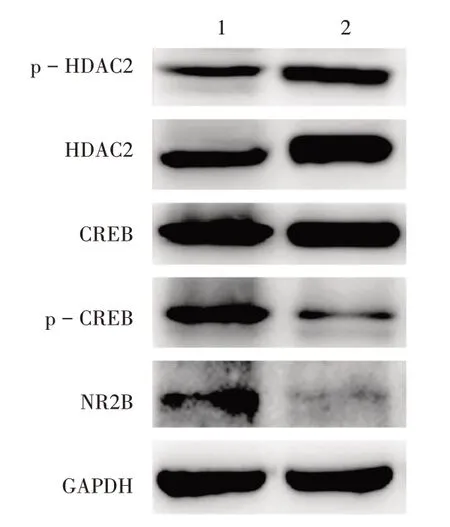
1.对照组2.丙泊酚组图4对照组和丙泊酚组子鼠HDAC2,p-HDAC2,CREB,p-CREB,NR2B蛋白表达水平1.The control group 2.The propofol groupFig.4 Comparison of the expression levels of HDAC2,p-HDAC2,CREB,p-CREB and NR2B protein of the offspring rats in the control group and the propofol group
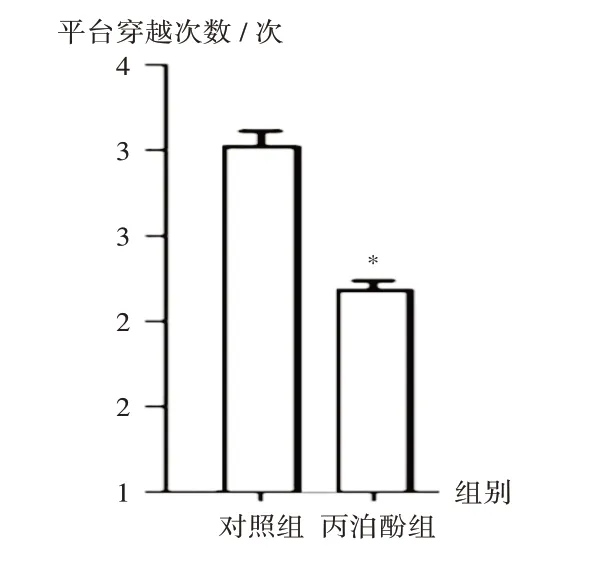
图2 对照组和丙泊酚组子鼠平台穿越次数Fig.2 The times of crossing platform of the offspring rats in the control group and the propofol group
3 讨论
孕中期为胎儿脑发育的关键时期,全身麻醉药物对脑发育期中枢神经系统具有潜在神经毒性作用。本研究结果显示,HDAC2抑制剂Romidepsin可抑制HDAC2蛋白的表达水平,改善孕中期丙泊酚麻醉后对子鼠学习与记忆功能的负面影响。孕中期大鼠颈内注射1.5%丙泊酚暴露,并以20 mg/(kg·h)的速率持续静脉泵注丙泊酚4 h,对大鼠的生殖和子代的发育均无影响,但海马组织的突触可塑性标记物表达减少,且子鼠的学习与记忆能力明显变差。其中,使用Romidepsin激活CREB−NR2B信号,改善了子鼠的学习与记忆缺失。
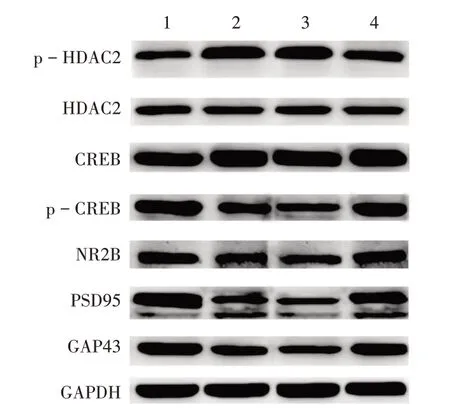
1.对照组2.丙泊酚组3.丙泊酚+Saline组4.丙泊酚+Romidepsin组图6各组子鼠HDAC2,p-HDAC2,CREB,p-CREB,NR2B,PSD95,GAP43蛋白表达水平1.The control group 2.The propofol group 3.The propofol+Saline group 4.The propofol+Romidepsin groupFig.6 Comparison of the expression levels of HDAC2,p-HDAC2,CREB,p-CREB,NR2B PSD95 and GAP43 protein of offspring rats in each group
丙泊酚是临床实践中广泛应用的镇静剂,是一种抑制GABA能神经元的药物。研究表明,患者在接受丙泊酚镇静的麻醉下进行手术时,轻度镇静与深度镇静均能导致其记忆缺失甚至谵妄,但轻度麻醉的发生率较深度麻醉降低50%,提示丙泊酚可能是诱导患者神经退行性疾病的重要危险因素[10]。麻醉剂对未成熟的神经元细胞有毒性作用,怀孕小鼠中、高剂量丙泊酚单次暴露2 h可损害子代的学习和记忆功能[11−12]。然而,丙泊酚应用于孕中期大鼠的手术中是否会对子鼠的认知能力造成影响仍不明确。本研究结果显示,孕中期大鼠暴露于丙泊酚,会导致子代的学习和记忆功能障碍。学习和记忆障碍是中枢神经系统损害非常重要的症状,也是阿尔茨海默病和帕金森病的主要特征[9,13]。目前,尚无可靠的药物来治疗此类具有学习和记忆缺陷的神经退行性疾病。本研究中使用HDAC2的抑制剂Romidepsin抑制HDAC2后,子鼠缺失的学习和记忆能力部分恢复。提示HDAC2可能是丙泊酚诱导子代认知功能障碍的关键调节靶点,通过靶向调节此信号有助于改善丙泊酚暴露导致的子代学习和记忆缺失。
突触可塑性对于记忆的形成和记忆存储至关重要[14]。海马区HDAC2−CREB−NR2B信号通路与海马区神经突触可塑性调节密切相关,在HDAC家族成员中,HDAC2起调节突触可塑性和对神经回路产生持久变化的作用,对学习和记忆产生负面影响[15],HDAC2作为组蛋白脱乙酰基酶,被抑制后可恢复学习功能,并促进神经退变动物长期记忆的恢复[16]。抑制HDAC2可为神经退行性疾病引起的记忆障碍提供治疗途径。HDAC2的过度磷酸化可降低cAMP应答元件结合蛋白CREB的磷酸化,导致CREB蛋白水平降低[12]。使用HDAC2的抑制剂SAHA后,可升高乙酰化组蛋白水平,并伴随p−CREB与NR2B亚基的启动子中结合位点的结合增强,导致大鼠海马中NR2B蛋白水平升高,通过维持突触可塑性改善机体的认知功能障碍[15]。本研究结果显示,使用HDAC2抑制剂Romidepsin可激活CREB−NR2B信号,明显恢复丙泊酚麻醉孕中期大鼠导致的子鼠的空间学习和记忆缺陷,并检测到突触可塑性标志物GAP43和PSD95的表达明显上调。提示HDAC2−CREB−NR2B信号通路通过调节海马突触可塑性改善子鼠的认知障碍;母体被麻醉剂暴露后,海马神经元中与NR2B共定位的PSD95表达水平降低,而上调PSD95可改善子代的空间和学习记忆缺陷[17],且PSD95和NR2B的表达水平降低可能会导致长期自发性反复的行为缺陷[18]。可见,HDAC2−CREB−NR2B信号通路调节的突触可塑性与空间学习和记忆功能密切相关。
研究表明,子代海马组织的神经元损失程度在丙泊酚暴露后明显增加[12]。本研究中使用HDAC2抑制剂Romidepsin抑制其激活后,海马组织的神经元缺失程度减少,提示海马神经元的活性可能受到HDAC2−CREB−NR2B信号通路的调节,与文献[15]的报道一致。
本研究存在的局限性,首先,选择大鼠的样本数较少,需扩大样本量;其次,为避免子鼠受发情期影响,子代仅选用雄性大鼠,文献[19]指出,麻醉药物对神经系统的毒性可能存在性别差异,故选择雄性大鼠作为实验对象。
综上所述,丙泊酚麻醉孕中期大鼠引发子代的认知障碍,其关键作用机制之一是激活HDAC2并抑制CREB−NR2B信号,抑制HDAC2导致CREB−NR2B信号的激活可能给治疗孕中期丙泊酚暴露致子鼠空间学习和记忆能力的缺陷提供帮助。
