灵芝多糖化学结构及药理活性研究进展*
2022-02-17王婷婷陈特欣肖建勇余耿介林月芬吴筠莹李灼坤
王婷婷,陈特欣,肖建勇,余耿介,林月芬,吴筠莹,李灼坤
(福建农林大学食品科学学院,福建 福州 350002)
灵芝(Ganoderma spp.)称为瑞草、瑶草,含有多种活性成分。2020年版《中国药典》记载,其为多孔菌科真菌赤芝(Ganoderma lucidum) 或紫芝(Ganoderma sinense) 的干燥子实体,主要有补气安神,止咳平喘的功效[1]。灵芝不仅在中国有着悠久的食用历史,可用于泡茶、泡酒、入菜[2];而且自灵芝等食用菌于2020年1月被国家卫生健康委及国家市场监管总局正式公布为药食同源食品起,其在食品行业的应用研究更加热门及广泛[3]。
作为一种天然的食药兼用菌,灵芝的成分和结构复杂,主要有多糖、蛋白质、无机盐和矿物质等成分。Jong等[4]研究表明灵芝多糖有良好的药用价值,胞外多糖和胞内多糖是其多糖主要成分;在胞外发酵液中主要含胞外多糖,而在灵芝孢子、子实体和菌丝体中主要包含胞内多糖[5]。此外,灵芝多糖的潜在价值巨大,国内外研究团队利用高效液相色谱(high performance liquid chromatography,HPLC) 技术、核磁共振成像(nuclear magnetic resonance imaging,NMRI) 技术、高效阴离子交换色谱与脉冲安培检测器联用(high performance an-ion exchange chromatography-pulsed amperometric detecter,HPAEC-PAD)等新型现代技术对灵芝多糖进行探究,分析发现了灵芝多糖具有抗氧化[6]、免疫调节、消炎[7]、抑制肿瘤细胞活性[8]和调节肠道菌群[9]等活性。且从不同种类灵芝的不同部位中提取、分离的灵芝多糖具有不同的化学结构和生物活性,且毒副作用较小[10-12]。通过对近年灵芝多糖相关研究进行阐述,以期为灵芝多糖的深层次研发利用提供思路和佐证。
1 灵芝多糖的化学结构
1.1 多糖组成
多糖是由糖苷键连接不少于10个单糖组成的聚合高分子碳水化合物,主要存在于动、植物细胞中,在生命活动的维持中有重要的作用,且在食品、医药等行业中被大量使用[13-14]。糖类的结构及生物活性是科研领域的研究热点[15]。
结构决定功能特性,因此分析不同种类的多糖结构十分必要。多糖的一级结构主要由不同种类的单糖、糖苷键、构型、支链组成和取代基等构成;其中,多糖的分子量大小影响多糖的生物活性,多糖的分支度与糖苷键的连接方式和数量有关,灵芝多糖中常见的单糖组分有葡萄糖、岩藻糖、甘露糖等[16]。单糖的α-构型和β-构型是决定糖苷键定向及空间构象的重要因素,常见的糖苷键类型有α-(1→6)、β-(1→4) 和 β-(1→6)等[17]。二级结构是多糖骨架链间以氢键结合所形成的构象。三级结构和四级结构是在二级结构的基础上,通过非共价作用形成有规则的构象[18]。
一些多糖由于溶解度低或分支较多会对生物活性有一定影响,可通过修饰多糖来提高溶解度,如在多糖分子链上引入乙酰基、硫酸基、羧甲基、磷酸基等取代基团[19]。多糖的提取根据相似相溶原则,且已知其是一种极性高分子化合物,可溶于水,但不溶于有机溶剂如乙醇和丙酮等,因此一般通过热水或亚临界水提取,后用乙醇等非极性溶剂从提取物中沉淀多糖。目前的试验提取和工业化生产中,一般辅助使用超声波、微波、酶等技术来优化提取工艺,从而使多糖提取更加高效[20]。
1.2 灵芝多糖的结构
灵芝多糖因需求不同,提取的种类有均多糖和杂多糖,均多糖由单一的葡萄糖或半乳糖构成,而杂多糖则由多种单糖以不同比例构成[21]。灵芝多糖结构分析难点在于灵芝提取物中的杂多糖种类繁多且空间结构复杂,以葡萄糖、半乳糖和甘露糖为主的单糖主要构成灵芝多糖主链,岩藻糖、木糖和阿拉伯糖等糖单元主要构成其支链[22]。此外,一级结构是解析灵芝多糖的基础,解析一级结构的重难点在于灵芝多糖分子质量、糖基组成顺序和构型、组成比、糖醛酸种类和比例、糖链和非糖部分连接情况、糖残基外接基团类型等问题的解决。
在梁琰等[23]的研究中,测定了赤芝的单糖组分,发现了赤芝多糖酸解产物中的7种单糖,且摩尔比为鼠李糖∶岩藻糖∶木糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖 =5.90∶5.34∶72.64∶31.96∶1.00∶1.89∶5.24。Wang等[24]从破壁灵芝孢子粉的水提取物中分离出分子重量 (molecular weight,MW) 为 1.57×105g·mol-1的水溶性灵芝多糖,通过离子交换和色谱纯化,红外光谱和核磁共振分析,确定其为β-D-葡聚糖均多糖。上述关于多糖结构部分的研究对提取灵芝多糖一级结构中的部分组成进行仔细探讨,为后期健全灵芝多糖结构分析库提供了一定的数据依据。
灵芝的来源不一与性质迥异,导致其多糖的分子质量和结构差异巨大,且灵芝多糖的分支还含有蛋白或多肽。而灵芝多糖结构解析进展有限,目前试验分离得到的200多种灵芝多糖,大多仅完善了部分重复单元的部分解析,还需要深入研究灵芝多糖二级结构、三级结构和空间构象[25]。而随着现代仪器的发展和科研技术的进步,灵芝多糖结构研究已取得一定突破,目前对其研究的部分结果统计见表1。

表1 灵芝多糖的结构Tab.1 The structures of Ganoderma lucidum polysaccharides
由表1可知,Ye等[26-28,31]已经从灵芝子实体中纯化出了几种具有多种不同生物活性的多糖/糖缀合物,其中LZ-B-1和LZ-D-1被研究发现具有刺激小鼠脾脏淋巴细胞增殖的能力。LZ-B-1通过超滤纯化、DEAE-琼脂糖凝胶CL-6B等一系列纯化步骤分离,已确定相对分子量为1.12×104Da;LZ-D-1是从灵芝子实体中分离出的水溶性多糖,分子量为2.8×104Da。为了进一步探究其多糖结构及功效关系,利用核磁共振等技术得到LZ-B-1、LZ-C-1、LZ-D-1和GLPCW-Ⅱ中的多糖均主要由L-Fuc(L型果糖)、D-Gal(D型半乳糖) 和D-Glc(D型葡萄糖)组成。其中GLPCW-Ⅱ的分子量为1.2×104Da(由HPLC测定),组成成分为90%碳水化合物和8%蛋白。Zhang等[29-30]从灵芝子实体中分离出灵芝多糖PSG,将PSG分离成不同级分后,通过化学组成和抗氧化活性分析,鉴定得出PSG具有抗氧化活性的关键组分。将其纯化后,得到高支化的PSG-1是一种杂多糖;另一种是水溶性异半乳糖PSG-2,由半乳糖、果糖和葡萄糖通过α-(1→6) 糖苷键连接,摩尔比分别为75.87%、11.83%和6.02%。Dong等[32]采用热水浸提和醇沉灵芝孢子粉,而后在阴离子交换色谱中通过氯化钠溶液洗脱和Sephacryl S-300凝胶柱纯化得到灵芝多糖GLSA50-1B。GLSA50-1B的结构单元表明由(1→6)-β-D-Glcp构成主链,是一种均质多糖。王亚涛[33]使用沪农灵芝1号未破壁灵芝孢子粉,通过水提和50%的乙醇醇沉,得到的组分经过水洗脱和Sephacryl S-500 HR凝胶柱进一步分离并反复过柱纯化,收集到的样品被命名为LSB50A-Ⅲ-1。LSB50A-Ⅲ-1 是由 (1→3,6)-β-DGlcp、 (1→3)-β-D-Glcp、(1→4,6)-β-D-Glcp、(1→4)-β-D-Glcp和 (1→6)-β-D-Glcp 5种糖残基构成主链,由β-D-Glcp-构成支链的葡聚糖,其多分散性系数为1.36,重均分子量为1.93×105Da。经HPLC分析该样品为均多糖,且得率高,有利于以后有针对性地获取和研究灵芝孢子粉中的葡聚糖。此外,该灵芝孢子粉通过在离子交换柱层析中用氯化钠溶液洗脱可得到杂多糖。综上,同一研究团队分离纯化同种、同地源灵芝得到的灵芝多糖,其结构单元均有所差异,故未来需对其高级结构和构效关系进行更多研究,以便运用生产。
2 灵芝多糖的药理活性
灵芝多糖的部分药理活性见图1。
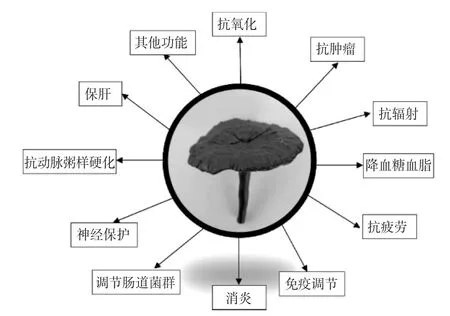
图1 灵芝多糖的药理活性Fig.1 Pharmacological activity of Ganoderma lucidum polysaccharides
如图1所示,国内外已经探究了灵芝多糖具有抗氧化[6]、抗肿瘤[8]、抗辐射、保肝及免疫调节[26]等多种药理活性,从整体上提高了灵芝的药用价值。近年来,消费者生活质量提高带动了对灵芝的需求,目前市场上灵芝产品有药品、食品、保健品等。消费者购买灵芝通常是源于对其药理活性的需求,但复杂的化学组成使得其功能活性的机制仍处于研究阶段。
2.1 灵芝多糖的抗氧化作用
吴杨洋等[34]利用多种自由基的氧化特性,探究灵芝多糖的抗氧化活性,发现在一定范围内,灵芝多糖的浓度越大,还原力越强,说明灵芝多糖的抗氧化性较好。对灵芝多糖抗氧化活性的评估中,其中的一项重要指标是抑制脂类物质的氧化,构成脂质的脂肪酸链易氧化降解,鉴定脂质体氧化程度的标志性物质是过氧化物和次级代谢产物丙二醛(malondialdehyde,MDA)。Xu等[35]研究表明灵芝多糖可提高肝脏超氧化物歧化酶(superoxide dismutase,SOD) 活性,降低MDA含量,从而达到抗氧化的作用。殳叶婷等[36]制备了仿照细胞膜脂类物质氧化进程的脂质体,将灵芝多糖添加入该脂质体中,从而灵芝多糖抗脂质体氧化作用,结果表明灵芝多糖能显著抑制氧化过程的最佳时间为0~60 h,与阴性对照组相比可有效抑制过氧化物和MDA的产生,试验证明了灵芝多糖的抗脂质氧化作用。Zhang等[37]研究了灵芝多糖改善氧化状态的方式主要有清除过量的氧自由基、提高抗氧化酶活性和降低脂质过氧化物等途径。
抗氧化检测无法用单一方法进行评价,检测中一般通过多项指标共同评价物质的抗氧化能力[38-39]。目前,对一种物质抗氧化能力的评价还暂未形成统一的评价体系,虽有理论指导,但对物质的抗氧化能力检测未获得统一的国家标准,今后应把灵芝多糖的抗氧化作用体系建立健全,从而形成探究体系运用实践。
2.2 灵芝多糖的抗肿瘤作用
恶性肿瘤具有侵袭性强和快速生长的特点,初期病症较为普通且常见,不容易被引起重视,常因未及时治疗导致疾病恶化,甚至死亡[40]。灵芝的子实体、孢子粉、菌丝体中均含有抗肿瘤活性成分,Xie和Zhong等[41-42]研究表明,灵芝多糖会影响肿瘤细胞凋亡。Jiang等[43]发现,赤芝子实体多糖在单独应用或与5-氟尿嘧啶联合应用时能抑制肿瘤细胞生长并诱导其凋亡。
Li等[44]发现灵芝多糖未通过直接抑制肿瘤细胞,而是通过激活吞噬细胞来抑制肿瘤细胞活动。李芳等[45]发现,灵芝多糖能减少肿瘤组织中细胞因子的生成和表达,灵芝三萜与多糖配合使用效果更佳;并确定了在灵芝三萜和灵芝多糖共同作用下,可有效抑制调节性T细胞的功能,从而达到促进机体抗肿瘤的功效。Boh[46]研究结果表明灵芝的抗肿瘤作用归因于5组机制:调节免疫反应;对癌细胞产生细胞毒性;抑制肿瘤诱导的血管生成;抑制癌细胞增殖和侵袭性转移行为;致癌物失活。
目前学术界对灵芝多糖的抗肿瘤机理研究深度不够,暂无定论,后续试验可以加强灵芝多糖在抗肿瘤机理等方面的研究。
2.3 灵芝多糖的抗辐射作用
辐射广泛存在于日常生活环境中,辐射污染已成为危害人体健康一大隐形因素,其能导致免疫系统或新陈代谢等疾病,严重时会致癌[47-48]。于纯淼等[49]通过研究灵芝多糖对辐照损伤后小鼠的体内试验表明,给予中剂量、高剂量灵芝多糖对减轻辐射损伤有积极意义;其团队进一步通过小鼠试验,利用血清代谢组学技术,发现灵芝多糖可通过改善小鼠血清中辐射诱导产生的潜在标志物和相关代谢途径的表达,从而在防辐射中发挥作用[50]。
迪丽索耶尔·亚勒坤木等[51]通过灵芝多糖对辐照损伤后小鼠胸腺的代谢通路进行分析后发现,灵芝多糖对牛磺酸、L-谷氨酸和磷脂酰胆碱等代谢通路中生物标志物的合成具有显著保护作用,利用拓扑分析等代谢组学技术分析,得出灵芝多糖参与的代谢通路主要有牛磺酸(亚牛磺酸) 代谢、D-谷氨酰胺(D-谷氨酸)代谢以及甘油磷脂代谢,因此研究发现灵芝多糖可逆转内源性代谢物的变化,即减少辐射造成的内源性代谢物的氧化应激和DNA分解,从而有效抗辐射损伤。
但是目前还没有关于代谢通路中灵芝多糖的最佳剂量和相关生物标志物或调控因子具体量效关系的报道,在今后的研究中还有待进一步深入探索。
2.4 灵芝多糖的降血糖和血脂作用
Li等[52]测定链脲佐菌素诱导后高血糖小鼠的体重、空腹血糖、血清胰岛素和血脂水平,用一定剂量灵芝多糖进行注射治疗28 d后,灵芝多糖处理过的高血糖小鼠体重和血清胰岛素水平显著高于用生理盐水处理的高血糖对照组。此外,根据急性毒性试验,注射灵芝多糖未引起小鼠的行为改变和死亡,且测得总胆固醇、甘油三酯和低密度脂蛋白胆固醇水平下降,说明灵芝多糖也有降血脂的功效。Li等[53]研究了一种新型灵芝多糖铬配合物,并测试复合物对高糖和高脂肪饮食诱导的糖尿病前期小鼠高血糖和高脂血症的影响,喂食灵芝多糖复合物的试验组小鼠体内血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇、空腹血糖水平和糖耐量均显著低于对照组,且试验组小鼠的生理代谢、器官指数和肝组织形态无显著不良影响,综上可知灵芝多糖可作为预防或治疗高血糖和高血脂的潜在功能食品成分。
目前的研究多认为灵芝多糖可通过修复胰岛β细胞,从而促进胰岛素分泌、改善葡萄糖转运功能和葡萄糖氧化作用达到降低高糖的目的;另可通过调控因子加强葡萄糖代谢酶的活性来降低胰岛素抵抗,增强糖代谢作用[54],但尚未形成定论,需进一步探索。
2.5 灵芝多糖的抗疲劳作用
万利等[55]对六周龄小鼠摄入灵芝多糖提取物的研究揭示,灵芝多糖提取物能提高小鼠的跑台运动时间;显著减缓小鼠骨骼肌病理改变,且呈现出明显的剂量依赖性。此项研究还发现灵芝多糖提取物能提高小鼠的肌糖原和肝糖原含量,也能提高小鼠骨骼肌组织中SOD、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px) 和过氧化氢酶(Catalase,CAT) 含量;降低MDA水平;显著调高小鼠肝组织中α-1-酸性糖蛋白及趋化因子受体的mRNA和蛋白水平,据此推测灵芝多糖提取物能在一定程度上提高运动小鼠的抗疲劳能力。
李欣等[56]将灵芝多糖分为低、中、高3个剂量组对小鼠抗疲劳作用进行评估,结果表明与阳性对照组相比,中剂量、高剂量灵芝多糖处理组无明显差异,均显著延长负重小鼠游泳力竭时间,显著升高血糖、肝糖原和肌糖原的含量。此试验表明灵芝多糖对抗疲劳有积极效果,但还有待进一步临床研究。
2.6 灵芝多糖的免疫调节作用
Zhu等[57]研究了灵芝多糖在免疫抑制小鼠体内发生的免疫效应。连续7 d在小鼠腹膜内分别注射不同剂量的灵芝多糖,其中低剂量灵芝多糖加速了小鼠骨髓细胞、红细胞和白细胞以及B淋巴细胞和T淋巴细胞的恢复;第5天的T淋巴细胞活性变强,第8天T细胞和B细胞的生长繁殖加强,第7天至第9天淋巴因子激活杀伤细胞活性。第12天吞噬细胞的吞噬和细胞毒性功能得到增强。数据证明了低剂量灵芝多糖治疗对增强免疫抑制小鼠免疫细胞活性有显著影响。
Huang等[58]开发了一种由灵芝多糖和猪苓多糖3∶1组成的多糖复合物(Ganoderma lucidum Polysaccharides and Polyporus umbellatus Polysaccharides,命名为GPP),在小鼠单核巨噬细胞白血病细胞(RAW264.7)吞噬细胞中检测了GPP的免疫调节作用和急性口服毒性。试验得出,GPP能增强细胞的吞噬能力、一氧化氮的产生以及诱导型一氧化氮合成酶和肿瘤坏死因子的mRNA表达,明显改善了吞噬细胞的吞噬功能和细胞活性,表明GPP能一定程度上调节小鼠的免疫功能。
灵芝多糖的免疫调节作用让其在医药和食品行业拥有巨大潜能,但目前对此类产品的开发还不够,其原因可能在于没有足够清晰的理论体系支撑[59]。
2.7 灵芝多糖的消炎作用
一般人体内白细胞和其分泌的物质抵御外界微生物入侵的过程称为炎症反应;但一些疾病虽无外界物质入侵也会产生炎症导致身体损伤,例如关节炎、动脉粥样硬化等[60]。CCl4诱导下被激活的炎症小体NLRP3可以导致促炎细胞因子的释放[61-62]。Chen等[63]研究发现,与对照组相比,CCl4诱导的小鼠血清中促炎细胞因子平均水平及基因蛋白表达平均水平显著升高,而一定剂量的灵芝多糖能显著抑制NLRP3炎症小体的激活,明显减轻全身炎症反应。Zhang等[37]研究发现灵芝多糖能改善多器官功能障碍综合症小鼠炎症因子水平,减轻炎症。
但引起炎症的细胞因子种类较多,目前关于灵芝多糖的消炎机制研究还不够透彻,对于多糖或各种细胞分子间作用关系的探究广度和深度还远远不够。
2.8 灵芝多糖调节肠道菌群
Chen等[64]考察了灵芝多糖对高脂饮食和链脲霉素诱导糖尿病大鼠的肠道微生物群和粪便代谢物的影响,结果表明,灵芝多糖治疗组降低了有害细菌的丰度,如气球菌属、瘤胃球菌属、棒杆菌属和变形杆菌属,并提高了部分有益菌的水平;此外,灵芝多糖的使用让空腹血糖和胰岛素水平显著下降。预测微生物菌落技术表明,灵芝多糖可以恢复大鼠肠道细菌群落的氨基酸代谢、碳水化合物代谢、炎症物质代谢和核酸代谢的紊乱,而利用代谢组学进行分析观察,得到的大多数代谢变化与上述预测结果一致。
Lv等[65]发现灵芝多糖肽对试验大鼠的肠道微生物群形成了显著的结构变化,特别是调节了肠道有益微生物的相对丰度。随后,Sang团队[66]证明了从灵芝破壁孢子中提取的多糖对大鼠肠道菌群结构有积极的改变作用。
2.9 灵芝多糖的神经保护作用
阿尔茨海默病(Alzheimer’s disease,AD) 是一种神经系统退行性疾病,病因迄今未定论,促进神经生长被视为治疗与AD相关疾病的一种可行方法。Huang等[67]研究发现口服灵芝多糖水提取物可促进神经祖细胞(neural progenitor cells,NPC) 增殖,从而加强神经生长并减轻转基因AD小鼠的认知缺陷;进一步研究发现,灵芝多糖强化了成纤维细胞生长因子受体和下游细胞外信号调节激酶和级联的活性;最终验证试验表明,在抑制成纤维细胞生长因子的条件下,就能有效地阻止灵芝多糖促进的NPC增殖和下游级联的激活,从而证明试验结果。
Zhou等[68]研究发现口服灵芝多糖能显著减少脑梗塞面积,减轻神经功能缺陷和神经元凋亡。此外,还可以降低凋亡神经元的百分比、减轻神经元形态学损伤并抑制基因的过度表达。
Huang和Zhou的研究均证实了灵芝多糖对神经系统有良好的保护作用,可作为一种神经再生治疗剂,用于治疗与神经退行性疾病相关的认知能力下降。
2.10 灵芝多糖的抗动脉粥样硬化作用
高脂血是导致动脉粥样硬化的原因之一,与其相关的血浆脂质成分主要有总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白 (low-density lipoprotein,LDL)、脂蛋白 (a)[lipoprotein(a),Lp(a)],这些因素均会促进动脉粥样硬化发展[69]。吴锋等[70]构建动脉粥样硬化大鼠模型,通过形态学和组织病理学研究,提出灵芝多糖可抑制动脉粥样斑块形成;且能明显降低血清TC、TG、LDL及Lp(a) 水平。
动脉粥样硬化斑块不稳定的原因之一是未成熟、脆弱的新血管生成。Wihastuti等[71]研究了灵芝多糖糖肽对抑制动脉粥样硬化小鼠中的血管滋养管、H2O2的数量的影响。试验结果和方差分析表明,其显著降低了动脉粥样硬化小鼠模型中的血管滋养管数量,并认为其可成为动脉粥样硬化中的抗血管生成剂。
2.11 灵芝多糖的保肝作用
Susilo等[72]用酶联免疫吸附测定法测量天冬氨酸氨基转移酶 (Aspartic transaminase,AST)、MDA、丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、SOD和CAT的水平。在小鼠给药后第10天采集血清和肝脏样品,发现灵芝多糖显著降低血清ALT、AST、MDA水平,显著升高SOD、CAT水平。此外,在组织学评估中,CCl4处理小鼠的肝组织表现为水样变性、坏死和窦性扩张,但灵芝多糖改善了肝的组织病理。因此得出灵芝多糖具有肝保护作用,可使受损肝组织再生。
Liu等[73]通过酶联免疫和免疫印迹法检测CCl4诱导的肝细胞损伤机制,发现灵芝多糖显著提高了细胞活力,抑制CCl4诱导细胞标志物的升高,从而抑制脂质过氧化、提高抗氧化酶活性、抑制细胞凋亡和免疫炎症反应来保护CCl4诱导的肝细胞损伤。
2.12 灵芝多糖的其他作用
Xu等[74]试验发现灵芝多糖能减轻抗癌类药物阿霉素在临床应用中的心脏毒性,这对阿霉素治疗癌症的应用填补了空白。Park团队[75]研究提出灵芝多糖是一种有前景的抗纤维化剂。Zeng等[76]探究了灵芝多糖延缓小鼠皮肤组织衰老的作用,得出灵芝多糖可增加表皮和真皮的厚度,改善皮肤组织结构,增强SOD水平和mRNA的表达,从而达到延缓皮肤衰老的效果。
近年来,灵芝多糖的研究除了上述作用外,未知的作用和机理仍有很多。今后需加大灵芝多糖开拓的广度和深度,将试验研究和产品制造相结合,使其不再单一使用于科学研究,能在未来做到产学研相结合。
3 结论与展望
灵芝多糖是从天然食(药)用菌灵芝中提取得到,具有毒性小和活性功能广的优点。目前对于灵芝多糖的一级结构和空间构象有了一定认识,但高级结构还需在今后进行更深入的研究,才能为将来中草药量效理论的建立提供可靠的依据。同时,灵芝多糖活性功能具有多样性,与灵芝生长环境、提取分离方式等因素密不可分,对于灵芝多糖的相关结构和活性功能之间的构效关系及其机制的研究,同样还有很长的路去探索。
然而,基于各地区灵芝具有结构和功效迥异的特点,共享各地灵芝相关研究成果,可使灵芝多糖得到高效利用,从而拓宽其市场潜在价值。顺应全球数字化发展方向,应针对具有地域特点的中草药和药食同源性食材开设全领域共享的结构分析和活性功能研究方面的信息共享平台,让研发者和企业获得准确的信息,可更有地效推广灵芝等药(食)同源的中药。
未来趋势上,针对灵芝多糖的化学结构和构型表征仍需继续研究。虽然目前有许多现代检测分析技术检测了天然多糖的物化性质,但仍需进一步针对灵芝多糖进行修饰改造或针对特定功能人工合成,达到批量生产的条件。并且,灵芝多糖的复配产品也有待进一步研发,使其复配产品在口感和安全性上满足人群需求,与有毒副作用的药物联合协同治疗,减小此类药物的使用剂量,减缓其毒副作用,减轻患者自身损伤程度。为了保证其安全性和功效的一致性,可利用实时无损监测技术,实现灵芝培育的标准化生产。此外,灵芝多糖的研发产品可以是多领域结合,例如结合基因组探究,利用基因工程对其修饰,使具有特定功能的结构片段高效表达,提高产品纯度的同时达到高效无毒害的目的,从而量产出针对性强、高纯度、无毒害产品。
