小鼠脾脏和外周血免疫细胞及部分细胞因子的增龄性变化
2022-02-16吴小雨何心怡陶志炜马学乾朱柏旭李宗芳西安交通大学第二附属医院生物诊断治疗国家地方联合工程研究中心西安70004西安交通大学第二附属医院肿瘤科通讯作者mailjiangweixjtu56xjtueducn
吴小雨,何心怡,陶志炜,马学乾,朱柏旭,李宗芳,,江 维,(西安交通大学第二附属医院生物诊断治疗国家地方联合工程研究中心,西安 70004;西安交通大学第二附属医院肿瘤科;通讯作者,E-mail:jiangweixjtu56@xjtu.edu.cn)
衰老是生命过程中不可抗拒的自然规律,人口老龄化已逐步成为我国重大社会问题[1]。衰老常表现为免疫功能的减退或紊乱,如淋巴结中淋巴细胞的减少、运动异常、T淋巴细胞和B淋巴细胞之间的协作异常等,因此老年人发生严重感染的风险增高、对疫苗的反应性降低、肿瘤和自身免疫疾病的风险增高[2]。脾脏不但具有造血功能、滤血功能、储血功能等,还是机体最大的二级免疫器官[3]。脾脏与多种免疫相关性疾病的发生发展相关,比如感染、肿瘤、肝脓肿等[4-7]。随着年龄的增长,脾脏也发生了显著的变化,比如有研究报道老年小鼠脾脏边缘区B淋巴细胞的运动能力、产生抗体的能力均降低,脾脏的白髓增大[8,9]。但是现有的研究主要集中于脾脏单个细胞表型和功能的改变,尚缺少对脾脏增龄性变化的动态研究。因此,本研究旨在探索不同年龄小鼠脾脏和外周血免疫细胞及细胞因子的变化。
1 材料与方法
1.1 主要试剂
大鼠抗小鼠FITC-labeled CD3、大鼠抗小鼠PE-labeled CD19、大鼠抗小鼠PE-labeled CD4、大鼠抗小鼠APC-labeled CD8、大鼠抗小鼠APC-labeled CD49b、大鼠抗小鼠FITC-labeled Ly6G、大鼠抗小鼠PE-labeled Ly6C、大鼠抗小鼠CD16/32、大鼠抗小鼠PE-cy7-labeled CD11b、大鼠抗小鼠FITC-labeled CD11c抗体,均购自美国Biolegend公司。小鼠白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒、小鼠IL-6 ELISA试剂盒、小鼠干扰素γ(interferon-γ,IFN-γ)ELISA试剂盒,均购自上海西唐生物科技有限公司。
1.2 实验动物
雄性C57BL/6J小鼠24只(1月龄7只、2月龄7只、12月龄7只、17月龄3只),SPF级,购于西安交通大学医学部实验动物中心,生产许可证号:SYXK(陕)2018-001,饲养于西安交通大学医学部实验动物中心SPF标准动物房内。按月龄将其分为4组:幼年组(1月龄)7只、青年组(2月龄)7只、中年组(12月龄)7只、老年组(17月龄)3只。所有小鼠在同一时间麻醉,取脾脏和外周血,并检测脾脏质量、计算脾脏指数,制备脾脏和外周血单细胞悬液、血清、脾脏组织悬液。实验经西安交通大学医学部伦理委员会批准。
1.3 脾脏质量和脾脏指数测定
利用小动物呼吸系统4%异氟烷吸入法麻醉小鼠并称重,打开小鼠腹腔,无菌取脾脏、无菌滤纸重复吸收水分并称取脾脏干质量,计算脾指数,即脾脏质量/体质量。
1.4 外周血及脾脏单细胞悬液制备
不同月龄小鼠在同一时间麻醉后取其脾脏,置于70 μm细胞筛网上研磨,用含2%胎牛血清的PBS冲洗研磨后的组织,并经70 μm尼龙筛网过滤,过滤后获取的细胞悬液在4 ℃、350g离心5 min,弃上清,并重复1次,取沉淀细胞并加入2 ml PBS重悬制备脾脏细胞悬液备用。眼球取血法采血于EDTA抗凝管中形成外周血细胞悬液备用。将5 ml红细胞裂解液加入上述所制备脾脏细胞悬液、外周血细胞悬液并充分混匀,冰上孵育5 min,用含2%胎牛血清的PBS 9 ml终止,4 ℃、350g离心5 min,取沉淀细胞,用5 ml PBS重悬,4 ℃、350g离心5 min;取其沉淀细胞并用1 ml PBS重悬,计数,调悬液细胞浓度为1×107~2×107个/ml,放置于冰上,备用。
1.5 流式细胞术检测脾脏和外周血免疫细胞比例
吸取100 μl上述所制备的细胞悬液加入流式管中,用大鼠抗小鼠CD16/32抗体4 ℃孵育15 min,加入相应的抗体(CD3-CD19+B细胞、CD3+CD4+T细胞、CD3+CD8+T细胞、CD3-CD49b+自然杀伤细胞(natural killer cell, NK)、CD11b-CD11c+树突状细胞(dendritic cell, DC)、CD11b+Ly6CmedLy6G+粒细胞、CD11b+Ly6ChiLy6G-单核细胞),4 ℃避光孵育30 min,加入含1%胎牛血清的PBS 2 ml,4 ℃下350g离心5 min,弃上清液;重复1次,最后加入0.5 ml PBS重悬,用FACS Canto Ⅱ流式细胞术(BD,美国)检测结果。
1.6 ELISA检测脾脏和外周血炎症因子水平
4%异氟烷吸入法麻醉小鼠,眼球取血法采血0.5 ml左右,血液在室温下凝固1 h,5 000 r/min离心10 min,获得血清。取脾脏组织,称重后放入1 ml含蛋白酶抑制剂RIPA裂解液的离心管中,并置于冰上,用组织匀浆仪匀浆脾脏组织,冰上孵育20 min,14 000g离心10 min,取上清。ELISA试剂盒测定脾脏和外周血IL-1β、IL-6和IFN-γ水平。
1.7 统计学分析
2 结果
2.1 脾脏质量变化
随着月龄的增长,小鼠的体质量呈逐渐增加趋势,中年组小鼠体质量达到最大值,但中年组与老年组相比差异无统计学意义(P>0.05,见图1)。随着月龄的增长,小鼠脾脏质量也呈逐渐增加趋势,与幼年组小鼠相比,老年组小鼠脾脏质量显著增加(P<0.05),其他组间相比差异无统计学意义(P>0.05,见图1)。随着月龄的增长,小鼠脾脏指数呈逐渐下降趋势,其中中年组小鼠脾脏指数最小,与幼年组龄小鼠相比较,中年组小鼠脾脏指数显著降低(P<0.01),其他组间相比差异无统计学意义(P>0.05,见图1)。

与幼年组比较,*P<0.05,**P<0.01;与青年组比较,##P<0.01图1 不同月龄小鼠体质量、脾脏质量、脾脏指数比较Figure 1 Comparison of body weight, spleen weight and spleen index among mice of different ages
2.2 脾脏免疫细胞的变化
中年组小鼠脾脏CD3-CD19+B淋巴细胞比例相对幼年组小鼠、青年组小鼠均明显降低(P<0.05或P<0.01,见图2);同样,老年组小鼠脾脏CD3-CD19+B淋巴细胞比例相对幼年组小鼠、青年组小鼠也明显降低(P<0.05或P<0.01,见图2)。不同月龄小鼠中,青年组小鼠脾脏CD3+CD4+T淋巴细胞比例最高,与幼年组小鼠相比差异有统计学意义(P<0.05,见图2);而与中年组和老年组相比差异无统计学意义。不同年龄小鼠脾脏CD3+CD8+T细胞、CD3-CD49b+自然杀伤细胞比例均无显著差异(P>0.05,见图2)。中年组小鼠脾脏CD11b+Ly6ChiLy6G-单核细胞比例最高,相对幼年组小鼠、青年组小鼠差异均有统计学意义(P<0.05),而与老年组小鼠相比差异无统计学意义(P>0.05,见图2)。不同年龄小鼠脾脏CD11b+Ly6CmedLy6G+粒细胞、CD11b-CD11c+树突状细胞比例差异无统计学意义(P>0.05,见图2)。
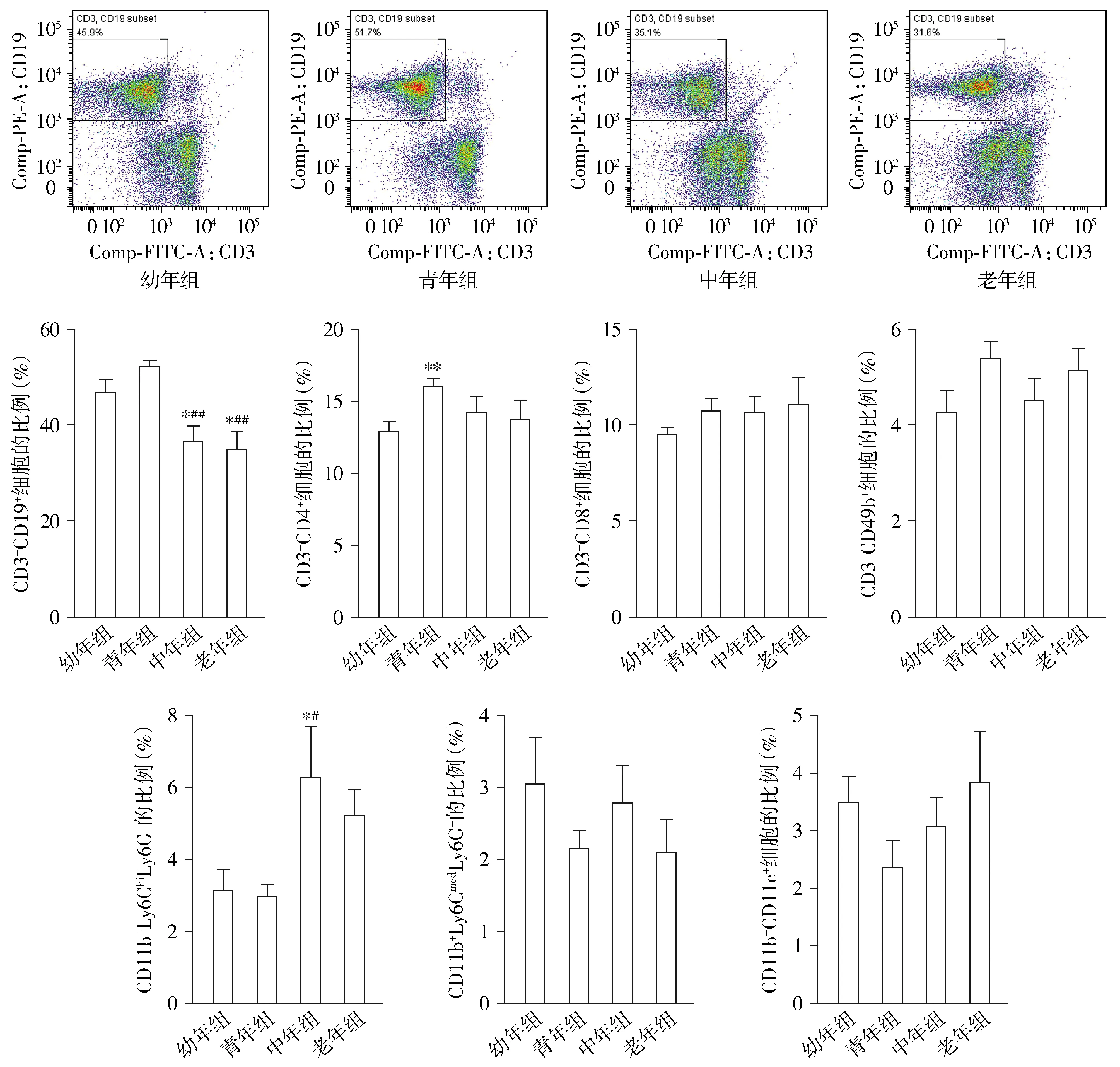
与幼年组比较,*P<0.05 vs,**P<0.01;与青年组比较,#P<0.05,##P<0.01图2 不同月龄小鼠脾脏免疫细胞比例的比较Figure 2 Comparison of the proportion of spleen immune cells among mice of different ages
2.3 外周血免疫细胞的变化
中年组小鼠外周血CD3+CD4+T淋巴细胞比例相对幼年组小鼠、青年组小鼠均明显降低(P<0.05或P<0.01);同样,老年组小鼠外周血CD3+CD4+T淋巴细胞比例相对幼年组和青年组小鼠均明显降低(P<0.01,见图3)。中年组小鼠外周血CD3+CD8+T淋巴细胞比例最高,与幼年组和青年组小鼠相比差异均有统计学意义(P<0.05),与老年组小鼠相比差异无统计学意义(P>0.05,见图3)。不同年龄小鼠外周血CD3-CD19+B细胞、CD3-CD49b+NK比例差异无统计学意义(P>0.05,见图3)。中年组小鼠外周血CD11b+Ly6ChiLy6G-单核细胞比例相对幼年组和青年组小鼠均显著升高(P<0.01);同样,老年组小鼠外周血CD11b+Ly6ChiLy6G-单核细胞比例相对幼年组和青年组小鼠均显著升高(P<0.01,见图3)。不同年龄小鼠外周血CD11b+Ly6CmedLy6G+粒细胞、CD11b-CD11c+DC比例差异无统计学意义(P>0.05,见图3)。
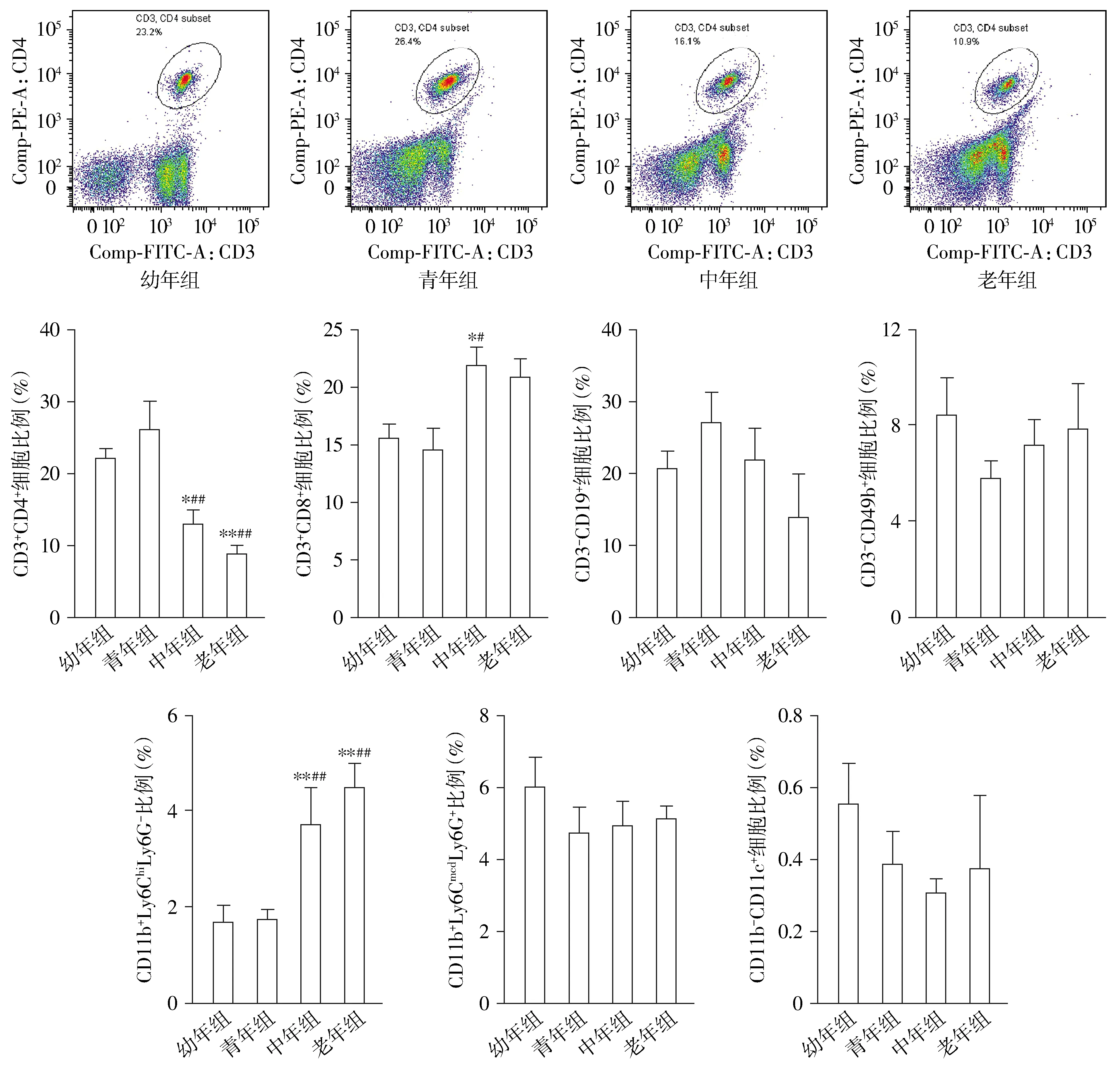
与幼年组比较,*P<0.05,**P<0.01;与青年组比较,#P<0.05,##P<0.01图3 不同月龄小鼠外周血免疫细胞比例的比较Figure 3 Comparison of the proportion of blood immune cells among mice of different ages
2.4 脾脏细胞因子的变化
中年组小鼠脾脏IL-1β相对青年组小鼠明显降低(P<0.01);同样,老年组小鼠脾脏IL-1β相对青年组小鼠明显降低(P<0.05,见图4)。不同年龄小鼠脾脏IL-6、IFN-γ差异无统计学意义(P>0.05,见图4)。
2.5 外周血细胞因子的变化
不同年龄小鼠外周血IL-1β、IFN-γ差异无统计学意义(P>0.05,见图5)。中年组小鼠血清IL-6相对幼年组和青年组小鼠均显著升高(P<0.01);同样,老年组小鼠血清IL-6相对幼年组、青年组小鼠均显著升高(P<0.05,见图5)。

与青年组比较,#P<0.05,##P<0.01图4 不同月龄小鼠脾脏细胞因子的比较Figure 4 Comparison of the levels of spleen cytokines among mice of different ages

与幼年组比较,*P<0.05,**P<0.01;与青年组比较,#P<0.05,##P<0.01图5 不同月龄小鼠血清细胞因子的比较Figure 5 Comparison of the serum levels of cytokines among mice of different ages
3 讨论
脾脏是胚胎时期的重要造血器官,出生后脾脏发育成为最大的淋巴器官,是机体发生免疫应答的重要场所[10]。有研究表明小鼠生后1 d,脾脏才可见动脉周围淋巴鞘,随后出现脾小结,随着年龄的增长,小鼠脾小结模糊,脾脏白髓和红髓之间界限逐渐不清,白髓所占比例减小,免疫能力随之下降,因此,脾脏处于一个动态发育过程[9,11]。该研究结果提示,随着年龄的增长小鼠脾脏质量增加,小鼠脾脏指数却是逐渐下降,小鼠脾指数随年龄增长而降低是因为体质量增长速度明显快于脾脏增长速度。
文献报道老年小鼠脾脏边缘区巨噬细胞的数量减少以及功能减弱[12],随着年龄增长,小鼠脾脏中的趋化因子如CCL19、CCL21等表达异常,导致脾脏T淋巴细胞、B淋巴细胞的趋化异常,进而导致淋巴细胞的比例失调[13-15]。而该研究结果提示青年(2月龄)小鼠脾脏CD3+CD4+T淋巴细胞比例最高,而随着月龄增长,小鼠脾脏CD3-CD19+B淋巴细胞比例降低。同样,随着月龄增长,外周血CD3+CD4+T淋巴细胞比例降低而CD3+CD8+T淋巴细胞比例增高,说明不同月龄小鼠脾脏和外周血的淋巴细胞组成存在差异,可能是由于不同年龄小鼠趋化因子表达的差异造成。
单核巨噬细胞是造血系统中最具可塑性的一群细胞,具有吞噬、抗原提呈、修复等功能,是机体免疫系统的重要防线[16]。脾脏红髓含有大量的单核巨噬细胞,在清除衰老细胞等滤血作用、吞噬病原物和抗原递呈过程中起重要作用[17]。该研究结果表明中年(12月龄)小鼠脾脏CD11b+Ly6ChiLy6G-单核细胞比例最高,随后单核细胞比例有下降趋势,说明中年小鼠脾脏的滤血作用可能最强,随着年龄增长而减弱。但该研究仅探索了脾脏免疫细胞比例的变化,对不同月龄小鼠脾脏免疫细胞功能的变化还未知。同时,基质细胞是脾脏的重要组成成分,对脾脏免疫细胞的趋化定位、增殖与凋亡、免疫功能都具有重要的作用[18]。不同月龄小鼠脾脏基质细胞的变化以及对脾脏免疫细胞比例及其功能的影响还需进一步探讨。
细胞因子是免疫细胞分泌的炎症产物,在免疫反应中发挥作用[19]。脾脏边缘区B淋巴细胞对T淋巴细胞功能的调控、细胞因子的分泌、免疫反应的调节等具有重要的作用[20]。实验结果显示随着月龄增长,小鼠脾脏IL-1β表达降低,可能是由于随着月龄增长,脾脏CD3-CD19+B淋巴细胞比例降低而导致脾脏分泌的IL-1β减少造成的。IL-6主要是由单核巨噬细胞分泌的一种促炎因子[18]。而实验的结果显示随着月龄增长,小鼠外周血IL-6表达增高。可能是由于随着月龄增长,外周血CD11b+Ly6ChiLy6G-单核细胞比例增高,单核细胞分泌的IL-6增多造成的,但其具体机制以及IL-1β、IL-6的变化对机体免疫的作用还需进一步研究。综上所述,随着月龄增长,脾重呈上升趋势而脾脏指数呈下降趋势,脾脏CD3-CD19+B淋巴细胞比例降低,外周血CD3+CD4+T淋巴细胞比例降低而CD3+CD8+T淋巴细胞、CD11b+Ly6ChiLy6G-单核细胞比例增高,同时小鼠脾脏IL-1β表达降低而外周血IL-6表达增高,可能与不同年龄机体免疫状态不同相关。
