下调lncRNA MCM3AP-AS1通过调控miR-205-5p/NEGR1轴抑制动脉粥样硬化的机制
2022-02-16张维新刘红石志坚程亚丽
张维新 刘红 石志坚 程亚丽
(郑州市中医院心内科,河南 郑州 450007)
心血管疾病是严重威胁人类健康的疾病,动脉粥样硬化(AS)是心血管疾病的病理基础〔1〕。内皮细胞凋亡是内皮损伤的主要形式,在AS的发生发展中起重要作用〔2〕。氧化性低密度脂蛋白(OX-LDL)可介导内皮细胞氧化应激和凋亡相关信号通路,导致内皮细胞损伤,促进AS的发生发展〔3〕。因此,探讨影响OX-LDL诱导的内皮细胞凋亡的分子机制可为AS的预防和治疗提供新途径。MCM3AP-AS1是一种长链非编码RNA(lncRNA),对多种疾病的发生发展起调控作用。研究显示,MCM3AP-AS1参与调控胶质瘤〔4〕、肝癌〔5〕等肿瘤细胞的恶性行为;MCM3AP-AS1 在骨关节炎中表达上调,其通过靶向 miR-142-3p引起HMGB1表达的上调,进而促进软骨细胞凋亡,加剧骨关节炎的发展进程〔6〕。然而,MCM3AP-AS1在内皮细胞损伤的影响还未知。
生物信息学软件预测显示,MCM3AP-AS1可能靶向调控miR-205-5p的靶基因,神经生长调节因子(NEGR)1可能是miR-205-5p的靶基因。研究显示,miR-205-5p可靶向抑制HMGB1的表达减轻缺血再灌注诱导的脑组织氧化应激和炎症反应,改善脑缺血再灌注损伤〔7〕;过表达miR-25-5p可通过靶向下调NEGR1表达进而抑制OX-LDL诱导的人脑微血管内皮细胞(HBMECs)凋亡〔8〕。目前,MCM3AP-AS1能否靶向miR-205-5p/NEGR1影响血管内皮细胞损伤也还未知。本研究主要探讨了MCM3AP-AS1对OX-LDL诱导的人脐静脉内皮细胞(HUVEC)增殖和凋亡的影响,并以miR-205-5p/NEGR1轴为切入点,探讨了MCM3AP-AS1影响OX-LDL诱导的HUVEC细胞增殖和凋亡的作用机制。
1 材料与方法
1.1细胞和试剂 HUVEC细胞购自中国科学院上海细胞库;四甲基偶氮唑蓝(MTT,美国Sigma公司);胎牛血清(FBS,浙江天杭生物科技有限公司);DMEM培养基,二喹啉甲酸(BCA)蛋白检测试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒(北京索莱宝);LipofectamineTM2000试剂盒(美国Invitrogen公司);miR-205-5p模拟物(mimics)、MCM3AP-AS1小干扰RNA(si-MCM3AP-AS1)、NEGR1的小干扰RNA(si-NEGR1)和过表达载体(pcDNA-NEGR1)、模拟对照序列(miR-con)、小干扰RNA阴性对照序列(si-con)、空载体(pcDNA-con,广州锐博生物科技有限公司);Trizol试剂、逆转录试剂盒和PCR试剂盒(日本TAKARA公司);PCR引物,上海生工;NEGR1抗体(中国Abcam公司);细胞周期蛋白(Cyclin)D1和活化的半胱天冬酶(Cleaved-caspase)-3抗体(北京中杉);双荧光素酶活性检测试剂盒(美国Promega公司)。
1.2方法
1.2.1细胞培养和转染 复苏HUVEC细胞,加含10% FBS的DMEM培养基(完全培养基),置于37℃、CO2体积分数5%、湿度97%的培养箱中培养。取2.5 ml对数期HUVEC细胞(2.5×104个/ml)接种于6孔板中,当细胞融合至60%时,更换为不含FBS的培养基。利用LipofectamineTM2000试剂盒,分别转染si-MCM3AP-AS1、si-NEGR1、si-con、miR-205-5pmimics、miR-con、pcDNA-con、pcDNA-MCM3AP-AS1、共转染miR-205-5p mimics与pcDNA-con、miR-205-5p mimics与pcDNA-MCM3AP-AS1、si-MCM3AP-AS1与pcDNA-NEGR1、si-MCM3AP-AS1与pcDNA-con至HUVEC细胞。转染12 h后,更换为完全培养基。再培养24 h,收集细胞用于后续实验。
1.2.2细胞分组 HUVEC细胞分为OX-LDL组(用含10 mg/L〔9〕OX-LDL的培养基干预48 h)和对照组(NC组,用不含OX-LDL的培养基干预48 h)。转染si-con、si-MCM3AP-AS1、si-NEGR1、miR-205-5pmimics、miR-con、共转染si-MCM3AP-AS1与pcDNA-NEGR1、si-MCM3AP-AS1+pcDNA-con的HUVEC细胞均用含10 mg/L OX-LDL的培养基干预48 h,并分别记为OX-LDL+si-con组、OX-LDL+si-MCM3AP-AS1组、OX-LDL+si-NEGR1组、OX-LDL+miR-205-5p组、OX-LDL+miR-con组、OX-LDL+si-MCM3AP-AS1+pcDNA-NEGR1组、OX-LDL+si-MCM3AP-AS1+pcDNA-con组。
1.2.3qRT-PCR检测细胞中MCM3AP-AS1、miR-205-5p和NEGR1mRNA表达 取2.5 ml HUVEC细胞或转染后的细胞(2.5×104个/ml)均接种于6孔板中,培养4 h后,吸弃培养基,按照上述1.2.2分组处理。培养后,收集各组细胞,用Trizol试剂提取细胞中总RNA,逆转录为cDNA后,进行PCR反应。反应程序:95℃ 5 min,95℃ 10 s,60℃ 30 s,72℃ 30 s,共40个循环。引物序列:MCM3AP-AS1上游5′-GTGCCCAGTA GCCGATG-3′,下游5′-CGTGCGATGACAGTCG AT-3′;miR-205-5p上游5′-TGCGAAAGTC CGTGAACGG-3′,下游5′-AGGTACCGATAGCAGTGAT-3′;NEGR1上游5′-TGGGCAGCAA CGACCGATGA-3′,下游5′-GTACGATAGTCATAGT CTAAC-3′;U6上游5′-GGGCCGATGAAAATGCAGAG-3′,下游5′-CCAGAAGCCATGATGATCT-3′;GAPDH上游5′-CGGATTTGGTCGTATTGGG-3′,下游5′-CTGGAAGATGGTGATGGGATT-3′。2-△△Ct法分别计算MCM3AP-AS1和NEGR1mRNA相对GAPDH、miR-205-5p相对U6的表达量。
1.2.4Western印迹法检测细胞中NEGR1、CyclinD1和Cleaved-caspase-3蛋白表达 细胞接种和培养同1.2.3。用RIPA蛋白裂解液提取细胞中总蛋白,经BCA法测定蛋白含量后,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,转至聚偏氟乙烯(PVDF)膜,并用5 %脱脂牛奶封闭1 h。于4℃冰箱中分别用NEGR1(1∶600)、CyclinD1(1∶400)、Cleaved-caspase-3(1∶500)和β-actin(1∶500)一抗孵育过夜。洗膜后,置于辣根过氧化酶标记的二抗(1∶2 000)中37℃孵育1 h。加显影液,避光显影,曝光拍照,ImageJ软件分析目的蛋白相对β-actin的表达量。
1.2.5MTT检测细胞增殖 取200 μl HUVEC细胞或转染后的细胞(2.5×104个/ml)接种于96孔板中,培养4 h后,弃培养基。按照上述1.2.2分组处理后,每孔加20 μl MTT(5 g/L),孵育4 h。弃培养基,每孔加150 μl二甲基亚砜,振荡混匀,于酶标仪490 nm处测吸光度(A)值。实验重复3次。细胞存活率(%)=A实验组/A对照组×100%。
1.2.6流式细胞仪检测细胞凋亡 细胞接种和培养同1.2.3,收集各组细胞。用PBS清洗后,加500 μl结合缓冲液,重悬细胞。加10 μl膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC),室温避光孵育10 min。加5 μl碘化丙啶(PI),室温避光反应5 min,上流式细胞仪检测。
1.2.7双荧光素酶报告基因实验 由上海捷瑞生物工程有限公司分别合成含有miR-205-5p结合位点的MCM3AP-AS1的核苷酸序列及NEGR1的3′非翻译区(UTR),并插入pGL3-Promoter质粒载体中,构建MCM3AP-AS1野生型重组质粒(WT-MCM3AP-AS1)和NEGR1野生型重组质粒(WT-NEGR1)。利用定点突变技术将结合位点突变后,插入pGL3-Promoter质粒载体中,MCM3AP-AS1突变型重组质粒(MUT-MCM3AP-AS1)和NEGR1突变型重组质粒(MUT-NEGR1)。取2.5 ml对数期HUVEC细胞(2.5×104个/ml)接种于6孔板中,当细胞融合至60%时,更换为不含FBS的培养基。利用LipofectamineTM2000试剂盒,分别将WT-MCM3AP-AS1(或MUT-MCM3AP-AS1)与miR-205-5pmimic(或miR-con),WT-NEGR1(MUT-NEGR1)与miR-205-5pmimic(或miR-con)共转染至HUVEC细胞。转染12 h后,更换为完全培养基。再培养24 h后,收集细胞。利用双荧光素酶活性检测试剂盒检测荧光素酶活性,以萤火虫与海肾的荧光强度比值表示荧光素酶活性。
1.3统计学分析 采用SPSS22.0软件进行t检验,方差分析,SNK-q检验。
2 结 果
2.1OX-LDL对HUVEC细胞中MCM3AP-AS1、miR-205-5p和NEGR1的表达的影响 OX-LDL组HUVEC细胞中MCM3AP-AS1、NEGR1 mRNA和蛋白的表达量均高于NC组(P<0.05),而miR-205-5p表达量低于NC组(P<0.05)。见图1,表1。
表1 OX-LDL诱导HUVEC细胞后MCM3AP-AS1、NEGR1 和miR-205-5p表达水平
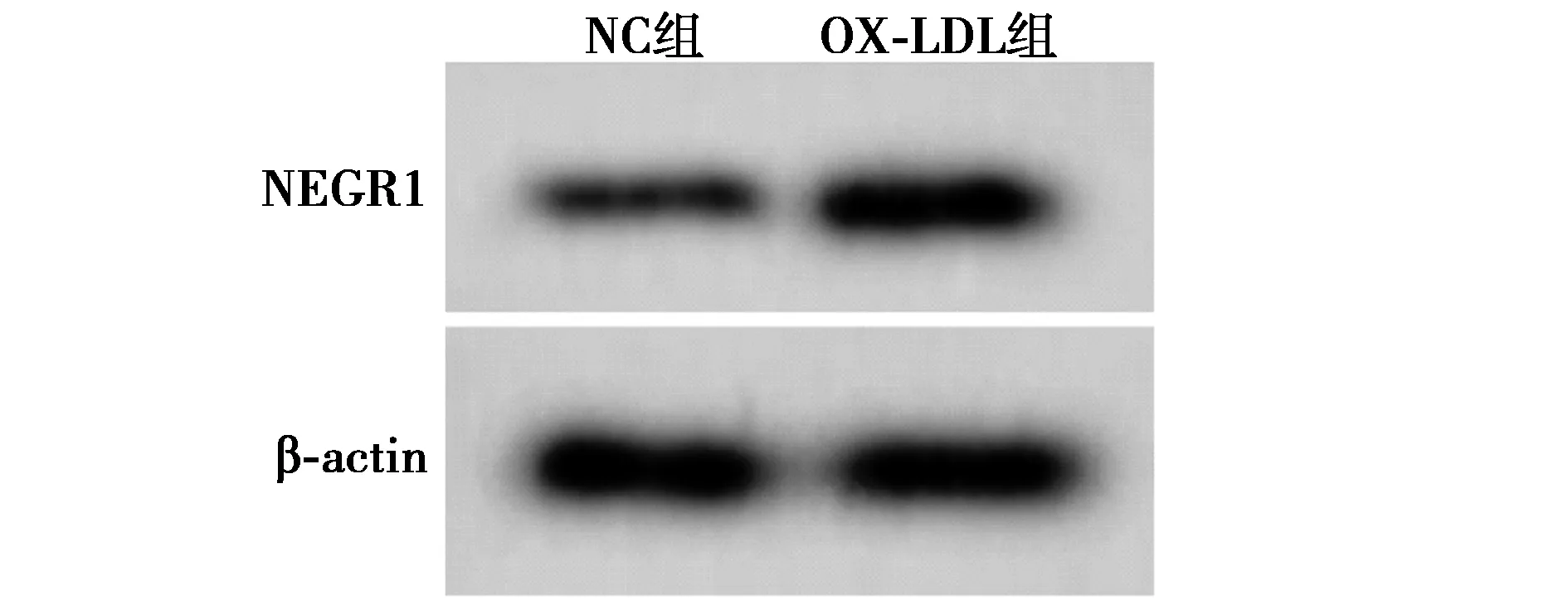
图1 Western印迹检测NEGR1蛋白表达
2.2下调MCM3AP-AS1对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响 OX-LDL组HUVEC细胞存活率和CyclinD1蛋白表达量均明显低于NC组(P<0.05),而MCM3AP-AB1水平、细胞凋亡率和Cleaved-caspase-3蛋白表达量均明显高于NC组(P<0.05)。OX-LDL+si-MCM3AP-AS1组HUVEC细胞存活率和CyclinD1蛋白表达量均明显高于OX-LDL+si-con组(P<0.05),MCM3AP-AS1水平、凋亡率和Cleaved-caspase-3蛋白表达量均明显低于OX-LDL+si-con组(P<0.05)。见图2、图3,表2。
表2 下调MCM3AP-AS1对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响
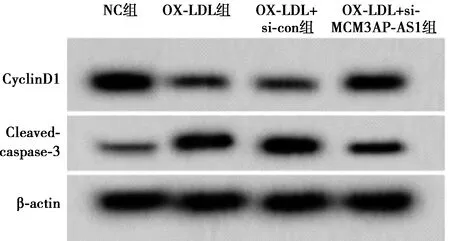
图2 Western印迹检测CyclinD1和Cleaved-caspase-3蛋白表达
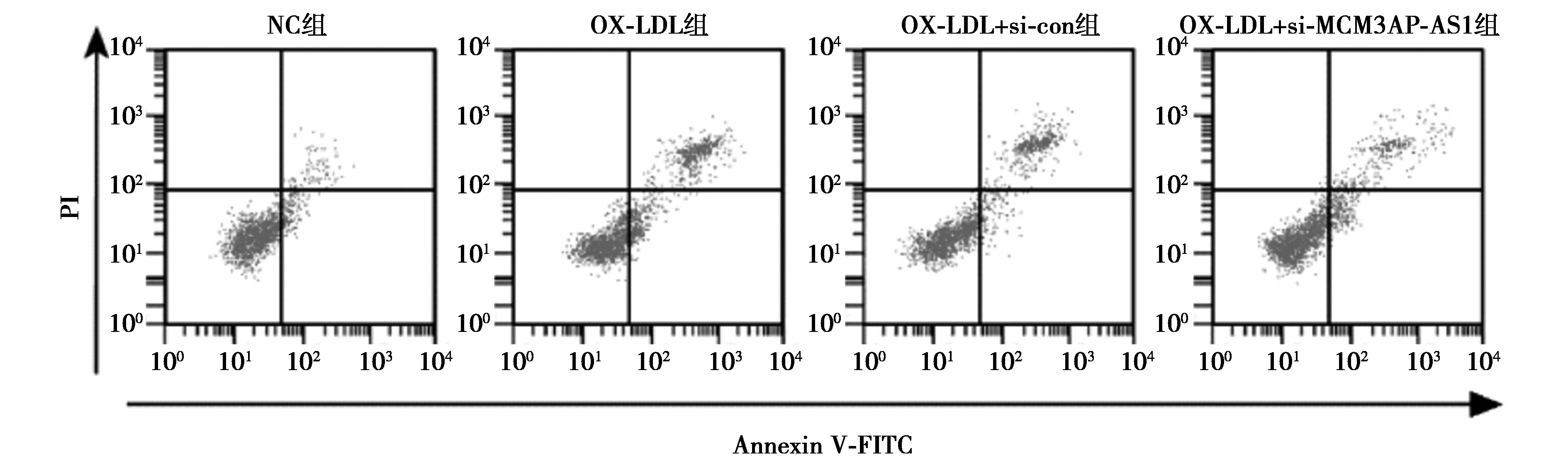
图3 流式细胞仪检测下调MCM3AP-AS1对OX-LDL诱导的HUVEC细胞凋亡的影响
2.3下调NEGR1对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响 OX-LDL+si-NEGR1组HUVEC细胞存活率和CyclinD1蛋白表达量均高于OX-LDL+si-con组(P<0.05),凋亡率、NEGR1和Cleaved-caspase-3蛋白表达量均低于OX-LDL+si-con组(P<0.05)。见表3,图4,图5。
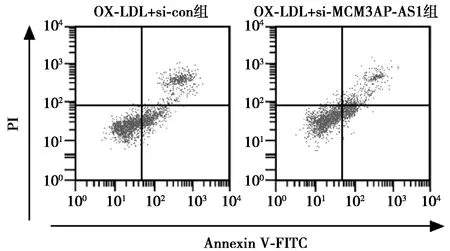
图4 流式细胞仪检测下调NEGR1对OX-LDL诱导的HUVEC细胞凋亡的影响
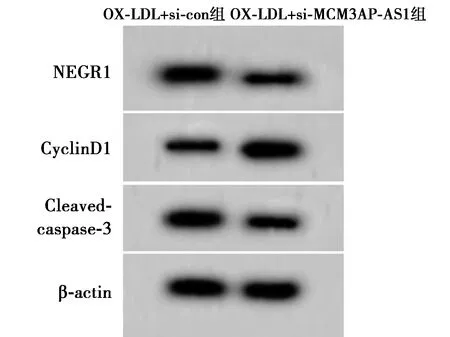
图5 Western印迹检测NEGR1、CyclinD1、Cleaved-caspase-3蛋白表达
表3 下调NEGR1 对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响
2.4上调miR-205-5p对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响 OX-LDL+miR-205-5p组miR-205-5p水平、HUVEC细胞存活率和CyclinD1蛋白表达量均高于OX-LDL+miR-con组(P<0.05),凋亡率和Cleaved-caspase-3蛋白表达量均低于OX-LDL+miR-con组(P<0.05)。见图6,图7,表4。
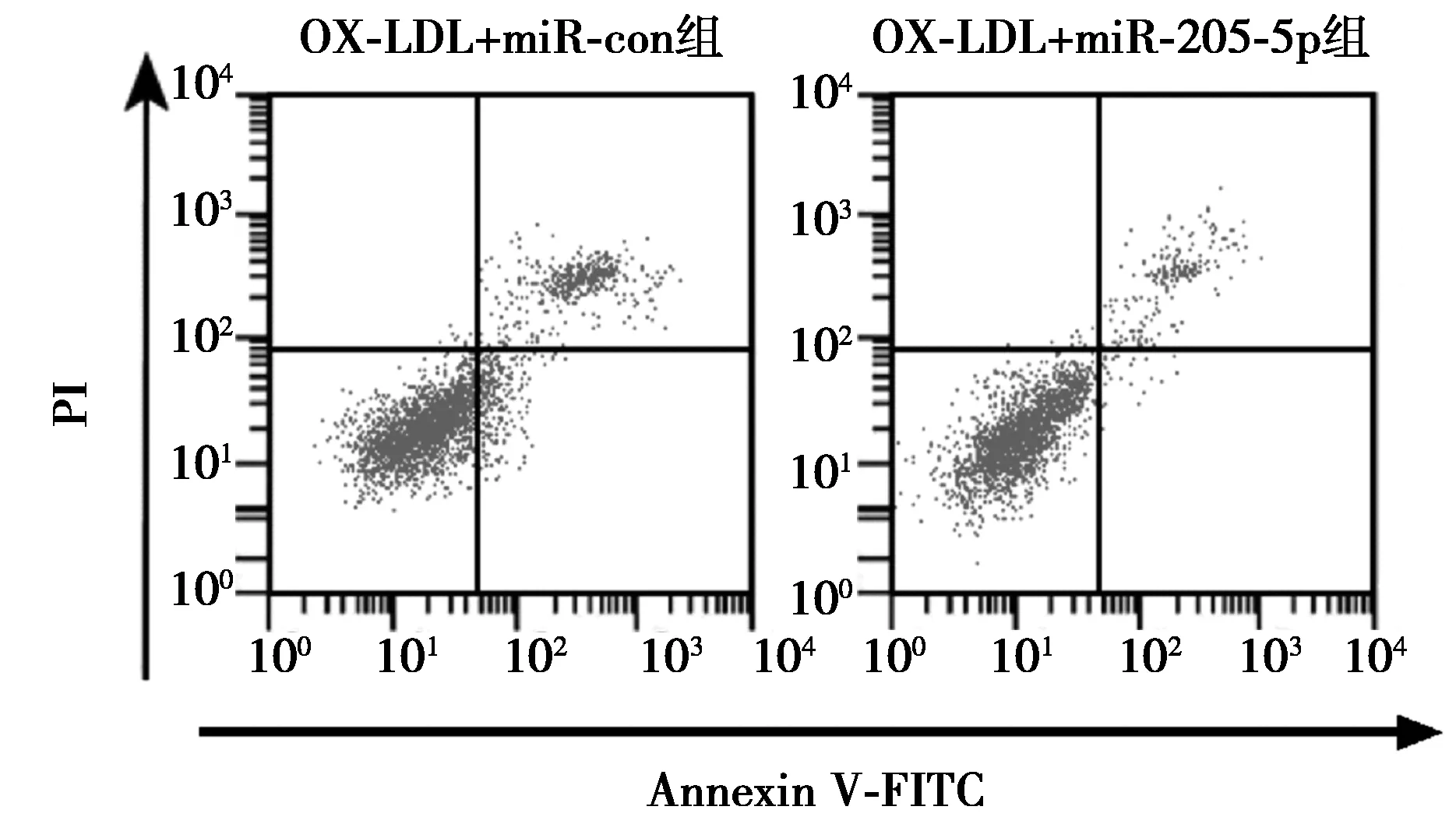
图6 流式细胞仪检测上调miR-205-5p对OX-LDL诱导的HUVEC细胞凋亡的影响

图7 Western印迹检测上调miR-205-5p对OX-LDL诱导的HUVEC细胞中CyclinD1、Cleaved-caspase-3蛋白表达的影响
表4 上调miR-205-5p对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响
2.5MCM3AP-AS1靶向miR-205-5p Starbase生物信息学软件预测显示的MCM3AP-AS1与miR-205-5p的结合位点见图8。共转染WT-MCM3AP-AS1与miR-205-5p的HUVEC细胞荧光素酶活性为(0.25±0.03),显著低于共转染WT-MCM3AP-AS1与miR-con的HUVEC细胞(1.00±0.10,t=21.551,P<0.05);共转染MUT-MCM3AP-AS1与miR-205-5p的HUVEC细胞荧光素酶活性为(1.04±0.13),与共转染MUT-MCM3AP-AS1与miR-con的HUVEC细胞荧光素酶活性(1.08±0.12)比较无显著变化(t=0.678,P>0.05)。si-MCM3AP-AS1组miR-205-5p表达量为(2.69±0.27),显著高于si-con组的(1.00±0.14,t=16.670,P<0.05)。

图8 starbase对miR-205-5p和MCM3AP-AS1结合进行预测示意图
2.6miR-205-5p靶向调控NEGR1表达 Starbase生物信息学软件预测显示的NEGR1 3′UTR与miR-205-5p的结合位点见图9。共转染WT-NEGR1与miR-con、WT-NEGR1与miR-205-5p的HUVEC细胞荧光素酶活性分别为(1.00±0.10、0.38±0.04),两者比较差异显著(t=177.459,P<0.05);共转染MUT-NEGR1与miR-con、MUT-NEGR1与miR-205-5p的HUVEC细胞荧光素酶活性分别为(1.10±0.12、1.15±0.13),两者比较差异无统计学意义(t=1.006,P>0.05)。miR-205-5p组NEGR1蛋白水平(0.14±0.01)显著低于miR-con组(0.42±0.04,t=20.373,P<0.05),见图10。

图9 NEGR1的3′UTR含有与miR-205-5p核苷酸序列互补的结合位点
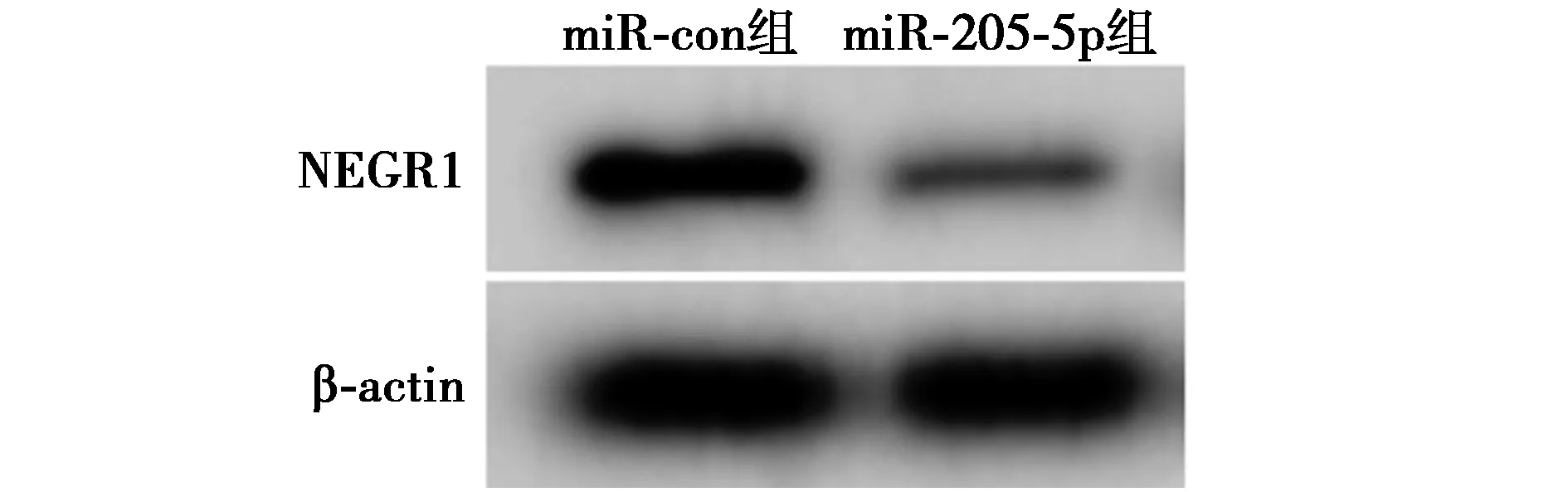
图10 Western印迹检测NEGR1 的表达
2.7上调NEGR1逆转下调MCM3AP-AS1对HUVEC细胞增殖和凋亡的影响 OX-LDL+si-MCM3AP-AS1+pcDNA-NEGR1组HUVEC细胞存活率和CyclinD1蛋白表达量均低于OX-LDL+si-MCM3AP-AS1+pcDNA-con组(P<0.05),而细胞凋亡率和Cleaved-caspase-3蛋白表达量均高于OX-LDL+si-MCM3AP-AS1+pcDNA-con组(P<0.05)。图11,图12,见表5。
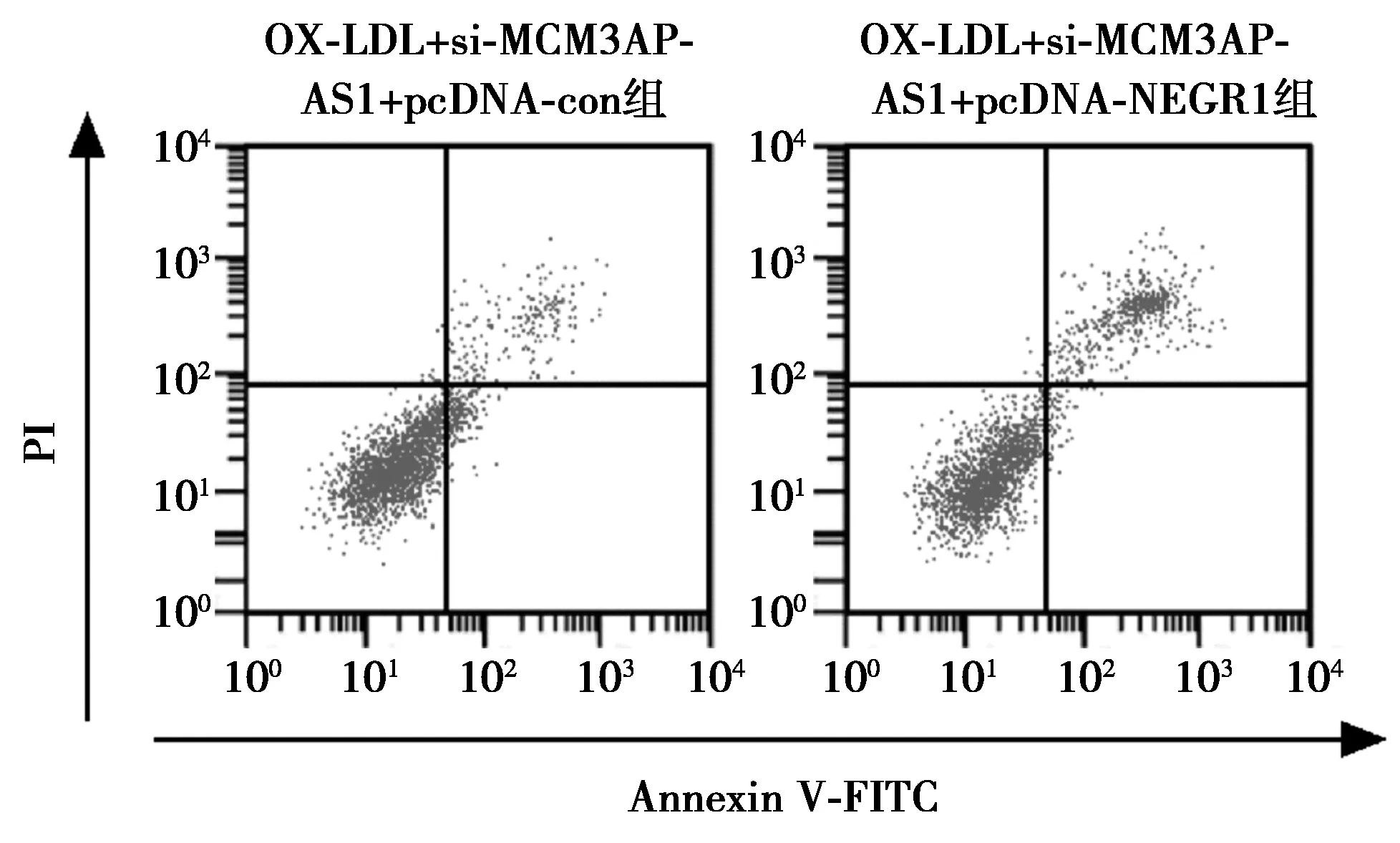
图11 上调NEGR1逆转下调MCM3AP-AS1对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响
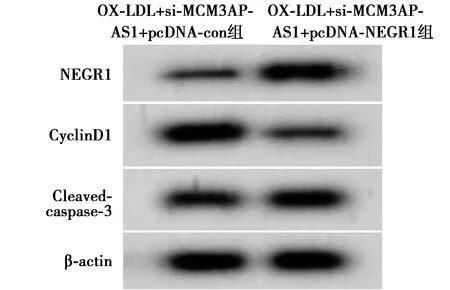
图12 Western印迹检测NEGR1、CyclinD1、Cleaved-caspase-3蛋白的表达
表5 上调NEGR1逆转下调MCM3AP-AS1对OX-LDL诱导的HUVEC细胞增殖和凋亡的影响
3 讨 论
血管内皮细胞是血管内膜的保护屏障,其受损或功能障碍可导致血管内膜的通透性增加,造成内膜功能紊乱,引发动脉粥样硬化〔10〕。OX-LDL可使炎性细胞黏附于内皮,造成内皮细胞释放大量细胞因子,引起斑块破裂及血栓的形成,是血管内皮细胞损伤的关键因素之一〔11〕。本研究结果与相关研究报道结果一致〔12〕,说明OX-LDL可阻碍HUVEC细胞增殖,并促进其凋亡。
近年来,随着对lncRNA研究的深入,发现lncRNA参与动脉粥样硬化的发生发展。Tao等〔13〕研究显示,lncRNA CASC11通过下调IL-9和调节血管平滑肌细胞的凋亡和增殖改善动脉粥样硬化。作为一种lncRNA,MCM3AP-AS1参与肿瘤、骨关节炎等多种疾病的发展进程〔14~16〕。本研究结果说明下调MCM3AP-AS1能够促进OX-LDL诱导的HUVEC细胞增殖,并抑制其凋亡,提示MCM3AP-AS1有可能成为减轻血管内皮细胞损伤的分子靶点。
本研究证实了MCM3AP-AS1在HUVEC细胞中靶向结合并负调控miR-205-5p的表达。研究显示,过表达miR-205-5p可通过靶向下调HMGA2的表达进而抑制高糖诱导的人肾系膜细胞炎症、细胞外基质积累和氧化应激,miR-205-5p/HMGA2轴参与糖尿病肾病的发展进程〔17〕。本研究结果提示miR-205-5p有可能成为减轻血管内皮细胞损伤的分子靶点。
此外,本研究证实了NEGR1是miR-205-5p的靶基因。NEGR1是一种细胞黏附因子,已有研究显示,下调NEGR1表达可抑制内皮细胞的凋亡〔8〕,与本研究OX-LDL可促进HUVEC细胞中NEGR1表达,下调NEGR1表达可促进OX-LDL诱导的HUVEC细胞增殖并抑制细胞凋亡的结果一致。本研究进一步提示下调MCM3AP-AS1通过靶向miR-205-5p进而下调NEGR1的表达来促进OX-LDL诱导的HUVEC细胞增殖及抑制细胞凋亡。
