内质网应激信号在姜黄素诱导Jurkat细胞凋亡中的作用
2022-02-16段园园陈梦娇杨雪松李晨阳丁浩然王铭晖王弘珺
段园园 陈梦娇 杨雪松 李晨阳 丁浩然 王铭晖 王弘珺
(吉林医药学院基础医学院组织学与胚胎学教研室,吉林 吉林 132013)
急性T淋巴细胞白血病属于恶性白血病〔1.2〕。临床强化化疗可以显著提高急性T淋巴细胞白血病治愈率,但有效治疗与靶向治疗无效者或者同种干细胞移植失败者预后较差,50%成年患者或15%~20%儿童患者或面临死亡〔3〕。白血病与淋巴瘤细胞普遍存在基因表达异常和蛋白质翻译增加的情况,增加的未折叠蛋白或错误折叠蛋白引起内质网应激(ERS)〔3,4〕。如果化疗药物提高肿瘤细胞ERS,将导致内质网稳态失衡促进肿瘤凋亡。本研究体外培养Jurkat细胞,重点关注姜黄素诱导ERS对Jurkat细胞凋亡的影响。
1 材料与方法
1.1材料 实验细胞系Jurkat由吉林大学第一医院移植免疫学研究组提供;姜黄素、增强化学发光(ECL)液购自Sigma-Aldrich;甲基噻唑蓝(MTT)溶液、PBS缓冲液购自宝泰克生物公司;RPMI1640购自Gibco;胎牛血清购自Biological Industries;Muse凋亡试剂购自Merck Millipore;葡萄糖调节蛋白(GRP)-78抗体购自Santa Cruz;C/EBP同源蛋白(CHOP)抗体购自Cell Signaling;半胱氨酸天冬氨酸蛋白酶(Caspase)3抗体、Caspase4抗体和β-actin抗体购自SAB。
1.2Jurkat细胞培养 用含10%血清的RPMI1640(含双抗)培养细胞,将细胞置于37℃、5%CO2的培养箱中,每2~3 d进行细胞传代、换液。
1.3MTT比色法检测Jurkat细胞存活与增殖 按照5×104细胞/孔接种Jurkat细胞于96孔板,设空白、阴性对照和不同浓度姜黄素组;细胞置于37℃培养12 h或24 h后,每孔加20 μl MTT溶液,再培养4 h;每孔加100 μl三联液(10%十二烷基硫酸钠,5%异丁醇,0.012 mol/L盐酸),培养12 h,适当振摇,加速结晶溶解;用Bio-Rad酶标仪在570 nm测定吸光度(A值)。计算增殖抑制率=1-(不同药物孔A值-空白孔A值)/(对照孔A值-空白孔A值)。
1.4流式细胞术检测Jurkat细胞凋亡率 按照5×105细胞/孔接种Jurkat细胞于6孔培养板,设阴性对照和不同浓度姜黄素组;细胞置于37℃培养12 h;离心收集细胞;用含1%血清的RPMI1640培养液重悬细胞(密度1×106细胞/ml);取等体积的细胞悬液与Muse 凋亡试剂,颠倒混匀,室温避光放置20 min,在1 h内用流式细胞仪测定结果。
1.5Western印迹检测内质网应激相关蛋白表达 按照2×106细胞/瓶接种Jurkat细胞,设阴性对照和不同浓度姜黄素组;细胞置于37℃培养12 h;离心收集细胞;用冰的PBS缓冲液洗涤细胞1次,离心收集细胞;加入100 μl RIPA蛋白裂解液(含1 mmol/L PMSF),置于4℃静止45 min,冰浴下超声裂解细胞;12 000 r/min低温离心5 min,取上清;Bradford法测定蛋白浓度。在样品中加入2×十二烷基硫酸钠(SDS)上样液,于100℃煮10 min。进行SDS-聚丙烯酰胺凝胶电泳(PAGE),将样品转至聚偏氟乙烯(PVDF)膜。先将PVDF膜置于5%脱脂牛奶中室温封闭2 h;然后置于稀释的一抗、4℃孵育过夜;次日用磷酸盐吐温缓冲液(PBST)溶液漂洗PVDF膜5 min×3次;再置于稀释的辣根过氧化物酶(HRP)标记二抗、室温孵育2 h;用PBST溶液漂洗PVDF膜5 min×3次。吸去多余液体,每10 cm2膜加1 ml ECL工作液,放置1~2 min,将PVDF膜置于保鲜膜中,荧光成像仪检测结果。用β-actin做内参,采用Quantity-one软件分析结果。
1.6统计学方法 采用SPSS17.0软件进行t检验方差分析。
2 结 果
2.1姜黄素对Jurkat细胞生长的影响 将Jurkat细胞置于含0、5.0、7.5、10.0、20.0、30.0、40.0、60.0 μmol/L姜黄素的培养液中,培养12 h或24 h后,MTT比色法分析Jurkat细胞存活率。结果如图1,姜黄素显著抑制Jurkat细胞存活,抑制作用呈剂量与时间依赖性,12 h和24 h的IC50值分别为30.44 μmol/L和29.02 μmol/L。
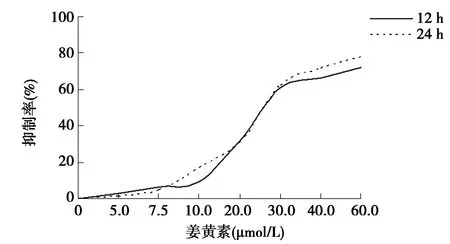
图1 姜黄素作用12 h和24 h对Jurkat细胞增殖的抑制作用
2.2姜黄素对Jurkat细胞凋亡的影响 随姜黄素浓度增加,Jurkat细胞凋亡逐渐增加。姜黄素10.0 μmol/L、20.0 μmol/L组早期凋亡明显高于对照组(P<0.01);姜黄素20.0 μmol/L、30.0 μmol/L、60.0 μmol/L组晚期凋亡明显高于对照组(P<0.001),见表1;姜黄素30.0 μmol/L、60.0 μmol/L组主要为晚期凋亡,晚期凋亡占总凋亡的比率分别为81.63%、87.04%。

表1 各组细胞凋亡比率的比较
2.3姜黄素诱导Jurkat细胞凋亡的机制 随着姜黄素浓度增加,活化Caspase3表达逐步增加,姜黄素30.0 μmol/L组活化Caspase3表达增加至对照组的11.9倍;活化Caspase4表达随着姜黄素浓度增加而增加,姜黄素20.0 μmol/L组活化Caspase4表达增加至对照组的4.9倍,姜黄素30.0 μmol/L组活化Caspase4表达为对照组2.3倍。见图2,表2。随着姜黄素浓度增加,GRP78和CHOP表达增加,姜黄素20.0 μmol/L组GRP78表达量为对照组的2.6倍,CHOP表达量为对照组的4.8倍;姜黄素30.0 μmol/L组GRP78和CHOP表达量降低。见表2,图3。

图2 姜黄素对Jurkat细胞Caspase3、4的影响
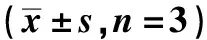
表2 各组Caspase3和Caspase4及GRP78和CHOP表达水平的比较

图3 姜黄素对Jurkat细胞内质网应激蛋白的影响
3 讨 论
内质网由扁囊和小管构成,是维持细胞存活、调节细胞应激反应的重要细胞器,主要负责蛋白质的合成、修饰、折叠、转运及钙离子贮存和脂类合成。凡是影响内质网环境、扰乱内质网功能的因素将触发内质网应激,例如缺氧、营养缺乏、氧化应激、钙失衡及错误折叠或未折叠蛋白堆积等。肿瘤细胞本身存在内质网失衡、非折叠蛋白反应。大剂量化疗增加未折叠蛋白反应,如果肿瘤细胞不能维持内质网稳态,将激活内质网应激反应、诱导细胞凋亡〔5〕。
姜黄素为天然抗肿瘤药,能够抑制乳腺癌、脑胶质瘤干细胞增殖,已经用于乳腺癌、结肠癌、胰腺癌的临床治疗试验〔6~8〕,其主要作用机制为抑制肿瘤增殖、迁移与血管再生等。本实验发现,姜黄素显著抑制Jurkat细胞增殖,抑制作用具有明显剂量依赖性和时间依赖性。姜黄素具有促进Jurkat细胞凋亡的作用。随姜黄素浓度增加,活化Caspase3表达逐步增加,与流式分析结果同步,说明Jurkat细胞凋亡与姜黄素浓度相关。进一步发现,姜黄素作用后Jurkat细胞内质网应激相关凋亡蛋白Caspase4表达增加。姜黄素激活内质网应激上调GRP78、CHOP,通过活化内质网应激途径诱导了Jurkat细胞凋亡。
姜黄素是多靶点抗肿瘤药,在Jurkat细胞凋亡中,尚不清楚内质网应激信号与线粒体凋亡信号之间的关系。有研究表明内质网膜与线粒体外膜之间存在线粒体相关膜结构,存在Ca2+从内质网到线粒体的转运〔9~11〕,内质网应激和线粒体凋亡信号之间或存在相互关联。研究报道〔12~15〕,姜黄素诱导的肿瘤细胞凋亡与激活线粒体凋亡信号有关,姜黄素增加Jurkat细胞Bax表达,降低Bcl-2表达。在姜黄素诱导Jurkat细胞内质网应激时,是否内质网释放Ca2+激活并促进线粒体凋亡信号加速Jurkat细胞凋亡,这尚需实验证据。综上,深入研究内质网应激与线粒体凋亡信号网络在姜黄素诱导Jurkat细胞凋亡中的作用,将为解释姜黄素的抗肿瘤机制以及治疗急性淋巴细胞白血病提供新线索。
