尤瑞克林通过MAPK/ERK信号通路改善小鼠脑缺血再灌注损伤
2022-02-16于荣焕李万里张洁晶张高才曹金娟王焕焕
于荣焕 李万里 张洁晶 张高才 曹金娟 王焕焕
(开封市中心医院,河南 开封 475000)
脑梗死具有高发生率及高死亡率的特点,占脑血管病的50%~80%,严重危及患者的生命和健康〔1〕。脑缺血再灌注损伤是指脑缺血完全坏死之前,已闭塞血管再通后缺血性损伤进一步加重的现象。许多病理生理学机制,如氧化应激、凋亡、兴奋性氨基酸毒性及炎症,参与甚至调控脑损伤的发生发展过程,缺血再灌注损伤后产生的众多的产物激活胞内的信号转导通路,进一步导致细胞的凋亡或坏死〔2~4〕。
尤瑞克林(HUK)的主要成分是人尿激肽原酶,通过促进血管缓激肽和血管舒张素的生成达到扩张血管平滑肌的作用。Chao等〔5〕的研究表明人尿激肽原酶能显著减少脑梗死面积,其机制可能与促进血管内皮细胞再生和减少细胞凋亡等有关,同时可能通过抑制炎症反应及下调核因子(NF)-κB通路进而对小鼠的脑缺血再灌注损伤起到明显的保护作用。作者前期研究表明,人尿激肽原酶能够通过减少凋亡相关蛋白及增加抗凋亡蛋白进而起到改善神经功能的作用〔6〕。
丝裂原活化蛋白激酶(MAPK)信号通路是调节脑梗死后炎症及凋亡的必要的信号通路,主要包括细胞外信号调节激酶(ERK)1/2、p38和Jun氨基末端激酶(JNK),通过将细胞外信号转导至细胞内,进而调节细胞内的分子学水平的变化〔7,8〕。既往研究表明,ERK1/2的持续活化具有神经保护作用〔9,10〕,同时有研究指出,持续的p38活化具有神经损伤作用,甚至导致神经细胞的死亡〔11〕。Satoh等〔12〕研究指出给予ERK1/2的抑制剂具有显著的神经保护作用,证明ERK1/2的活化具有神经损伤作用。结合以上研究,ERK1/2可能在神经细胞的凋亡过程中具有双重作用,因此调节ERK1/2的活性可能是治疗脑梗死的新的研究点。本研究探讨HUK对脑缺血再灌注小鼠72 h后细胞凋亡相关蛋白的影响及可能的神经细胞保护机制,为HUK的临床应用提供可能的实验基础。
1 材料与方法
1.1实验动物与分组 选用清洁级雄性ICR小鼠60只〔购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2018-0005〕,体重23~25 g,随机分为假手术组(16只),I/R+NS组(20只),I/R+HUK组(24只),其中I/R+HUK组小鼠有1只在手术过程中由于出血死亡,1只在缺血第2天死亡,考虑与麻醉过深有关。参照文献〔8〕的给药方法:用灭菌0.9%氯化钠溶液稀释HUK(广东天普生化医药股份有限公司),在缺血30 min前,经尾静脉给予小鼠20×10-3PNAU/kg,并要求在 3 min内注射完成,缺血组给予同等剂量0.9%氯化钠溶液。实验过程严格遵循中华人民共和国科技部办法的《关于善待实验动物的指导性意见》。
1.2小鼠短暂性大脑中动脉阻塞(MCAO) 模型制备参照Zhang等〔13〕的实验方法制备MCAO模型,具体实验方法:术前12 h小鼠禁食不禁水,将小鼠称重后,给予腹腔注射4%水合氯醛,并按照0.1 ml/10 g剂量进行麻醉。仰卧位固定,常规络合碘消毒,颈部正中切开,依次暴露右侧颈总动脉、颈外动脉、颈内动脉,应用缝合线短暂性阻断颈总动脉血流后,在远心端结扎并剪断颈外动脉,在距颈总动脉分叉处0.5 cm 处剪一小切口,顺着颈总动脉插入用硅胶包裹的头端直径为0.25~0.35 mm的6-0缝合线,观察多普勒血流仪,在血流突然下降时停止线栓插入,此时进线长度约10 mm,缺血40 min后拔出线栓,结扎颈外动脉断端,缝合皮肤。在手术过程中,保持小鼠体温始终维持在37.0℃。假手术组仅切开颈部皮肤;I/R+NS组给予等比例的生理盐水;I/R+HUK组给予等比例HUK。
1.3观察指标
1.3.1神经功能缺损评分和脑梗死体积测定 参考经典的Longa等〔14〕的神经功能缺损评分方法,评定手术72 h后小鼠的神经功能缺损情况,具体评分方法如下:0分,无明显神经功能丧失;1分,不能完全伸展左侧前爪;2分:向左侧旋转,环形运动;3分,行走时向左侧倾倒;4分,不能自行行走,意识水平下降。神经功能缺损评分结束后,将小鼠断头取脑,将小鼠脑组织放置冻台上,置于-30℃冰箱快速冷冻后取出依次切片,每层厚度约2 mm,将脑切片置于1% 2,3-氯化二苯四氮唑溶液中(粉末购置于美国Amerco公司),37℃闭光孵育30 min,并翻转脑片保证充分染色,在数码相机下高清拍照,应用 AlphaEaseFC软件评估小鼠脑梗死体积,结果用脑梗死体积/同侧脑半球面积百分比表示。
1.3.2Western印迹检测小鼠缺血侧大脑海马Bcl-2、Bax、ERK1/2蛋白的磷酸化水平 将断头后的小鼠脑组织快速置于冰上,小心清晰分离海马组织,加入同等质量比的裂解液,超声粉碎,冰上放置30 min,4℃ 13 000 r/min离心30 min,取出上清液-30℃冰箱保存备用,采用 BCA 法测定组织蛋白浓度后制定Western印迹样品,置于EP管中。电泳、聚偏氟乙烯(PVDF)膜转膜后以5%脱脂牛奶封闭后一抗4℃冰箱孵育过夜(抗Bcl-2、抗Bax抗体浓度分别为1∶1 000、1∶800,均购自美国Abcam公司;抗ERK1/2抗体及抗p-ERK1/2抗体浓度为1∶1 000,均购自Cell Signaling Technology;抗β-微管蛋白(Tubulin)(1∶5 000;美国Jackson Laboratories公司)。第2天取出蛋白膜PBST洗净后室温孵育二抗1 h,然后PBST洗净后应用洗片机显影。
1.3.3TUNEL染色评估缺血侧海马组织细胞凋亡程度 将小鼠断头取脑后,立即用10%甲醛溶液固定,将脑组织石蜡包埋后进行连续切片。实验过程严格遵循TUNEL试剂盒(上海翊圣生物科技有限公司)方法,应用荧光显微镜,在400倍镜下,每张切片随机选取3个视野进行图像采集及结果分析,颗粒状绿色深染的细胞为TUNEL 阳性细胞。
1.4统计学分析 采用SPSS13.0软件进行单因素方差分析。
2 结 果
2.1HUK对缺血再灌注小鼠神经功能评分及缺血体积的影响 假手术组脑组织无明显梗死,I/R+HUK组神经缺损评分显著低于I/R+NS组〔(1.89±0.29)分 vs(2.86±0.26)分,P<0.01〕。I/R+HUK组脑梗死体积显著小于I/R+NS组〔(0.35±0.05)% vs(0.58±0.02)%,P<0.01〕。见图1。
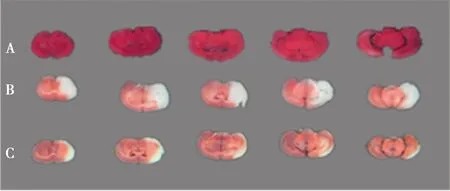
A:假手术组;B:I/R+NS组;C:I/R+HUK组
2.2HUK对缺血再灌注后小鼠神经元细胞凋亡的影响 与假手术组相比,I/R+NS组凋亡细胞显著增多,I/R+HUK组凋亡细胞的数量显著低于I/R+NS组(P<0.01)。见图2,表1。

图2 各组凋亡细胞的比较(TUNEL,×400)
2.3HUK对缺血再灌注小鼠海马凋亡相关蛋白的影响 与假手术组比较,I/R+NS组Bcl-2显著降低,Bax显著升高(P<0.01)。与I/R+NS组比较,I/R+HUK组Bcl-2显著升高,Bax显著降低(P<0.01)。见表1、图3。

图3 各组Bcl-2、Bax蛋白表达
2.4HUK对ERK信号通路的影响 I/R+NS组海马内ERK1/2和p-ERK1/2蛋白表达显著高于假手术组,I/R+HUK组ERK1/2和p-ERK1/2蛋白表达较I/R+NS组显著降低(P<0.01),见表1,图4。

表1 各组凋亡细胞数及Bcl-2、Bax、ERK蛋白表达比较
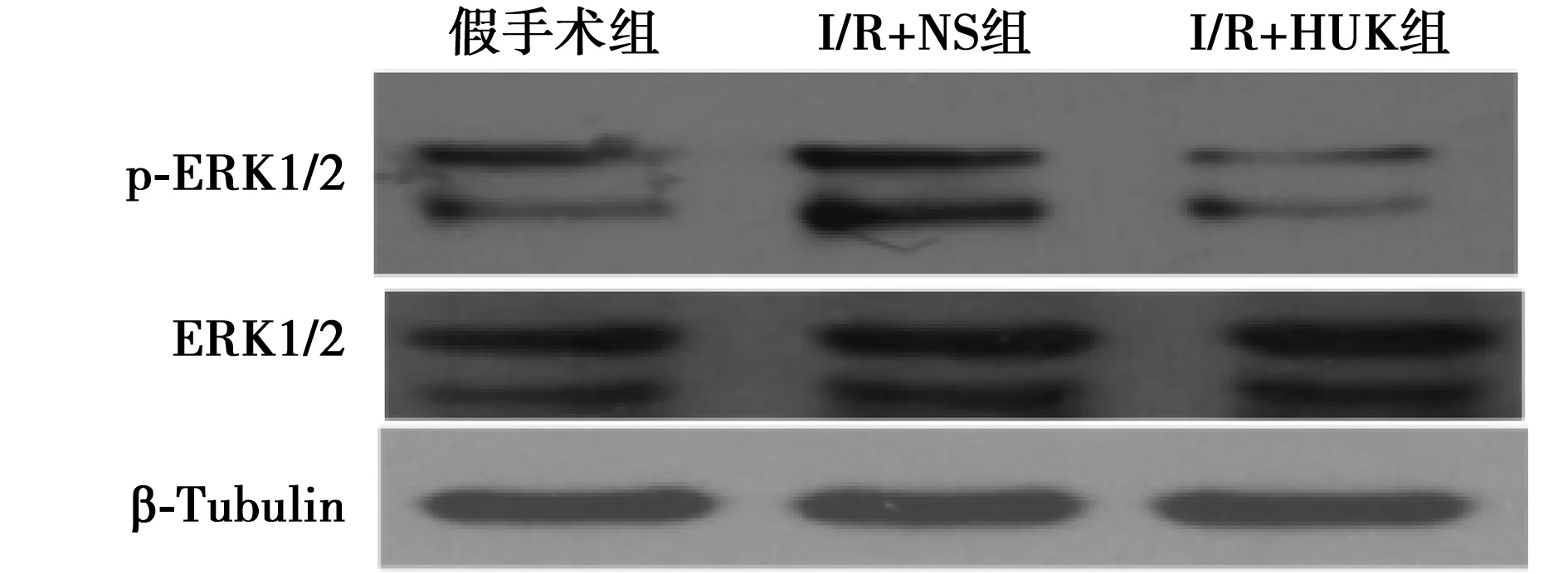
图4 各组ERK蛋白表达
3 讨 论
缺血性脑损伤是由于大脑血管狭窄或堵塞脑内循环血液的剥夺引起的,具有严重的致残性〔3〕。可以通过不同途径起到显著的神经保护作用〔15,16〕,既往研究发现,给予HUK后,小鼠的神经功能缺损症状明显减轻,并且可以促进抗凋亡蛋白的增加,进而起到抗凋亡的作用〔6〕,ERK信号通路是MAPK家族的重要成员,主要参与细胞的凋亡、增殖及分化,主要涉及Raf、ERK、p38MAPK及其他相关的蛋白表达〔17,18〕。ERK蛋白的活化可以上调Bcl-2等抗凋亡蛋白的表达及Bcl-2蛋白的活化,从而达到脑保护的作用;活化的ERK可以维持线粒体的功能,并能通过磷酸化Bcl-2细胞凋亡调节子(Bim),抑制Bim与Bax结合,从而抑制凋亡〔19~21〕。
HUK治疗缺血再灌注损伤的可能机制是通过下调 ERK1/2蛋白的磷酸化水平,进而通过升高Bcl-2蛋白表达,降低Bax蛋白水平而减少细胞的凋亡,从而达到神经保护的作用。本实验仍存在不足之处,并未对脑梗死小鼠应用 ERK抑制剂干预,后续研究中会进一步探讨HUK在MAPK通路中的其他相关蛋白水平的变化,进一步研究HUK对于急性脑梗死的作用机制。
