基于基因芯片技术探讨HHIP对慢性不可预见性应激小鼠海马神经元的干预作用
2022-02-15黄世敬陈宇霞
张 颖,黄世敬,陈 朝,陈宇霞
抑郁症为情感障碍性疾病,主要表现为健忘、失眠、情绪低落及焦躁不安等,中、重度抑郁导致病人生活和社会工作能力明显下降,尤其是重度抑郁的自杀倾向和行为给家庭带来严重的经济和思想负担,给社会造成不良影响,其发病高,发病机制仍不明晰,且治疗周期长、易复发、病人的依从性差,故抗抑郁症的防治目前成为医学界重要的关注点之一[1]。本研究拟采用慢性不可预见性温和刺激(CUMS)方法复制抑郁症模型,采用基因芯片技术对小鼠海马组织进行基因检测,寻找异常差异表达基因,探讨海马神经组织的功能变化及病理损伤,通过聚合酶链式反应(polymerase chain reaction,PCR)和蛋白免疫印迹法(Western Blot)确认基因芯片结果,并通过体外细胞实验验证刺猬相互作用蛋白(HHIP)对海马神经元的干预作用,为进一步揭示抑郁、焦虑症的发病机制及提高临床诊疗水平提供新的思路和依据。
1 材料与方法
1.1 实验动物与分组 C57BL/6N小鼠50只,雄性,体质量18~21 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。无特定病原体(SPF)级、室温25 ℃、湿度46%饲养。自由活动,标准饮食、饮水。小鼠适应性饲养3 d,根据体质量采用分层法随机分为两组,对照组20只,模型组30只。对照组分为两笼,每笼10只。
1.2 试剂与仪器
1.2.1 实验试剂 Agilent Mouse Gene Expression(Agilent,028005),Bcl-2抗体(Santa cruz,Sc-492),Bax抗体(Abcam,ab135240),HHIP抗体(Abcam,ab39208),Beta actin(中杉,TA-09),胎牛血清(Gibco,26050070),胰蛋白酶(Gibco,LP0042),质粒DNA大鼠抽提试剂盒(Tiangen,DP117),DMEM(Gibco,11965118),腺相关病毒纯化试剂盒(Biomiga,V1469-01),LipofiterTM转染试剂(Hanbio Biotechnology,HB-TRCF-1000),enonase(Signa,E1014),Trizol RNA抽提试剂(Invitrogen,15596026),引物(GAPDH-F:TCATTGACCTCAACTACATGG,GAPDH-R:CGCTCCTGGAAGATGGTG,HHIP-F:TCAAGGAGCCTTACTTGGACA,HHIP-R:CAGGCTTAGCAGGCCCCT),PC12细胞(ATCC),聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),0.45 μmol/L,26.5 cm×3.75 m(Millipore,IPVH00010),Horseserum(GIBCO,16050114),辣根过氧化物酶标记山羊抗兔(Thermo,31460),辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(beyotime,A0216),GAPDH Antibody(FL-335),GoScriptTMReverse Transcription System (PROMEGA,A5001),GoTa®qPCR Master Mix(PROMEGA,A6001),无RNase水(Thermo Fisher,AM9856)。
1.2.2 实验仪器 Agilent Scanner扫描仪(Agilent,G2505C),聚合酶链式反应(PCR)仪(ABI,9700),实时定量PCR仪(BIO-RAD,CFX96),0.2 mL PCR管(Axygen,PCR-02-C)。化学发光成像系统(BIO-RAD,ChemiDoc XBS+),超纯水制备系统(Millipore,Milli-Q),紫外分光光度计(ThermoFisher,NanodropND-2000),Agilent Bioanalyzer 2100(Agilent,2100),电热恒温水浴锅(上海一恒科技有限公司,DK-8D),二氧化碳培养箱(Thermo,3111),倒置荧光显微镜及图像分析系统(上海彼爱姆光学仪器有限公司,BM-38X),倒置显微镜(上海普丹光学仪器有限公司,PM-500),倒置生物显微镜(重庆光电仪器总公司,XDS-1B),冷冻离心机(Eppendorf,5417R),超速离心机(日立,CP70NE)。
1.3 抑郁模型的建立 建立慢性不可预见性温和应激模型,抑郁模型组孤养造模:①冰水游泳3 min;②足底电击2 min,自制电击,1 mA,30 mV,每次电击10 s,间隔时间随机;③夹尾2 min;④倾斜24 h;⑤潮湿垫料24 h;⑥黑白颠倒24 h;⑦禁食禁水24 h;⑧异物干扰24 h。8种刺激随机应激持续35 d,进行行为检测,处死动物,剥离海马组织,进行微列阵基因芯片、差异基因HHIP PCR和蛋白检测及验证。
1.4 观察指标
1.4.1 行为学检测
1.4.1.1 糖水实验 蔗糖加纯净水配成1%的蔗糖水,第1天每笼1瓶糖水24 h;第2天糖水、纯净水各1瓶饮水24 h,糖水位置不变;第3天小鼠禁水24 h;第4天200 g的1%蔗糖水和纯净水各1瓶按原来位置摆放24 h,后称糖水和纯净水的饮水量,计算糖水百分比=糖水/(糖水+纯净水)。
1.4.1.2 走格实验 自制50 cm×50 cm×40 cm走格木箱,箱底有25个10 cm×10 cm方格,箱内面为白色,用黑色划成方格。安静环境,将小鼠放入中间格,观察小鼠穿越格子数和抬头次数,穿越格子以小鼠3只脚同时进入一个格子计算,抬头以两条前腿同时抬起计算。
1.4.1.3 悬尾实验 自制6个独立空间立式木箱,空格内顶部有钉粘贴小鼠尾巴,小鼠悬尾倒置,适应2 min后使用泰盟悬尾软件(TST-100 Tail Suspension Test Video Analysis System)监测小鼠静止和抬头活动时间4 min。
1.4.2 微阵列芯片方法检测海马组织差异表达基因 取海马组织抽提总RNA,利用NanoDrop定量并经Agilent Bioanalyzer 2100检测RNA完整性。采用Agilent Mouse Gene Expression(8×60 K)芯片杂交,去磷酸化、变性、标记、纯化、杂交和洗脱后,Agilent Scanner对杂交结束后的芯片进行扫描。提取芯片扫描原始信号值,进行数据标准化和探针过滤。进行PCA、聚类、靶基因本体(GO)、通路分析。
1.4.3 HHIP基因检测 各组选取12只小鼠海马组织样本,进一步进行HHIP基因及蛋白的验证,HHIP引物设计使用ncbi-primer方法进行。
1.4.3.1 提取样本总RNA ①取50 mg海马组织,加入1 mLTrizol RNA抽提试剂,研磨震荡;②每1 mL Trizol 对应加入200 μL氯仿,振荡,12 000×g离心10 min,取上层水相移至新离心管;③加入等体积异丙醇,混匀静置10 min;④ 12 000×g离心10 min,去除上层水相,保留RNA沉淀;⑤用70%乙醇清洗RNA 2次;⑥去除上清,RNA沉淀室温开盖晾干;⑦根据RNA沉淀量,对应加50~100 μL RNase-free水溶解RNA。
1.4.3.2 浓度测定 取2 μL RNA,用Nanodrop仪进行RNA浓度测定。
1.4.3.3 反转录 取0.5 μg RNA作为模板,与反转录引物和无RNase水混匀,70 ℃作用5 min。立即放入冰水混合物中冷却5 min,离心机离心10 s,按照逆转录试剂盒说明,在冰上进行逆转录混合物配制。
1.4.3.4 实时定量PCR检测 取反转录的cDNA做模板,按照定量试剂说明书,利用CFX-96荧光定量PCR仪进行实时定量检测。实验结果采用2-△△ct方法进行数据的相对定量分析。
1.4.4 Western Blot检测
1.4.4.1 蛋白抽提 加入含蛋白酶抑制剂的预冷RIPA细胞裂解液,冰上孵育30 min,13 000×g ,4 ℃离心取上清。
1.4.4.2 二喹林甲酸(BCA)法 按照BCA蛋白定量试剂盒使用说明测定蛋白浓度。
1.4.4.3 Western Blot实验 ①根据蛋白分子量配制10%分离胶,浓缩胶浓度为5%,蛋白样品上样;②电泳:浓缩胶恒压90 V约20 min,分离胶恒压120 V,预染蛋白Marker确定电泳时间;③转膜:300 mA恒流,0.45 μm孔径PVDF膜转膜;④丽春红染色试剂对膜进行染色;⑤封闭:将膜浸没于5%BSA-TBST(100 mL TBST中含5 g BSA)的缓冲液中,水平摇床孵育1 h;⑥一抗孵育:5%BSA-TBST稀释一抗,水平摇床孵育过夜,次日TBST洗3次;⑦二抗孵育:5%BSA-TBST稀释二抗,山羊抗兔IgG(H+L)HRP和山羊抗鼠IgG(H+L)和兔抗山羊IgG(H+L)HRP 1∶1 000,室温孵育1 h;⑧洗膜:TBST洗膜3次;⑨增强型化学发光试剂(enhanced chemiluminescence,ECL)滴加至膜的蛋白面反应3 min,拍照。
1.4.5 HHIP包装慢病毒 病毒包装系统:三质粒系统,pAAV-RC,pHelper,pHBAAV-CMV-MCS-ZsGreen。包装细胞株:AAV-293细胞。菌株:大肠杆菌菌株Stbl3,用于扩增腺相关载体和辅助包装载体质粒。构建好的慢病毒载体和辅助质粒进行大量抽提;包装细胞株AAV-293细胞培养并传代;确认细胞密度达到80%~90%的汇合率即可进行病毒转染、纯化,-80 ℃保存。
1.4.6 HHIP慢病毒感染PC12细胞 PC12细胞正常培养并传代,分为3组:空白组、NTC组(NTC为病毒载体中插入一段无义序列,是阴性对照)、基因沉默组(HHIP病毒沉默组)。基因沉默组每孔加入相应10 μL病毒,混匀,置二氧化碳孵箱培养48 h收样检测感染成功率。
1.4.7 Bcl-2/Bax蛋白检测 6孔板细胞转染48 h,采用Q-PCR、Western Blot法检测Bcl-2/Bax蛋白(PCR检测方法同1.4.3.4,蛋白抽提及检测方法同1.4.4)。
1.4.8 Annexin V-FITC流式检测细胞凋亡数 6孔板细胞转染48 h,吸出细胞培养液,PBS洗涤贴壁细胞1次,加入胰酶消化细胞至细胞变圆脱落,加入收集的细胞培养液终止消化,1 000×g离心5 min,弃上清,收集细胞。加入PBS轻轻重悬细胞,1 000×g 离心5 min,弃上清,加入250 μL稀释的Binding Buffer重悬细胞。取细胞悬液加入5 μL Annexin V-FITC与5 μL PI,轻轻混匀,室温避光孵育20 min。孵育完成后于流式细胞仪上机检测Annexin V-FITC与 PI染色比例。

2 结 果
2.1 抑郁模型小鼠行为学检测结果 与对照组比较,模型组糖水实验糖水量减少;悬尾实验悬尾后小鼠不动时间减少,活动时间增多;走格实验穿越格数及直立次数均增加,差异均有统计学意义(P<0.05),提示CUMS方法可导致小鼠产生抑郁并伴有焦虑状态。详见表1。

表1 抑郁小鼠行为学实验结果 (±s)
2.2 微阵列芯片基因检测结果 对照组和模型组各取3只小鼠海马组织,H3、H5、H16为对照组;H32、H34、H38为模型组,进行基因芯片检测。抽提总RNA,反转录后进行芯片杂交,扫描信号值,进行标准化,PCA分析提示对照组和模型组样本分布在二维空间的不同区域,同组样品分布较集中,基因具有同类聚集性及相关性。两组间P<0.05且差异倍数两倍以上,将P值的负对数-log10(P-value)为纵坐标,log2(fold change)为横坐标做出火山图,显示出差异表达基因mRNA 447个,其中下调281个,上调166个,说明二组所选样本具有代表性。详见图1、图2。
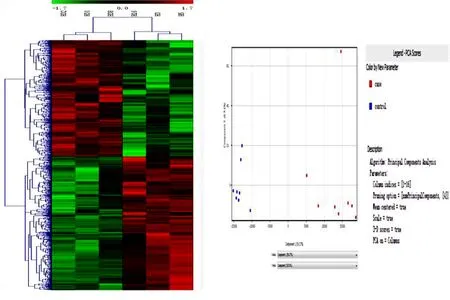
图1 差异mRNA聚类热图及表达谱芯片样本PCA分布
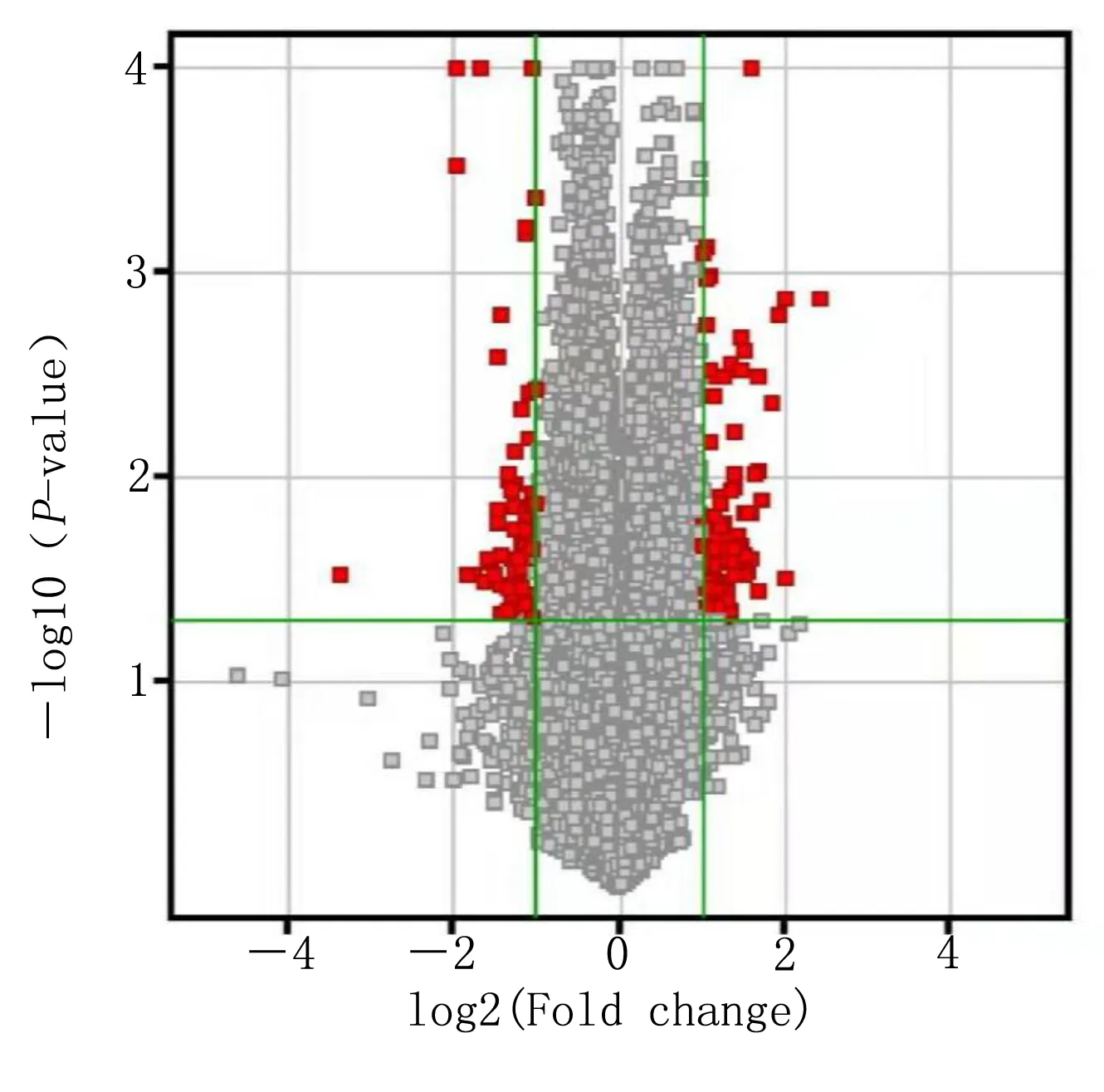
图2 火山图
对筛选到的所有差异mRNA进行GO、通路富集分析。GO分析结果可见模型小鼠海马组织神经元系统发育和动作电位的调节,神经元、少突胶质细胞的发育与分化,神经递质传递,神经元再生,细胞通讯等方面功能异常。通路分析结果显示,下调基因与神经活性的配体-受体相互作用、轴突导向、丝裂原活化蛋白激酶(MAPK)及Wnt通路、细胞通讯等功能相关,与下调基因的GO分析具有很高的关联性。详见图3、图4。
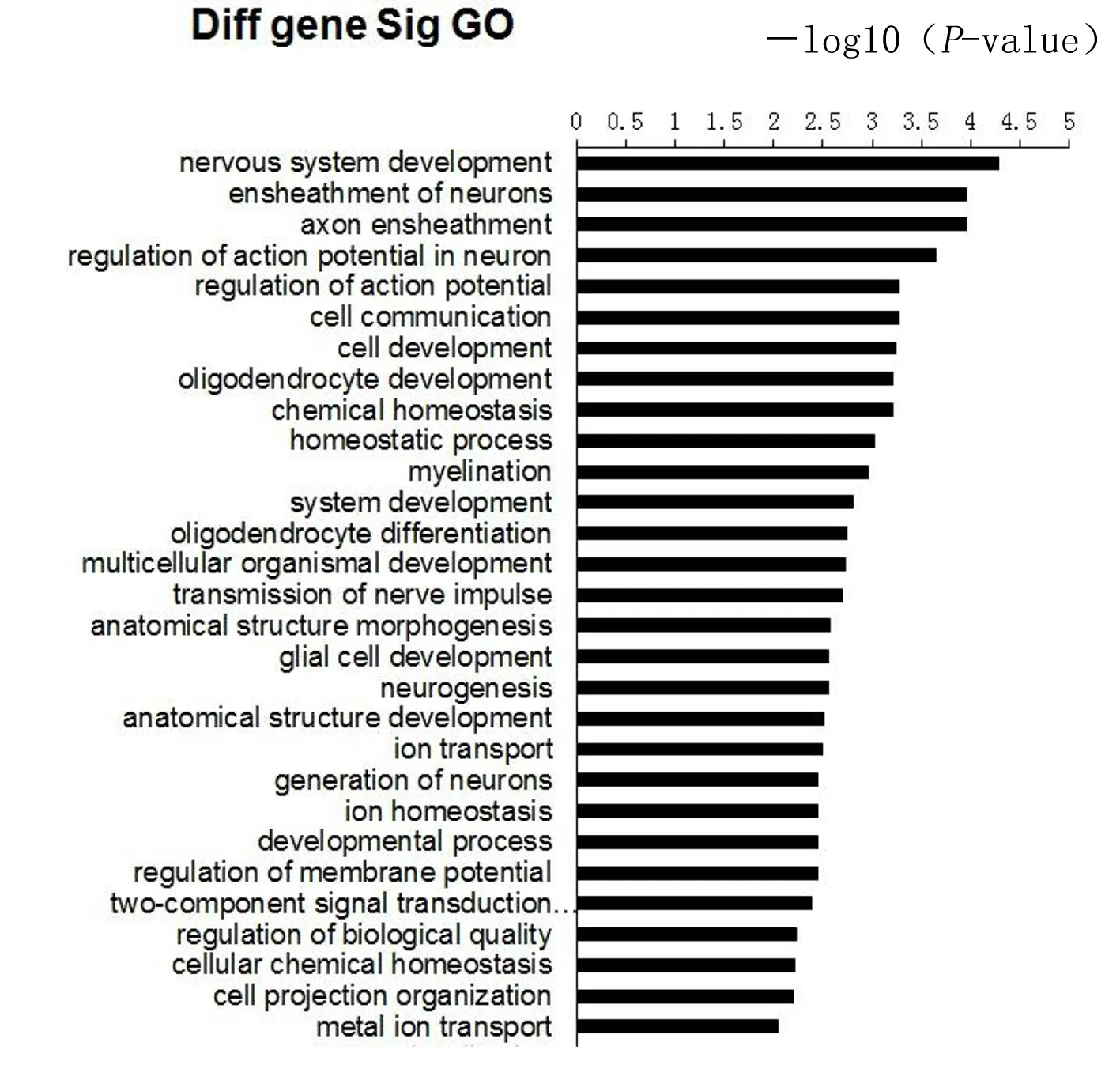
图3 GO分析结果

图4 通路分析结果
围绕抑郁、焦虑查找相关国内外文献并构建差异基因网络图,可见Hedge hoy(HH)信号通路中3个基因Shh、HHIP及Claudin11均在下调基因中,此3种基因均为HH信号通路成分,提示HH信号通路可能参与了本实验小鼠抑郁焦虑海马组织神经元、神经胶质细胞发育分化和再生的发生,并参与了海马组织神经血管单元间的耦联作用。详见图5。
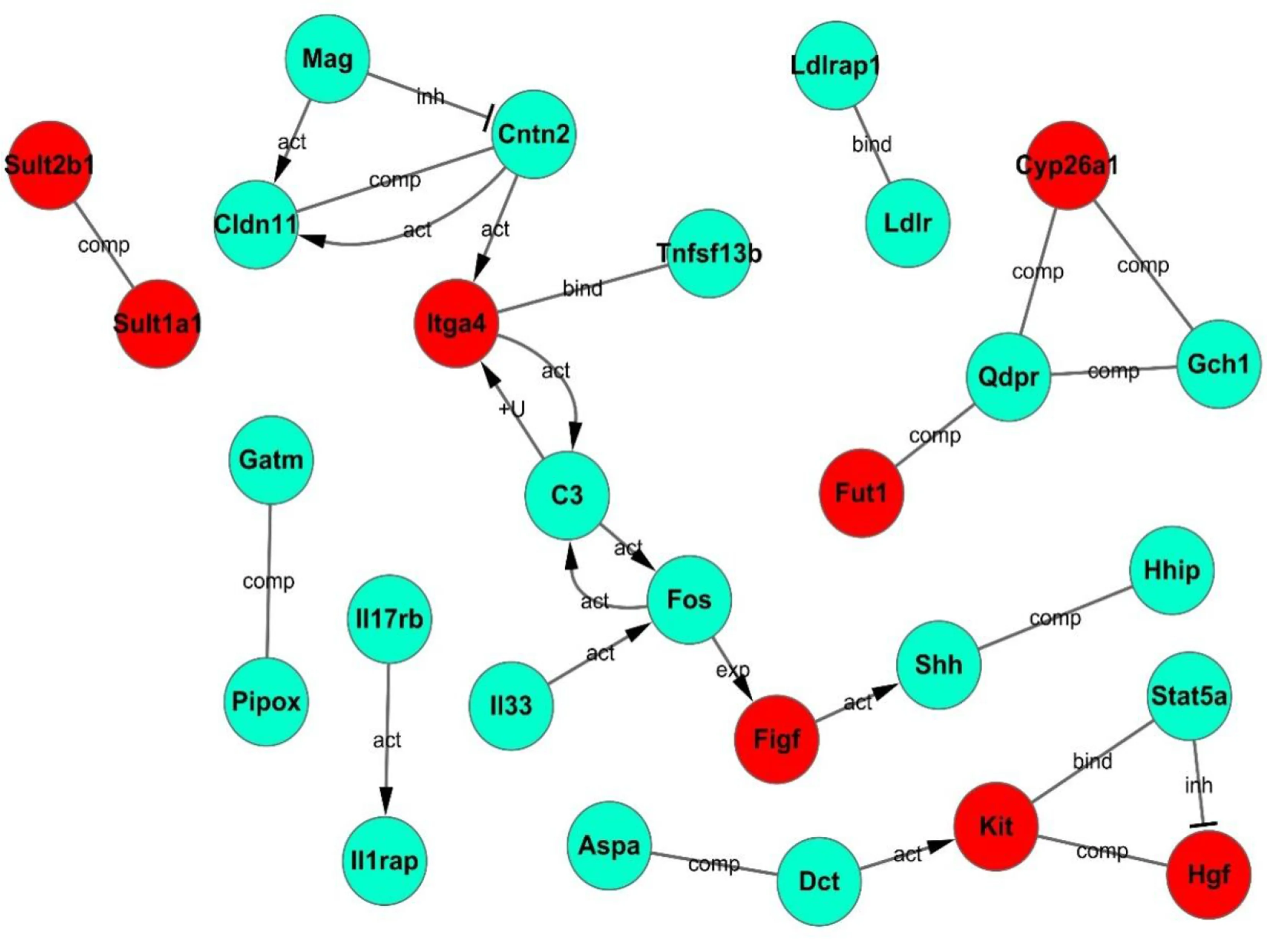
图5 差异基因相互作用网络图
2.3 HHIP基因及蛋白检测结果 与对照组比较,模型组HHIP 基因及蛋白表达均降低,差异有统计学意义(P<0.05或P<0.01),此结果与基因芯片结果一致。详见表2。

表2 抑郁模型小鼠HHIP 基因及蛋白表达变化 (±s)
2.4 HHIP慢病毒感染验证 为了进行HHIP沉默及补救实验,分别包装了HHIP沉默慢病毒与过表达HHIP慢病毒(对应对照分别为沉默对照病毒与对照过表达控制病毒)。结果显示,沉默病毒可明显降低细胞内源性HHIP基因表达水平(shRNA1组),而补救实验可扭转这种沉默(shRNA1+HHIP组)。详见图6。
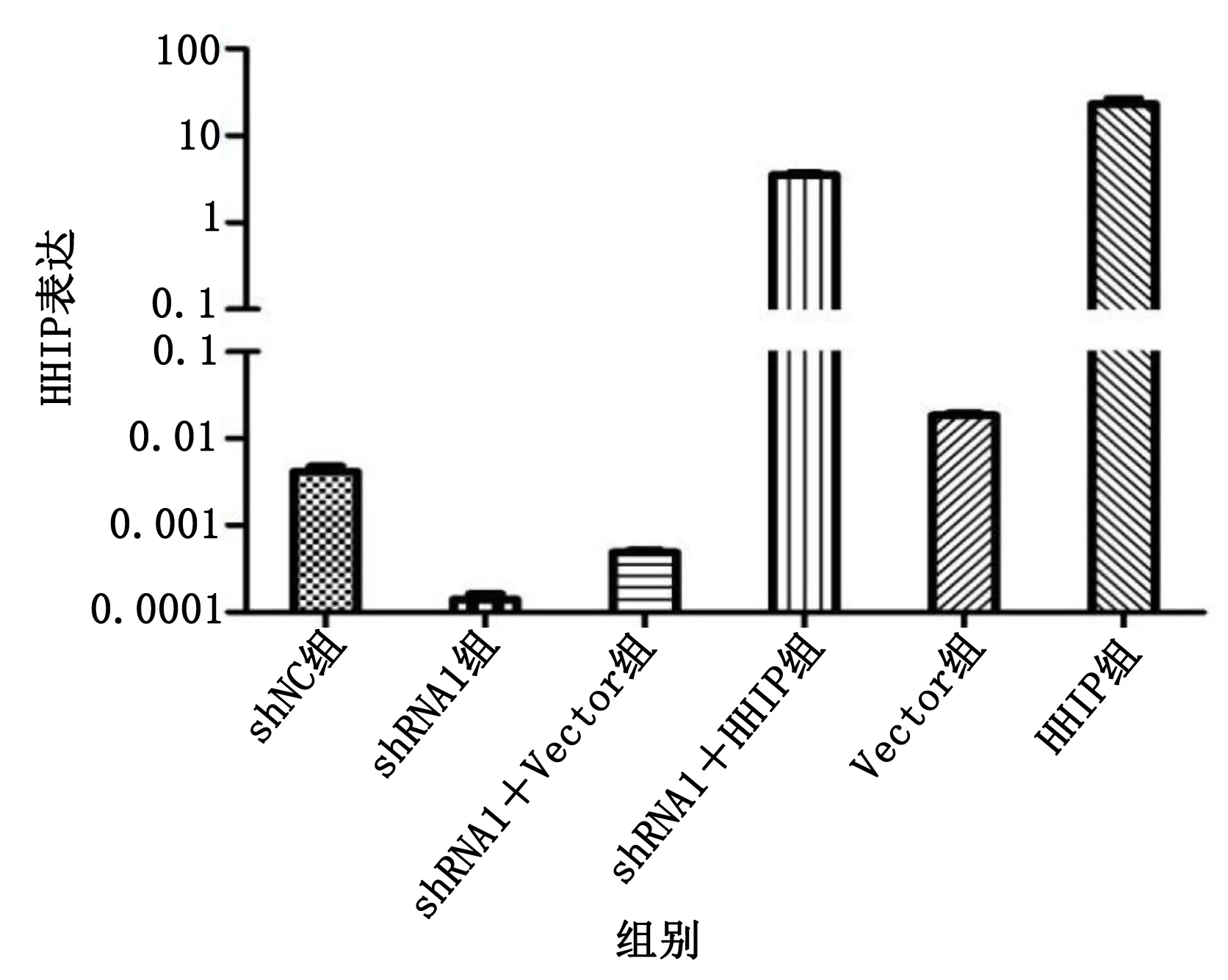
图6 HHIP慢病毒感染验证
2.5 HHIP慢病毒感染PC12细胞后细胞凋亡变化
2.5.1 PC12细胞Bcl-2/Bax蛋白表达变化 对照组(沉默对照和过表达对照)比较,HHIP沉默后PC12细胞抑凋亡因子Bcl-2蛋白表达降低,促调亡因子Bax表达增加,差异均有统计学意义(P<0.05),而补救组(shHHIP+HHIP组)可逆转因HHIP沉默所导致的抑凋亡因子Bcl-2蛋白表达降低,促凋亡因子Bax表达增加。详见图7、图8。

图7 HHIP慢病毒感染后PC12细胞Bcl-2/Bax蛋白表达条带图
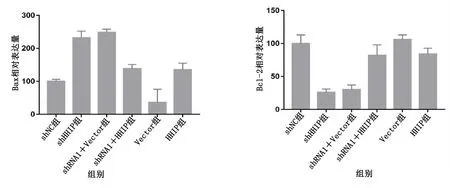
图8 HHIP慢病毒感染后PC12细胞Bcl-2/Bax蛋白表达比较
2.5.2 PC12细胞凋亡变化 HHIP沉默PC12细胞后,PC12细胞凋亡百分数增加。详见图9、图10。
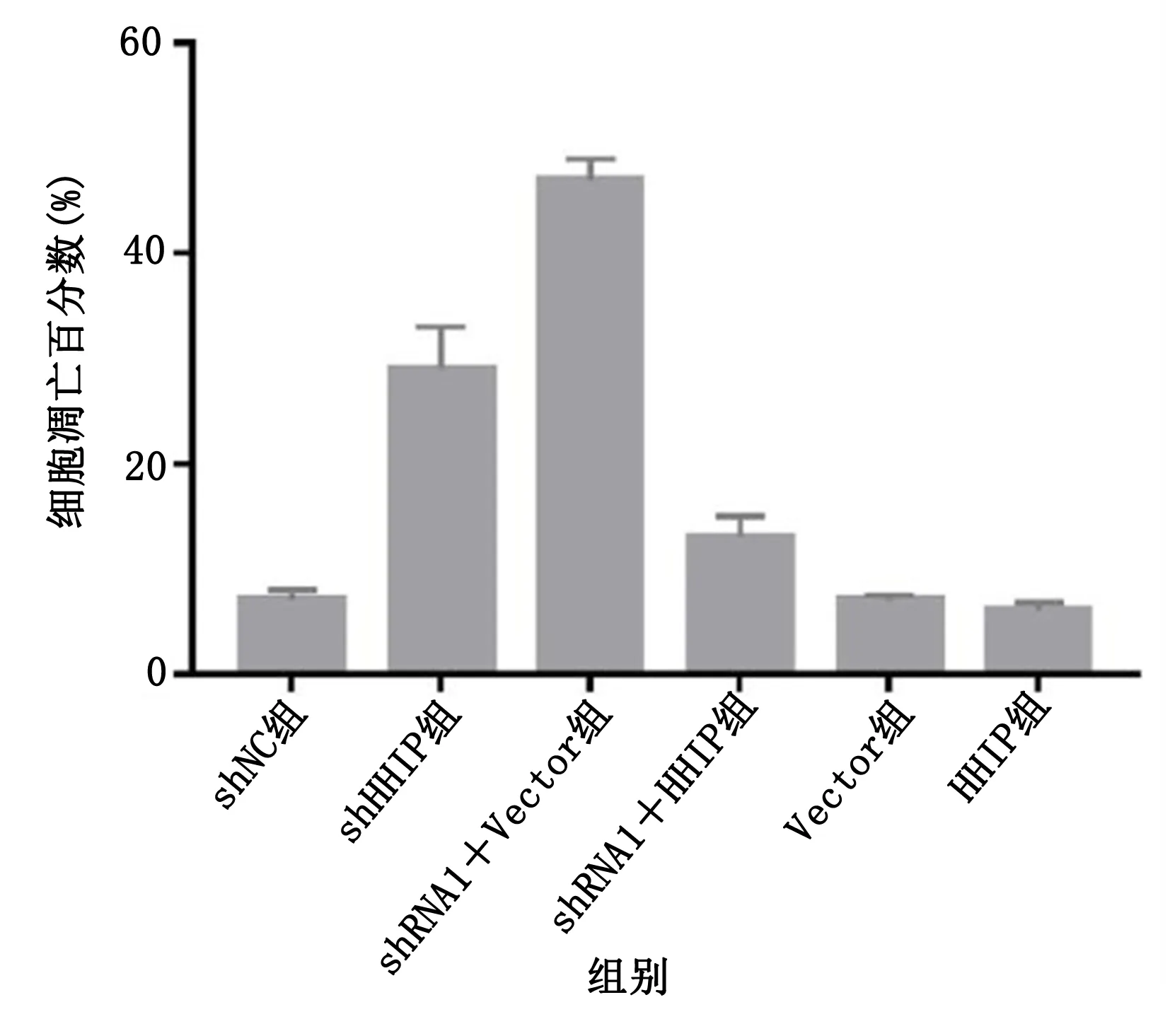
图9 各组PC12细胞凋亡百分数比较
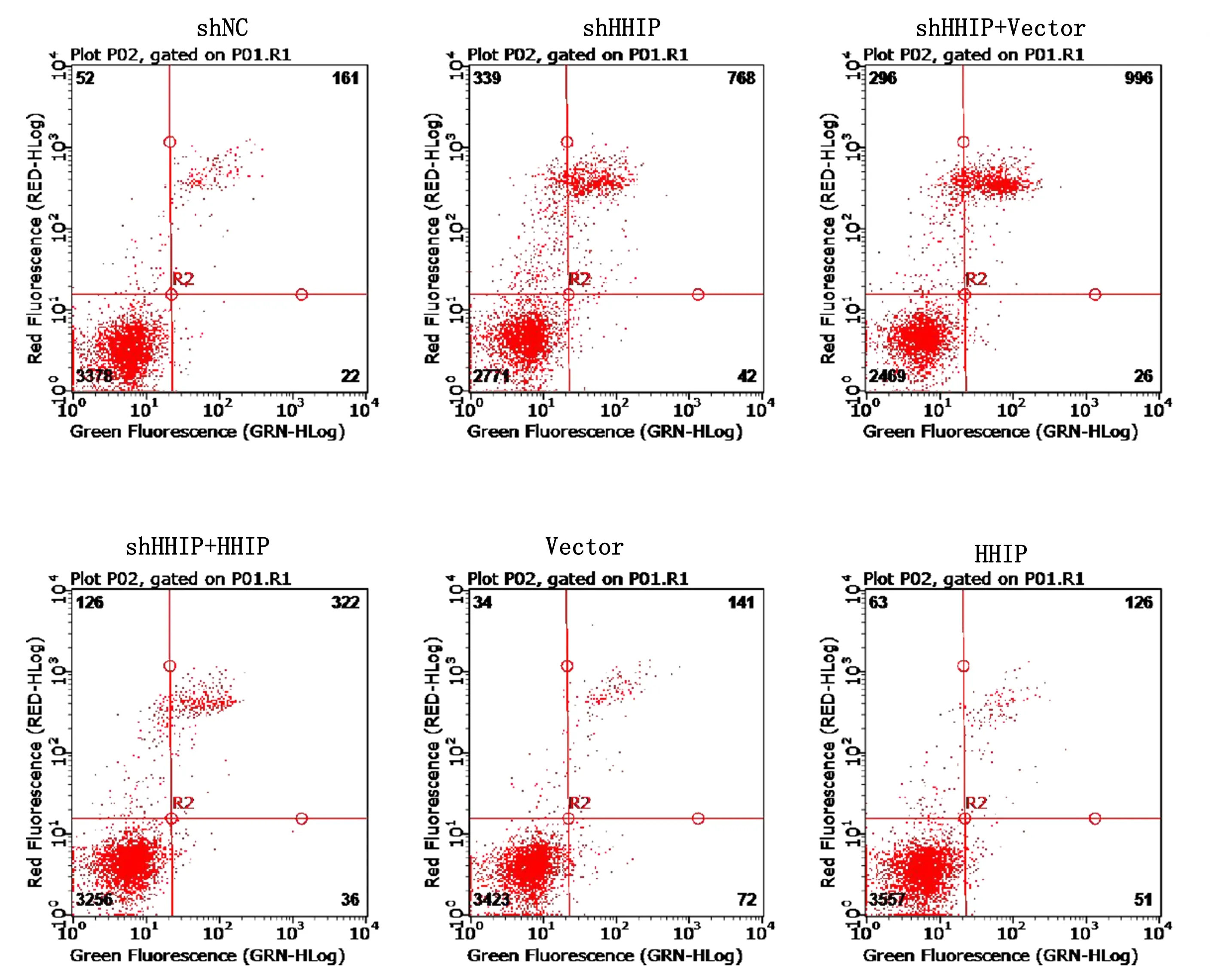
图10 各组PC12细胞凋亡流式图
3 讨 论
HH信号通路由Hammerschmidt等首先在果蝇中发现,随后又在脊椎动物中被证实[2]。HH信号通路对胚胎发育、细胞分化增殖、细胞极化等过程有重要的调控作用,在胚胎发育期间,大脑皮层所有的旺盛神经元的神经发生几乎都与HH信号通路相关,尤其调节中枢神经系统的极性方面[3]。
海马体是大脑中与学习和记忆相关的主要区域,多种感觉联合通过皮层传递信息汇聚到海马回路中的神经元,刺激突触传导冲动[4]。HH信号通路表达异常可诱导海马神经损伤的发生与发展,海马神经元树突中音猬因子(sonic hedgehog,SHH)配体的激活参与了跨神经元的信号通路,特别是CA1和CA3区锥体神经元,使抑郁症模型动物出现功能障碍及病理损伤[5],这与本课题组前期的研究结果[6]一致。文献研究发现,HH信号通路低表达的大鼠脑缺血模型中,脑组织疏松,神经元减少,抑郁、焦虑等情感行为异常[7]。另有研究显示,其信号通路低表达介导了抑郁焦虑症神经递质5-羟色胺(5-HT)、去甲肾上腺素(norepinephrine,NE)减少[8],可见HH信号通路与抑郁、焦虑密切相关。本研究基因芯片结果显示,HH信号通路中主要成员HHIP、Shh及Claudin11表达均降低,模型动物海马组织神经递质传递功能减弱及神经元和胶质细胞间信息连接障碍,可见HH信号通路参与了本实验抑郁焦虑症的发生。
基因芯片结果还提示,海马组织神经元、少突胶质细胞发育与分化、神经元再生等生物功能区域障碍,通路分析结果显示与神经活性相关的配体-受体、细胞外基质(ECM)、细胞通讯、轴突导向、MAPK通路及WNT通路等功能活动异常,可见,此模型动物海马组织神经血管单元包括神经元、胶质细胞及细胞外基质的耦联功能受损,神经元与神经胶质细胞间信息传递功能障碍,神经血管单元失稳态可能是导致小鼠抑郁焦虑发生的原因,HH等信号通路参与其发生机制,介导了海马组织神经血管单元联通性失常。
相互的蛋白HHIP是HH信号通路的组成部分,也是通路的靶基因,对HH通路发挥负反馈调控[9]。HH信号通路激活HHIP,HHIP与负向调控元件的12次跨膜蛋白(patched)竞争性结合HH通路配体,HH配体与跨膜蛋白受体结合减少,跨膜蛋白抑制正向调控元件的7次跨膜蛋白Smothened(SMO)被解除释放SMO、融合同源物(果蝇)抑制因子(suppressor of fused homolog,SUFU),与GLI家族锌指蛋白3发生分离,GLI3表达增加,促使锌指蛋白1(gliomaassociated oncogene homolog 1)、GLI3共同进入细胞核,启动调节靶基因转录,调控细胞周期、细胞凋亡[10]。
综上所述,本研究结果发现,实验动物海马组织HHIP基因和蛋白下调,包装HHIP慢病毒,进一步进行体外细胞实验发现,沉默HHIP基因后PC12细胞中抗凋亡因子Bcl-2表达下调,促凋亡因子Bax表达增强,细胞凋亡百分数增加。可见HHIP低表达诱导了模型动物脑组织海马组织神经元及胶质细胞凋亡,其所在HH信号通路也可能参与了抑郁症的发生及脑组织的病理改变,其高表达是否对抑郁症脑组织海马组织具有保护和修复作用还需进一步实验证实。
