基于细胞焦亡NF-κB信号通路探讨黄连解毒汤干预动脉粥样硬化斑块的作用机制
2022-02-15刘永瑞叶伯鑫
刘永瑞,唐 娜,王 林,叶伯鑫,刘 南
动脉粥样硬化(atherosclerosis,AS)是导致心血管疾病发生的主要因素,动脉粥样硬化斑块主要分布于由内皮细胞、血管平滑肌细胞和其他血管细胞组成的大、中型血管[1]。炎症在动脉粥样硬化形成中发挥关键作用,而促炎因子水平被认为是重要的预后因素,与动脉粥样硬化进程明显相关[2-3]。研究表明,细胞焦亡(Caspase-1依赖型细胞死亡)参与了多种疾病的病理生理过程,其本质为慢性炎症[4]。炎性小体为炎症通路的重要组成部分,其可通过核转录因子-κB(NF-κB)信号通路激活Caspase-1导致细胞焦亡[5],并刺激促炎细胞因子(如白细胞介素、肿瘤坏死因子-α等)的成熟和分泌,有望成为动脉粥样硬化的有效治疗靶点。黄连解毒汤为清热解毒的代表方,以黄连为君,清热泻火解毒,清心火及中焦之火;以黄芩为臣,清上焦之火及肺热;以黄柏为佐,清下焦火热;栀子为使,清泻上中下三焦之火,四药配伍,共奏清热泻火解毒之功。研究表明,黄连解毒汤具有抗菌抗炎、抗氧化应激、抗动脉粥样硬化[6-8]等多方面作用,但治疗机制仍未完全明确。
本研究采用苏木精-伊红(HE)染色法观察新西兰兔主动脉斑块情况,酶联免疫吸附法(ELISA)检测新西兰兔血清炎性因子水平,免疫组化(IHC)法、实时荧光定量聚合酶链式反应(RT-qPCR)法、蛋白免疫印迹(Western Blot)法评估细胞焦亡水平,从细胞焦亡角度评估黄连解毒汤对动脉粥样硬化稳定性的影响。
1 材料与方法
1.1 实验动物与药物
1.1.1 实验动物 雄性新西兰兔60只,体质量2.0~3.0 kg,购自广东省医学实验动物中心,实验动物合格证号:SCXK(粤)2019-0035。饲养于广州中医药大学第一附属医院实验中心,许可证号为:SCXK(粤)2018-0092。
1.1.2 试验药物 黄连解毒汤由黄连9 g、黄芩6 g、黄柏6 g、栀子9 g组成,购于广州中医药大学第一附属医院药房,代煎后分装,于冰箱中冷藏。
1.1.3 实验试剂 细胞焦亡抑制剂VX-765(购于MedChemExpress公司,No.HY-13205),脂多糖(LPS)(购于Sigma公司,No.L2880),维生素D3注射液(购于上海通用药业股份有限公司,国药准字H31021259),C反应蛋白(CRP),酶联免疫吸附试验(ELISA)试剂盒(购于Abcam公司,ab157726),白细胞介素-1β(IL-1β)ELISA试剂盒(购于Abcam公司,Ab273237),肿瘤坏死因子-α(TNF-α)ELISA试剂盒(购于武汉菲恩生物科技有限公司,ERB0126),转化生长因子-β(TGF-β)ELISA试剂盒(购于武汉菲恩生物科技有限公司,ERB0119),白细胞介素-18(IL-18)ELISA试剂盒(购于武汉菲恩生物科技有限公司,ERB0059),RNA提取试剂盒(购于Takara公司,9676),预混SYBR®Green 聚合酶链式反应(PCR)试剂盒(购于Takara公司,RR820A),IL-1β抗体(购于北京博奥森生物技术有限公司,bs-0812R),IL-18抗体(购于北京博奥森生物技术有限公司,bs-20159R),Caspase-1抗体(购于武汉三鹰生物技术有限公司,22915-1-AP),NOD样受体热蛋白结构域相关蛋白3(NLRP3)抗体(购于武汉三鹰生物技术有限公司,19771-1-AP),辣根过氧化物酶(HRP)山羊抗兔免疫球蛋白G(IgG)(购于Abcam公司,ab6721),二喹啉甲醇(BCA)试剂盒(购于上海碧云天生物技术有限公司,P0010),p50抗体(购于北京博奥森生物技术有限公司,bs-1194R),p65抗体(购于北京博奥森生物技术有限公司,bs-0465R),核因子kB抑制蛋白α(IkBα)抗体(购于北京博奥森生物技术有限公司,bs-1287R),β-actin抗体(购于Abcam公司,ab8224)。
1.2 动脉粥样硬化模型的建立与药物干预 将雄性新西兰兔随机分为6组,即空白组、模型组、黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组,每组10只。采用高脂饲料[购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2019-05073]喂养联合肌肉注射LPS(第4周、第8周、第12周,于新西兰兔右侧耳动脉、颈动脉和股浅动脉旁注射LPS,每个部位肌内注射1 μg)及腹腔注射维生素D3(喂养前一次性给药2×105U/kg)的复合方法进行造模。除空白组外,其余5组均给予复合方法进行造模。从第8周开始黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组分别给予黄连解毒汤每天0.75 g/kg、1.50 g/kg和3.00 g/kg灌胃,VX-765组给予氯喹[VX-765溶于二甲基亚砜(DMSO)溶液中]50 mg/kg腹腔注射,空白组与模型组每天给予等容生理盐水灌胃,以上操作连续干预至16周末后,用3%戊巴比妥钠30 mg/kg腹腔注射麻醉,采用腹主动脉取血休克法处死新西兰兔,分离主动脉组织。
1.3 ELISA法检测血清炎性因子水平 ELISA法检测血清炎性因子CRP、IL-1β、TNF-α、TGF-β、IL-18水平,将所有试剂平衡至室温18~25 ℃,设定标准孔、待测样品孔、空白孔,并按说明书要求分别加入相应试剂,加上覆膜,37 ℃孵育1 h,按说明书要求加相应试剂并用酶标仪检测。
1.4 苏木精-伊红(HE)染色观察主动脉组织斑块情况 将从新西兰兔分离的主动脉组织置于石蜡包埋盒中,并于流水中冲洗3 h充分洗去组织表面甲醛。冲洗后将组织放入脱水机行梯度乙醇脱水与浸蜡。包埋后进行组织切片脱蜡至水,苏木素与伊红染色,随后行脱水透明,封片晾干。在显微镜下对主动脉病变情况进行组织学评估。
1.5 细胞焦亡水平测评
1.5.1 RT-qPCR法检测Caspase-1、NLRP3基因表达 采用RNA提取试剂盒(Takara,Ostu,Japan)按照说明书步骤操作从新西兰兔主动脉组织中提取总RNA,并逆转录成cDNA。使用预混SYBR®Green PCR试剂盒进行实时PCR反应。特异性引物(见表1)由生工生物工程(上海)股份有限公司合成。扩增条件为95 ℃作用30 s,95 ℃作用5 s(40个循环),60 ℃作用30 s,用相对定量的2-△△Ct法计算目的基因相对表达量。

表1 引物序列(5′→3′)
1.5.2 IHC法检测IL-1β、IL-18、Caspase-1、NLRP3表达水平 石蜡切片脱蜡至水,步骤同HE染色。将切片放入抗原修复盒中,置微波炉中92~99 ℃加热1 min后冷却至室温,3%过氧化氢处理祛除内源性过氧化物酶,5%山羊血清封闭30 min后滴加相应一抗IL-1β(1∶500)、IL-18(1∶500)、Caspase-1(1∶200),NLRP3(1∶200),4 ℃过夜。复温至室温,滴加HRP山羊抗兔IgG(1∶1 000)孵育30 min。滴加3,3-N-二氨基联苯胺四盐酸(DAB)显色液,显色完成后放入水中终止,苏木素染核,脱水透明,封片、晾干,显微镜下观察拍照,采用Image-Pro Plus软件分析。
1.5.3 Western Blot法检测Caspase-1、NLRP3蛋白表达及 NF-κB信号通路关键蛋白表达 从新西兰兔主动脉组织中提取的蛋白质样品,使用BCA蛋白质定量试剂盒对蛋白质浓度进行定量后,经10%十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE)分离并转移到聚偏二氟乙烯膜(PVDF)上。在室温下用5%脱脂奶粉封闭2 h后,用稀释的Caspase-1(1∶1 000)、NLRP3(1∶1 000)、p50(1∶1 000)、p65(1∶1 000)、IkBα(1∶1 000)、β-actin(1∶1 000)一抗孵育4 ℃过夜。第2天取出并用磷酸缓冲盐溶液(PBS)洗涤后,在室温下滴加HRP山羊抗兔IgG(1∶5 000)二抗孵育1 h。随后,滴加显影液在化学发光成像仪显影,用Image J软件分析条带灰度值,确定各蛋白的相对比例。

2 结 果
2.1 各组血清炎性因子水平比较 与空白组比较,模型组CRP、IL-1β、TNF-α、TGF-β、IL-18水平明显升高,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组CRP、IL-1β、TNF-α、TGF-β、IL-18水平明显下降,差异均有统计学意义(P<0.01);与黄连解毒汤低、中剂量组比较,黄连解毒汤高剂量组、VX-765组CRP、IL-1β、TNF-α、TGF-β、IL-18水平明显下降,差异均有统计学意义(P<0.01);且VX-765组较黄连解毒汤高剂量组IL-1β、IL-18下降更明显,差异均有统计学意义(P<0.01)。详见表2。

表2 各组新西兰兔血清炎性因子水平比较 (±s)
2.2 HE染色主动脉斑块情况 新西兰兔主动脉HE染色中模型组斑块形成明显,提示通过联合喂养高脂饲料、肌肉注射LPS及腹腔注射维生素D3方法建立新西兰兔动脉粥样硬化模型造模成功。HE染色结果显示,黄连解毒汤各剂量组主动脉粥样硬化斑块较模型组减少,提示黄连解毒汤可以拮抗高脂等复合因素导致动脉粥样硬化斑块的形成,发挥稳定斑块及延缓动脉粥样硬化进展的作用,且以黄连解毒汤高剂量组最为明显,其效果与VX-765大致相当。详见图1。

图1 各组新西兰兔主动脉HE染色(×2)
2.3 细胞焦亡水平
2.3.1 各组IL-1β、IL-18、Caspase-1、NLRP3表达水平比较 与空白组比较,模型组IL-1β表达水平明显上调,差异有统计学意义(P<0.01);与模型组比较,黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组IL-1β表达水平下调,差异均有统计学意义(P<0.05或P<0.01)。与空白组比较,模型组IL-18表达水平明显上调,差异有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组IL-18表达水平下调,差异均有统计学意义(P<0.05或P<0.01)。与空白组比较,模型组Caspase-1表达水平明显上调,差异有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组Caspase-1表达水平下调,差异均有统计学意义(P<0.05或P<0.01)。与空白组比较,模型组NLRP3表达水平明显上调,差异有统计学意义(P<0.01);与模型组比较,黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组NLRP3表达水平明显下调,差异均有统计学意义(P<0.05或P<0.01)。详见图2、图3。

图2 各组新西兰兔主动脉斑块IHC染色后表达情况(×20)

模型组与空白组比较,* P<0.01;与模型组比较,# P<0.05,△ P<0.01。
2.3.2 各组Caspase-1、NLRP3基因表达水平比较 RT-qPCR结果提示,与空白组比较,模型组Caspase-1、NLRP3基因相对表达水平明显升高,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤低剂量组、黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组Caspase-1基因相对表达水平明显降低,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组NLRP3基因相对表达水平明显降低,差异均有统计学意义(P<0.01)。详见图4。
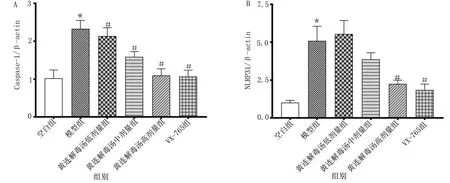
模型组与空白组比较,* P<0.01;与模型组比较,# P<0.01。
2.3.3 各组Caspase-1、NLRP3蛋白表达水平比较 Western Blot结果提示,与空白组比较,模型组Caspase-1、NLRP3蛋白相对表达水平明显升高,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组Caspase-1、NLRP3蛋白相对表达水平明显降低,差异均有统计学意义(P<0.05或P<0.01)。详见图5、图6。
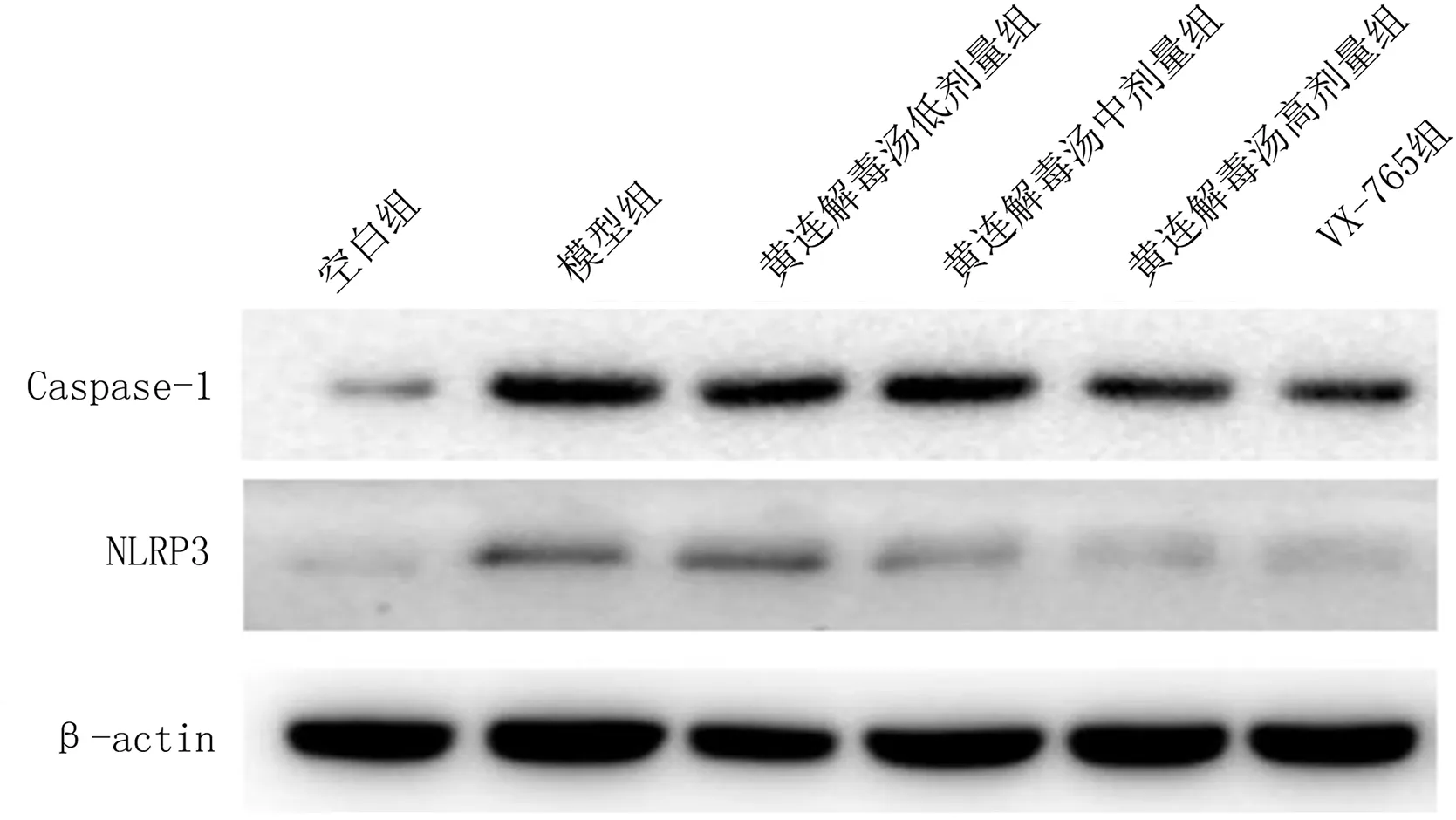
图5 各组新西兰兔主动脉Caspase-1、NLRP3蛋白表达电泳图
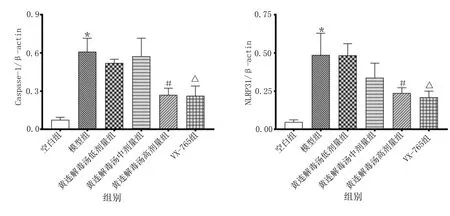
模型组与空白组比较,* P<0.01;与模型组比较,# P<0.01,△ P<0.01。
2.4 各组NF-κB通路蛋白相对表达量比较 Western Blot结果提示,与空白组比较,模型组p50、p65蛋白相对表达水平明显升高,IkBα蛋白相对表达水平明显降低,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组p50蛋白相对表达水平降低,差异均有统计学意义(P<0.05或P<0.01);与模型组比较,黄连解毒汤中剂量组、黄连解毒汤高剂量组、VX-765组p65蛋白相对表达水平明显降低,差异均有统计学意义(P<0.01);与模型组比较,黄连解毒汤高剂量组、VX-765组IkBα蛋白相对表达水平明显升高,差异均有统计学意义(P<0.05)。详见图7、图8。
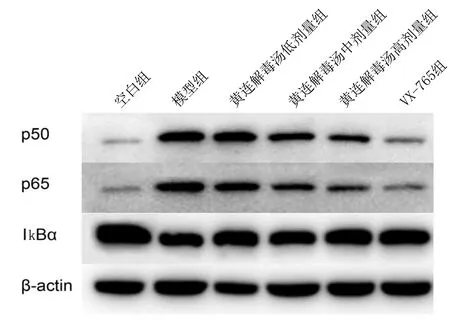
图7 各组NF-κB信号通路蛋白表达电泳图
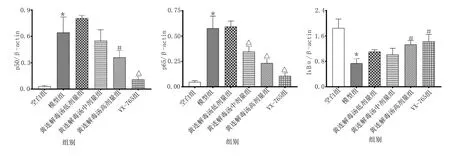
模型组与空白组比较,* P<0.01;与模型组比较,# P<0.05,△ P<0.01。
3 讨 论
动脉粥样硬化的发生始于血管内皮功能障碍,影响诸多病理生理过程如血管炎症、血管张力、线粒体功能、氧化应激等。其中,炎症在动脉粥样硬化进程中发挥重要作用[9],炎性细胞作为早期效应分子,分泌促炎因子(IL-1β、IL-6、IL-8、TNF-α、TGF-β等)进一步加速病变进展,导致斑块破裂、血栓形成,甚至发生急性冠脉综合征[2]。研究表明,急性心肌梗死早期伴有血清TNF-α、IL-1β、IL-6、TGF-β水平明显增加,促炎因子的分泌直接影响梗死区心肌细胞的存活及凋亡[10]。IL-6与肾素-血管紧张素系统(renin-angiotensin system,RAS)的相互作用被认为是动脉粥样硬化的重要发病机制,可诱导氧化应激和内皮功能障碍[11]。在心肌梗死后期,炎性因子的持续增加促进间质纤维化和非梗死区胶原沉积,导致心室功能障碍[12]。炎性因子累积可诱导梗死区局部基质金属蛋白酶和利钠肽表达,促进心脏重构[13]。促炎因子水平被认为是重要的预后因素,与动脉粥样硬化进程明显相关。研究证明,IL-1β可通过调控单核细胞功能诱导IL-10水平升高,并减小动脉粥样硬化斑块面积[14]。黄连解毒汤可通过降低动脉粥样硬化病人机体炎性因子IL-1、IL-6、IL-10、TNF-α的表达水平,缩小动脉血管内中膜厚度和斑块面积[8]。本研究通过构建新西兰兔动脉粥样硬化模型,评估黄连解毒汤对动脉粥样硬化炎症水平的影响。结果表明,黄连解毒汤具有明显的抗炎作用,黄连解毒汤中、高剂量可降低兔血清炎性因子CRP、IL-1β、TNF-α、TGF-β、IL-18水平。
动脉粥样硬化是一个多步骤过程,包括4个主要阶段:内皮损伤、泡沫细胞形成、血管平滑肌细胞增殖、动脉粥样硬化斑块的形成和破裂。同时,斑块易损特征被证明与炎症程度密切相关,抑制关键炎症通路可减轻动脉粥样硬化的发生与进展,并提高斑块稳定性,可能成为靶向性治疗策略。研究表明,组蛋白去乙酰化酶9(histone deacetylase 9,HDAC9)可促进血管系统的炎症水平,并增强动脉粥样硬化斑块的易损性,其促炎效应可被选择性炎症通路抑制TMP195逆转[15]。维生素E可通过炎症信号通路调节脂质稳态和动脉粥样硬化斑块稳定性[16]。帕瑞昔布通过抑制炎症和基质金属蛋白酶的产生改善动脉粥样硬化斑块稳定性[17]。黄连解毒汤可调控肠道菌群抑制高脂饮食导致的小鼠非酒精性脂肪性肝病和动脉粥样硬化斑块的形成[7]。临床数据表明,氧化应激和炎症是年龄相关心血管功能障碍的驱动因素,在动脉粥样硬化斑块稳定和破裂中发挥重要作用[18]。本研究中,兔主动脉HE染色结果显示,黄连解毒汤各干预组主动脉粥样硬化斑块较模型组明显减少,提示黄连解毒汤可以拮抗高脂等复合因素导致动脉粥样硬化斑块的形成,发挥稳定斑块及延缓动脉粥样硬化进展的作用。
现阶段,NLRP3为研究最广泛的一类炎性小体。动脉粥样硬化模型中NLRP3的主要成分(REF61)表达增加,抑制NLRP3炎性小体可降低载脂蛋白E基因敲除(ApoE-/-)小鼠动脉粥样硬化病变程度[19-20]。氧化低密度脂蛋白(ox-LDL)通过结合巨噬细胞表面的CD36/TLR4/TLR6信号复合物,随后诱导胆固醇结晶致巨噬细胞溶酶体损伤导致NLRP3炎性小体的激活[21]。来源于巨噬细胞或树突状细胞中的脂质积累可在多个环节诱导多蛋白复合物炎性小体,通过效应Caspase-1介导IL-1β和IL-18前体蛋白水解成为具有生物活性的IL-1β和IL-18释放,激活下游炎症通路并触发细胞焦亡。外源性成纤维细胞生长因子21(FGF21)治疗可明显减少动脉粥样硬化斑块面积并改善血脂,在体内体外实验中均可降低焦亡蛋白表达[22]。溶血磷脂酰胆碱诱导NLRP3炎性小体介导的IL-1β分泌触发焦亡,促使人单核细胞和内皮细胞泡沫细胞形成[23]。黄连解毒汤可通过调控NLRP3炎性小体,降低小鼠动脉粥样硬化模型主动脉组织中IL-1β、Caspase-1、NLRP3、TNF-α mRNA表达,从而发挥抗动脉粥样硬化作用[24]。本研究使用细胞焦亡抑制剂VX-765进行干预,结果提示,抑制细胞焦亡可拮抗动脉粥样硬化斑块形成,并降低兔血清炎性因子CRP、IL-1β、TNF-α、TGF-β、IL-18水平,且与高剂量黄连解毒汤比较,VX-765组在降低炎性因子IL-18及IL-1β水平上具有更好的治疗效应。同时,高剂量黄连解毒汤与VX-765均可下调基因NLRP3、Caspase-1水平,并明显降低焦亡蛋白IL-1β、IL-18、NLRP3、Caspase-1表达,二者无明显差异,即黄连解毒汤可降低动脉粥样硬化细胞焦亡水平,并起到抗炎作用,其效应与抑制剂VX-765相当。
为明确黄连解毒汤抑制焦亡的分子机制,本研究进一步验证了代表性NF-κB炎症通路下游蛋白表达水平。研究表明,转录因子NF-κB具有调控活性氧(ROS)产生、心肌细胞的存活与凋亡和心肌收缩性等功能[25-27]。亚基p65/p50磷酸化对NF-κB信号通路具有双向调节的作用,取决于所涉及的激酶及特定残基类型[28]。在冠状动脉结扎的心肌梗死模型中,选择性过表达IkBα抑制因子的转基因小鼠生存率提高,心室重构、心肌收缩功能及肺功能改善,并与NF-κB p65活化、细胞因子水平和凋亡水平降低密切相关[29]。基于网络药理学分析显示,黄连解毒汤可能通过NF-κB、MAPK、磷脂酰肌醇3激酶(PI3K)、VEGF信号通路治疗动脉粥样硬化[30]。结合本研究结果,高剂量黄连解毒汤可降低通路中p50、p65蛋白表达,逆转IkBα蛋白降低趋势,且与VX-765组无明显差异,提示黄连解毒汤可调节NF-κB通路,该通路可能为黄连解毒汤发挥抗炎及抗焦亡作用的关键途径。
本研究通过构建新西兰兔动脉粥样硬化动物模型进行体内实验,应用HE染色观察主动脉斑块情况,ELISA检测炎性因子水平,IHC法、RT-qPCR法、Western Blot法从基因和蛋白水平评估细胞焦亡水平,较为全面地评估黄连解毒汤对动脉粥样硬化稳定性的影响。结果表明,黄连解毒汤可通过调控细胞焦亡水平发挥稳定动脉粥样硬化斑块及抗炎作用,可能通过介导NF-κB信号通路实现,具体潜在分子机制需进一步研究验证。
