车前草内生芽孢杆菌CQC1的鉴定与抗菌活性研究
2022-02-15佘媛媛熊苏皖
佘媛媛,陈 陈,熊苏皖,杨 成
(1.皖南医学院临床学院,安徽芜湖 241002;2.皖南医学院微生物学与免疫学教研室,安徽芜湖 241002)
植物内生菌(endophyte),一类特殊的群体,通常指某个阶段或全部阶段生活于健康植物的组织和器官内部的真菌或细菌[1]。几乎所有植物都存在不同种类的内生菌,它与植物细胞之间往往互利互惠,合作共生,且植物内生菌往往能够产生和宿主成分相同或相似的代谢产物,因而,植物内生菌已成为一种新型的微生物资源,是新型天然活性物质的重要来源之一[2-4]。近年来,从各种不同的植物内生菌中分离到不同的抗菌活性成分,包括生物碱、多肽、甾体、萜类、醌类、酮类和酯类等,而这些化合物被认为对医药、农药、食品保鲜防腐剂的研制具有重要意义[3-5]。因此,利用植物内生菌筛选抗菌活性物质,潜力巨大。
车前草(Plantago asiatica L.),药用历史悠久,具有清热利尿、祛痰、凉血、解毒之功效。从车前草中已经分离出黄酮、三萜类及甾体类等60余种化合物,表现出抗菌、利尿、抗氧化、免疫调节及降血尿酸等多种药理作用[6-9]。目前,国内关于车前草内生菌的研究主要集中在内生真菌方面[10-14],尚未见到有关车前草内生细菌拮抗金黄色葡萄球菌的报道。而菌株CQC1是从车前草组织中分离获得一株对金黄色葡萄球菌具有明显拮抗作用的细菌。本研究拟通过形态学观测、生理生化特征及分子生物学手段分析明确CQC1菌株种属分类,采用平皿对峙和牛津杯法研究其抗菌活性,并测试其抗菌谱,在其基础上采用薄层色谱-生物自现影对抗菌成分筛检该菌株抗菌活性成分,为开发具有抗金黄色葡萄球菌活性代谢产物提供一定的资源。
1 材料与方法
1.1 材料
(1)车前草:采自皖南医学院内。
(2)指示菌:金黄色葡萄球菌、白色葡萄球菌、乙型溶血性链球菌、大肠杆菌、沙门氏菌、痢疾杆菌、变形杆菌、绿脓杆菌、白色念珠菌,本实验室。
(3)培养基:斜面与筛选固体培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL,自然pH;液体种子/发酵培养基(液体PDA):马铃薯200 g,葡萄糖20 g,蒸馏水1 000 mL,自然pH;营养培养基(NA):蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.4~7.6。
1.2 方法
1.2.1 车前草内生拮抗性芽孢杆菌分离与纯化
将车前草洗净,超声波清洗一次,先用75%酒精喷洒处理30 s,然后用无菌水冲洗3~5次,接着用10%次氯酸钠浸泡处理5 min,无菌水冲洗3~5次。用无菌生理盐水在超净工作台研磨,取匀浆上清液进行梯度稀释至10-1~10-4,分别吸取100μL涂布于PDA固体平板上,每个梯度重复一次,将平板倒置于37℃细菌恒温培养箱培养。利用固体培养基对分离获得的菌株进行划线纯化,并保存于4℃冰箱备用。
1.2.2 拮抗性芽孢杆菌的鉴定
形态学鉴定:已经纯化CQC1菌株接种至NA培养基上,并置于28℃恒温箱中培养,观察其菌落特征并染色镜检观察菌体形态学特征。
生理生化特征参照《常见细菌系统鉴定手册》[15]相关方法进行测定。
分子生物学鉴定:将纯化CQC1菌株收集菌体,菌株基因组DNA的提取、扩增以及测序纯化由上海生工生物工程股份有限公司完成。采用通用引物7F、1540R进行PCR扩增测序,测序结果在GenBank中进行BLAST比对分析,采用MEGA 7.0构建系统发育树,确定分类地位。
1.2.3 菌株CQC1抗菌活性复筛
采用平皿对峙法:采用NA固体培养基,将保存的指示菌和拮抗芽孢杆菌菌株先复活,然后将指示菌(金黄色葡萄球菌)用无菌水制成1麦氏浓度,用无菌棉棒直接涂布于平板中,然后直接将拮抗芽孢杆菌点接于平板中,37℃培养,观察拮抗芽孢杆菌菌落周围是否形成抑菌圈,并测量抑菌圈直径,重复3次,取平均值作为该样本抑菌结果。
采用牛津杯法:在冷藏保存斜面试管中挑选适量菌体接种至液体种子培养基中,在温度为37℃条件下培养24 h,移取2 mL拮抗芽孢杆菌菌株种子培养液到已经灭菌的液体发酵培养基,在37℃,转速为180 r/min条件下培养48 h得到发酵液,再在12 000 r/min转速下,保持30 min离心收集上清液,作为无菌发酵液备用待测。然后将1麦氏指示菌,用无菌棉棒直接涂布于NA平板中,然后放牛津杯,并让其自然下沉后,吸取200 μL无菌发酵上清液作为样品至牛津杯,轻轻移至37℃恒温培养箱培养24 h,观察抑菌圈,并测量抑菌圈直径,重复3次,取平均值作为该样本抑菌结果。
1.2.4 菌株CQC1发酵上清液抗菌活性成分筛检及其活性测试
采用薄层色谱-生物自显影法[16],将发酵上清液直接作为测试样品和杆菌肽标准样共同点样于硅胶薄层板上,共点两块硅胶薄层板,在三氯甲烷∶甲醇∶水=65∶25∶4的展开剂展开,自然挥发干试剂后,其中一块薄层板用0.4%茚三酮显色;在无菌条件下,将另一块薄层板置于无菌平皿中,加入半固体培养基,使培养基高出硅胶板面1~2 mm,培养基凝固后,用玻璃喷壶将1麦氏浓度的指示菌喷洒于培养基表面,并将平皿置于4℃冰箱,放置1 h以利于活性物质扩散。然后于37℃培养24 h后,取出,向上面喷施外源显色剂噻唑蓝15 min后,观察并拍照实验结果。
1.2.5 抗菌谱测定
采用上述1.2.3试验中的牛津杯法:将上述离心收集上清液,作为无菌发酵液备用待测。然后将供试菌配成1麦氏,用无菌棉棒直接涂布于NA平板中,然后放牛津杯,并让其自然下沉后,加入200μL无菌发酵上清液,轻轻移至37℃恒温培养箱培养24 h,观察是否出现抑菌圈,每个供试菌重复3次。
2 结果与分析
2.1 车前草内生拮抗性芽孢杆菌CQC1分离、纯化及形态学特征
接种于NA培养基,菌株CQC1菌落如图1(A)所示,革兰氏染色油镜下(×1 000)观察如图1(B)所示。由图1可知,在NA固体培养基上,菌株CQC1菌落表面不光滑,中间比边缘略有隆起,乳白色,不透明,菌落边缘不规则,似向外扩展,呈蜡状。由图1可知,菌株CQC1为革兰氏染色阳性,杆状,菌体单个,偶见成双,芽孢杆状透明,位于菌体中间,芽孢囊被菌体包裹,不突出菌体,初步推断菌株CQC1为芽孢杆菌。

图1 菌株CQC1菌落和菌体形态Fig.1 Colony and mycelial morphology of strain CQC1
2.2 拮抗菌株CQC1的生理生化特征
菌株CQC1接触酶、氧化酶、酯酶等阳性,卵磷脂酶、脲酶等阴性,具体生理生化特征见表1。结合菌体培养特征和生理生化特性,菌株CQC1属于芽孢杆菌属中的一种。
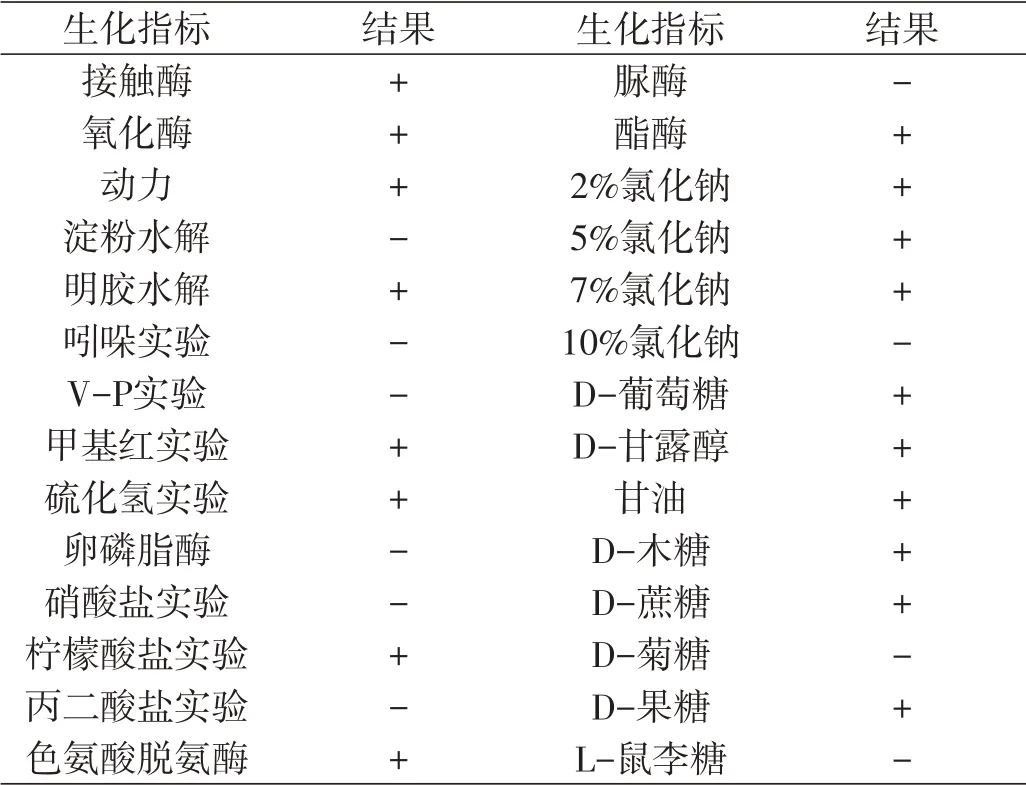
表1 菌株CQC1的生理生化特征Tab.1 Physiological and biochemical characteristics of strain CQC1
2.3 菌株CQC1 16SrDNA序列分析
通过PCR扩增菌株CQC1的16SrDNA序列,片段大小1337bp。利用NCBI数据库进行序列相似性分析,结果发现该菌株CQC1与芽孢杆菌属的高地芽孢杆菌(MT627439.1,MT605506.1,MT605426.1,MT605421.1,MT605414.1,MT598007.1)等序列相似性均为100%(覆盖率100%)。选取与该种菌株同源性接近的菌株,使用软件Mega7.0构建基于16SrDNA序列的系统发育树(图2),结合形态和生理生化特征,初步将菌株CQC1鉴定为高地芽孢杆菌。
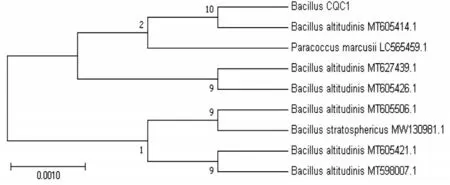
图2 菌株CQC1系统发育树Fig.2 Phylogenetic tree of strain CQC1
2.4 菌株CQC1抗菌活性复筛的检测
菌株CQC1抗菌活性复筛结果见图3所示。通过图3(A)可见,在NA培养基平皿中重复三次点接菌株CQC1,结果显示菌株CQC1菌落周围出现明显抑菌圈,平均为8.7 mm,表明菌株CQC1对供试金黄色葡萄球菌具有拮抗作用。然后采用牛津杯检测菌株CQC1发酵液胞外抗菌活性物质抑菌效果,结果见图3(B)所示,表明菌株CQC1发酵液中具有较强的抗菌物质,重复三次对金黄色葡萄球菌具有明显的抑制效果,抑菌圈平均直径达到22.4 mm。

图3 菌株CQC1和发酵液的抗菌活性Fig.3 Antibacterial activity of strain CQC1 and its fermentation broth
2.5 菌株CQC1发酵上清液抗菌活性成分筛检及其活性测试
以杆菌肽标准样为阳性对照,在三氯甲烷∶甲醇∶水=65∶25∶4的展开剂展开下,对测试样品进行展开分离,其中一块0.4%茚三酮显色,结果如图4(A)所示。另一块抗菌活性成分抑菌实验结果见图4(B)所示。A板直接用茚三酮显色,上清液中出现了与阳性对照一样颜色的斑点,而且呈现3个明显棕红色斑点,表明这3个组分中含有游离氨基,结合与Rf值及阳性对照,初步判断样品第①点可能为杆菌肽;而B板抗菌活性测试结果表明,菌株CQC1发酵上清液中有2个明显的抗菌活性成分,据Rf值位置判断可能为①③点。因此,结合A板和B板的试验结果,可以初步推断菌株CQC1发酵上清液中含有肽类抗菌成分。

图4 薄层层析-生物自显影法检测菌株CQC1中抗菌成分薄层板Fig.4 Antibacterial component screening of strain CQC1 by TLC-bioautography assay
2.6 菌株CQC1发酵上清液抗菌谱测定
通过抑菌圈法测定菌株CQC1发酵上清液抗菌谱,结果发现,菌株CQC1发酵上清液对金黄色葡萄球菌、白色葡萄球菌、乙型溶血行链球菌等革兰氏阳性菌抑制作用比较明显,如表2所示,对变形杆菌显示弱的抑制作用,对其他革兰氏阴性杆菌没有抑制活性。由此可见,菌株CQC1产生的抗菌物质对革兰氏阳性菌比较敏感,好于对革兰氏阴性菌。

表2 菌株CQC1抗菌谱Tab.2 Antibacterial spectrum of strain CQC1
3 讨论
植物内生菌具有独特的生防作用,其抗生作用是微生物防治植物病害的一个重要机制[17]。车前草所含生物活性物质抑菌功能显著,具有重要的医药价值[18-19],而内生菌由于与宿主植物形成特殊生境[20],因而两者具备类似代谢物的合成途径[21-22]。目前,研究者已从多种植物中分离得到对金黄色葡萄球菌有抑制作用的内生菌,如从芍药[23]、明党参[24]、红树[25]、薄荷[26]等多种植物中均分离得到了对金黄色葡萄球菌有抑制作用的内生芽孢杆菌。本研究通过平板对峙法和牛津杯法从车前草中分离获得一株对金黄色葡萄球菌具有抑制活性的高地芽孢杆菌CQC1。NA平板对峙抗菌试验表明,菌株周围抑菌带宽平均为8.7 mm,经牛津杯测定高地芽孢杆菌CQC1无菌发酵液抑菌圈平均直径为22.4 mm。通过对高地芽孢杆菌CQC1无菌发酵液中胞外抗菌物质物理和化学性质的试验,该胞外抗菌成分具有较强的耐热性能,121℃处理后抑菌圈由正常对照组的22.5 mm,仅减少了5.7 mm变为16.8 mm,且耐环境中pH,对蛋白水解酶的水解作用稳定性也较好。而脂肽类物质往往是芽孢杆菌属次生代谢产物中具有抗菌活性成分之一,具有理化性质稳定、抑菌效果明显等特点[27]。黄梦桑等[28]从辣椒根际土壤中分离获得一株对稻黄单胞菌种下的致病变种条斑病菌拮抗作用的高地芽孢杆菌,其抗菌活性物质可能涉及到合成非核糖体多肽类的地衣杆菌素(li⁃chenysin)、丰原素(fengycin)、菌溶素(bacilysin)、细菌素(bacteriocin)以及噬铁素等抑菌活性代谢产物,因此,结合菌株CQC1抗菌活性成分薄层色谱分析推测,该抗菌活性成分极有可能为脂肽类物质。
4 结论
金黄色葡萄球菌是食品中常见的食源性致病菌,容易污染乳制品、水产品和肉制品等食品,从而引起食物中毒,威胁人类的生命健康安全。本实验研究分离获得的高地芽孢杆菌胞外次生代谢产物中脂肽类抗菌物质,对金黄色葡萄球菌具有明显的抑制作用,为车前草内生细菌的研究开发应用奠定了基础。
