湿化学法制备α-Fe2O3的形貌调控及应用的研究进展
2022-02-15陈茜敏吴照金
陈茜敏,吴照金
(安徽工业大学冶金减排与资源利用教育部重点实验室,安徽马鞍山 243000)
α-Fe2O3是最稳定的铁氧化物,广泛存在于岩石及土壤中,通常是其他氧化物的最终产物[1]。α-Fe2O3纳米颗粒已广泛应用于健康以及技术领域,研究表明,控制其形貌、晶体微结构以及尺寸,对于优化其用途有重要意义[2-3]。迄今为止,已报道了多种制备具有独特磁性、化学、光学和催化性能的α-Fe2O3湿化学合成方法,且以上性能与它独特的微观形貌密切相关。独特的微观形貌与性能,使其有效适用于生物医疗、工业废水处理、电池电极等领域[4-5]。本文就近年α-Fe2O3形貌调控的湿化学合成方法的研究展开论述,并指出今后的发展方向。
1 α-Fe2O3的形貌调控
1.1 水热法
Tadic等[6]以六水合氯化铁为原料,采用水热法,改变表面活性剂甘氨酸的比例获得不同形貌的α-Fe2O3。加适量表面活性剂53.4 mmol,可获得磁性较强的椭球形3D结构(图1a),若表面活性剂加入量减半则为版状纳米粒子(图1b),若不添加表面活性剂则形成不规则纳米粒子(图1c)。室温下磁性测试结果表明,椭圆形形态的α-Fe2O3矫顽力比不规则颗粒高35倍,比纳米板高4倍,故合成样品的磁性能与其形状与结构有关。
Song等[7]以K4[Fe(CN)6]·3H2O与H2O2为原料,形成非均相溶液,将其移至高压釜中于160℃恒温反应100 min,最终得到纳米管状α-Fe2O3(图2a和图2b)。研究发现,产物的形貌随反应持续时间的延长而逐渐演化。反应50 min获得的产物为直径50 nm的球形颗粒(图2c),70 min得到球形颗粒链(图2d),90 min形成纳米棒及纳米管混合物(图2e),继续延长反应时间则得到均匀的纳米管结构。同时发现,纳米管状的α-Fe2O3在较低温度下对高氯酸的分解表现出最高的光催化活性,为基于形貌调控制备高效光催化剂提供了一种新可能。

图2 α-Fe2O3随水热反应时间的形貌演变:反应100 min(a)和(b)、50 min(c)、70 min(d)、90 min(e)产物的TEM图像[7]Fig.2 Morphology evolution ofα-Fe2O3 with hydrothermal reaction time:TEM images of products prepared for 100 min(a)and(b),50 min(c),70 min(d)and 90 min(e)[7]
Xin等[8]以七水合氯化铁为起始反应物,通过水热法一步制得沉积于泡沫镍衬底上的棘状α-Fe2O3。XRD结果显示(图3a),除了衬底材料镍的衍射峰(星号)外,产物的所有其他衍射峰都可归为六方α-Fe2O3。SEM分析表明,在3D镍泡沫上紧密生长着大量高密度颗粒物(图3c和图3d),进一步观察发现,这些颗粒具有棘突结构(图3e和图3f),每一个棘突包含许多通过自组装形成的纳米片。所合成的产物具有出色的光催化活性,可用于有机染料的降解,又因其独特的3D形貌,可提供大量活性位点并增强电极与泡沫镍之间的结合,进而促进载流子的输运性能,可用作超级电容器的电极活性材料。

图3 (a)合成产物的典型XRD图像;(b)纯镍泡沫SEM图像;(c~f)α-Fe2O3的SEM图像[8]Fig.3(a)Typical XRD pattern of the as-synthesized product;(b)SEM image of pure Nifoam;(c~f)SEM images of the as-synthesizedα-Fe2O3[8]
水热法可合成微球状、纳米棒状、纳米管状、棘状等不同形貌的α-Fe2O3。该方法以可重复、环保、耗能低的方式制造出形貌可控的高质量产物,但通常只能制备氧化物粉体。可通过控制表面活性剂浓度、前驱体浓度、反应时间、反应温度等[9-10]来调控产物的形貌,并且通过控制产物的形态和尺寸可以改善α-Fe2O3纳米粒子的性能。
1.2 溶剂热法
Qing等[11]以六水合氯化铁为原料,利用无模板微波辅助热溶剂技术成功制备出α-Fe2O3。不同成分溶剂合成的产物SEM图像如图4a~d所示,20%乙醇和水混合为溶剂,产物为大量纳米颗粒,部分颗粒为花状晶体(图4a);50%乙醇和水混合为溶剂,产物沿生长方向呈锥形,开始出现规则的、几何对称性好的花状纳米结构(图4b)。在水-乙醇混合溶剂中,乙醇含量达80%和90%的条件下,产物的每个分形都显示出清晰的叶状纳米结构(图4c~d),故3D叶状α-Fe2O3结构可以通过调节水-乙醇的比例来控制。此外,研究表明,3D叶状α-Fe2O3对丙酮气体表现出优异的传感器响应,因此该产物可以作为丙酮气体传感器最有希望的候选者。

图4 水-乙醇溶剂热法合成的α-Fe2O3 SEM图像(乙醇分别占比20%(a)、50%(b)、80%(c)、90%(d))[11]Fig.4 SEM images ofα-Fe2O3 synthesized by water-ethanol solvothermal method(ethanol accounted for 20%(a),50%(b),80%(c)and 90%respectively)[11]
Xi等[12]以九水合硝酸铁为原料,利用溶剂热法制备出微球状的α-Fe2O3(图5a)。从高倍TEM图像(图5b~c)中可以看出,α-Fe2O3空心微球由片状积木组成,HRTEM图像(图5d)表明该样品具有连续晶格条纹及良好结晶性质。各项表征结果显示,该样品特殊表面积有利于增加电极与电解质之间的接触面积,从而提高电化学性能,可以作为锂离子电池的材料,将来可用作高性能阳极材料。
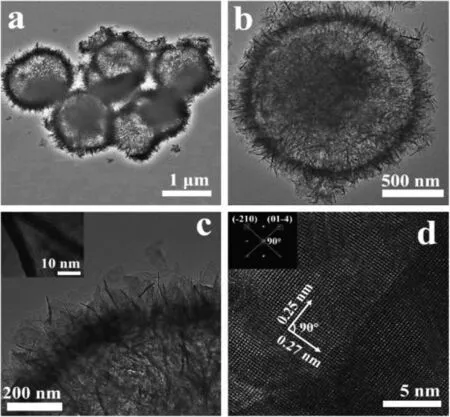
图5 中空微球状α-Fe2O3的低倍(a)、高倍(b,c)TEM图像,α-Fe2O3纳米薄片的HRTEM图像(d)[12]Fig.5 TEM image of hollow microsphereα-Fe2O3 at low-magnification(a)and high-magnification(b,c);(d)HRTEM image of a typicalα-Fe2O3 nanoflake[12]
溶剂热法可制得微球状、叶状、纳米棒状等形貌的α-Fe2O3。溶剂热法与水热法几乎相同,但溶剂法中使用非水溶液代替水。与水热法相比,由于使用的溶剂大多为有机溶剂,具有较高沸点,故溶剂反应的温度将会大大提高。在溶剂热法中,有机溶剂的性质对产物的形貌起重要的控制作用,产物的不同形貌对其性质也具有一定的影响。
2 电沉积法
Meng等[13]以四水合氯化亚铁和六水合氯化铁为原料,利用电化学沉积工艺制得准六边形的α-Fe2O3。研究表明,α-Fe2O3纳米颗粒的大小和形态与沉积时间有关。沉淀前产物形貌不规则(图6a),沉积时间为50 s的α-Fe2O3颗粒数量少,粒径小(图6b),沉淀时间为200 s的α-Fe2O3颗粒呈现准六边形,分散良好,颗粒均匀(图6d)。由图6b~d可知,α-Fe2O3粒子的尺寸随沉积时间的增长而增大,因此α-Fe2O3的形貌可以通过改变沉积时间来调控。

图6 不同沉积时间所得α-Fe2O3纳米颗粒的SEM图像:0 s(a)、50 s(b)、100 s(c)和200 s(d)[13]Fig.6 The SEM images ofα-Fe2O3 nanoparticles prepared at different deposition time:0 s(a),50 s(b),100 s(c)and 200 s(d)[13]
电沉积法可制得六边形、微球形的α-Fe2O3。与其他方法相比,电沉积法的优点是具有成本效益,环境友好;缺点是工艺较复杂,制作速度慢。使用电沉积法时,通过控制沉积时间、反应温度及反应物浓度可对产物的尺寸、形状及结晶度进行有效调控。
3 α-Fe2O3的应用
生物医学领域:α-Fe2O3具有稳定的化学性质及优良的物理性质,广泛应用于生物医学领域,例如诊断和磁场辅助放疗、磁共振成像和癌症治疗、引导药物输送、治疗贫血等[14-16]。
工业领域:α-Fe2O3独特的形貌使其具有较大的比表面积,表面效应显著,可用于光催化降解水中有机污染物。此外,α-Fe2O3还具有较强的表面张力,可产生较强的吸附能力,用于水中重金属离子或有毒污染物的吸附[17-19]。
电池电极领域:α-Fe2O3具有很高的理论比容量,可用于制备光化学电池,也可将其负载在石墨烯上以形成稳定的结构作为锂离子电池的负极材料,使它们各自发挥优点,提高整体性能[20-21]。
4 结论与展望
目前可采用不同的制备方法制备出多种形貌的α-Fe2O3。本文综述了湿法制备不同形貌的α-Fe2O3,如通过水热法可制备出椭圆形、版状、纳米棒状等形状的α-Fe2O3,可通过控制反应时间、表面活性剂浓度等调控产物形貌;通过溶剂热法可制备出叶状、中空微球状的α-Fe2O3,可通过改变溶剂性质来调控产物形貌;通过电沉积法制备出准六边形的α-Fe2O3,可通过改变沉积时间来调控产物形貌。研究表明,不同形貌的α-Fe2O3具有不同的物理化学性质,从而α-Fe2O3在医学、工业、光化学电池等领域被广泛应用,因此α-Fe2O3在未来具有重要的研究价值。鉴于α-Fe2O3的物理与化学性能与它的微观形貌和尺寸密切相关,基于应用定制的纳米形貌调控将是α-Fe2O3湿化学合成方法及其性能研究的重点。
