黑菊芋多糖的提取工艺优化及其体外益生活性的研究
2022-02-15姬妍茹杨庆丽张正海董艳石杰高宝昌田媛李国巍
姬妍茹,杨庆丽,张正海,董艳,石杰,高宝昌,田媛,李国巍
(黑龙江省科学院 大庆分院,黑龙江 大庆 163319)
菊芋(jerusalem anichoke)俗称洋姜,菊科向日葵属草本植物。菊芋含有丰富的营养物质,如多糖、蛋白质、维生素、膳食纤维和硒等,具有较高的营养价值和多种生理功能[1]。鲜菊芋多糖(菊糖)是菊芋的主要功效成分,占其干重的70%以上,具有双向调控血糖、改善肠道、防治便秘、促进矿物质吸收、预防肥胖、降血脂、抗肿瘤和提高免疫力等生理功能[2]。菊芋多糖由果聚糖组成,是已被科学论证过的符合益生元定义的不易被人体消化的多糖[3-4]。菊糖在人体的上消化道中不会发生消化分解,部分菊糖在结肠中可被益生菌发酵产生很少的热量[5-7]和短链脂肪酸(short chain fatty acids,SCFA)[8],能够发挥改善肠道微环境,有效预防便秘等多种生理功效[9]。菊芋块茎不耐贮存,通常直接炒食或者腌制成酱菜,口感脆硬,基本无甜味;黑菊芋是以鲜菊芋为原料,利用独特的齿变加热工艺加工而成的一种类似果脯的新型功能食品。前期研究发现,菊芋加工成黑菊芋后,糖类的构成和含量显著改变,总糖含量有所降低,果聚糖分解为果糖、葡萄糖、蔗糖和低聚果糖等小分子糖类,还原糖含量显著增加,占总糖含量的40%以上,是加工前的几十倍,因而黑菊芋呈现香甜的口感[10]。
菊糖的制备流程一般分为预处理、提取和纯化三步。预处理主要包括热烫灭酶和干制,提取方法主要包括热水浸提法、微波辅助法、超声辅助法和酶解法,纯化方法主要有盐析法、石灰沉淀法、溶剂萃取法、透析法、离子交换法、色谱法以及酶解法等[11]。鲜菊芋经高温加工成黑菊芋,其中的多酚氧化酶被灭活,多糖组成发生较大改变。因此,在提取黑菊芋多糖时,可以取消热烫灭酶的预处理步骤。本研究采用超声波辅助法提取黑菊芋多糖,并通过正交试验进行工艺优化,通过傅立叶红外光谱(Fourier transform infra red,FT-IR)对得到的多糖组分进行表征,并对多糖的益生活性进行评价。
1 材料与方法
1.1 材料与试剂
黑菊芋:以红果菊芋为原料,利用黑龙江省科学院大庆分院自制设备加工而成;果糖、葡萄糖、蔗糖、蔗果三糖、蔗果四糖、蔗果五糖(均为色谱纯):北京中科仪友化工研究院;植物乳杆菌菌株ZL9、干酪乳杆菌菌株GL6:黑龙江省科学院微生物所;无水乙醇、苯酚、硫酸、3,5-二硝基水杨酸(均为国产分析纯):上海国药化学试剂有限公司。
1.2 仪器与设备
压力蒸汽灭菌器(LDZX-40SCI):上海申安医疗仪器厂;高速离心机(GT10-1):北京时代北利离心机有限公司冷冻干燥机(VFD-4500):北京博医康实验仪器有限公司;超声波清洗仪(KQ3200):昆山市超声仪器有限公司;高效液相色谱(LC-15C):日本岛津公司;酶标仪(Epoch):美国 BioTek公司。
1.3 试验方法
1.3.1 黑菊芋多糖的提取
称取10.0 g黑菊芋,切成1.5 cm左右的薄片,用50mL的蒸馏水80℃恒温浸提16h,匀浆,然后以150W功率按照一定的超声温度、超声时间和料液比进行提取,六层纱布过滤,4 000 r/min离心10 min,取上清,即为黑菊芋粗多糖溶液。
1.3.2 黑菊芋多糖提取工艺优化
分别以超声温度、超声时间和料液比为影响因子进行单因素试验。各因子设5个水平,超声温度设为 60、70、80、90、100 ℃,超声时间设为 40、50、60、70、80 min,料液比设为 1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),每组试验设3个平行。提取液离心取上清液,采用苯酚-硫酸法测定多糖含量[12],计算多糖得率,确定单因素最佳条件。在此基础上进行正交试验,确定黑菊芋多糖的最佳提取工艺,多糖得率计算公式如下。

1.3.3 黑菊芋多糖的纯化
向黑菊芋粗多糖溶液中加入氯仿-正丁醇(体积比4∶1)混合液多次萃取除去蛋白,直至两相间无乳白色絮状物。浓缩至初体积的10%,加入乙醇至最终体积分数占比为80%,4℃条件下醇沉12 h,离心除去上清液,然后依次用无水乙醇、石油醚、丙酮洗涤,冻干,得黑菊芋多糖冻干粉。黑菊芋多糖用S-8大孔树脂静态吸附脱色除去类黑精,透析、浓缩、醇沉、洗涤、再次冻干。将DEAE纤维素柱用蒸馏水平衡好后,首先以蒸馏水对黑菊芋多糖进行洗脱,然后用0.1 mol/L~0.5 mol/L的NaCl溶液进行梯度洗脱,流速0.6 mL/min,同时以每管10 mL收集并跟踪检测多糖含量,合并含糖的洗脱液,冷冻干燥得黑菊芋纯化多糖,经300 Da的透析膜透析后用于益生活性的评价。
1.3.4 红外光谱分析
称取1.0 mg黑菊芋纯化多糖,在玛瑙研钵中加入100 mg KBr粉末,充分研磨均匀,压成薄片,用红外光谱分析仪在4 000 cm-1~400 cm-1进行扫描。
1.3.5 紫外扫描分析
黑菊芋纯化多糖冻干粉用蒸馏水配制成1.0 mg/mL的溶液,用紫外分光光度计在200 nm~400 nm波长下扫描,观察记录在波长260 nm和280 nm时,黑菊芋纯化多糖的吸光度。
1.3.6 各种糖分含量分析
称取适量黑菊芋,对其主要糖分进行检测分析。采用苯酚-硫酸法检测总糖含量[12],二硝基水杨酸法检测还原糖含量[13];总糖含量减去还原糖含量得菊糖含量;采用GB 5009.8—2016《食品安全国家标准食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》检测果糖、葡萄糖、蔗糖的含量[14]。
果糖的检测条件:色谱柱为AgilentZORBAXNH2柱(5.0 μm×4.6 mm×150 mm);流动相为乙腈-水(体积比70∶30),等度洗脱,流速为 1 mL/min;进样量 1.0 μL;柱温30℃。检测器为蒸发光散射检测器(evaporative lightscattering detector,ELSD),漂移管温度 80℃~90℃,氮气压力350 kPa;撞击器:关。
低聚果糖的检测[15],以蔗果三糖、蔗果四糖和蔗果五糖为标准品制作标准曲线。色谱柱:Agilent ZORBAX NH2柱(5.0 μm×4.6 mm×150 mm);流动相为乙腈-水(体积比 75∶25)。进样量为 5 μL~10 μL。漂移管温度80℃~90℃,氮气压力350 kPa;撞击器:关。
1.3.7 黑菊芋纯化多糖的益生活性评价
参试的乳杆菌菌株有2个,分别为植物乳杆菌ZL9和干酪乳杆菌GL6。将参试乳杆菌活化复壮备用,配制无糖的MRS液体培养基,调节pH值至6.0。按照培养基中葡萄糖的比例分别加入葡萄糖、果糖、低聚果糖、去除单糖的鲜菊芋纯化多糖和去除单糖的黑菊芋纯化多糖。无糖的培养基用CK表示,含有葡萄糖、果糖、低聚果糖、去除单糖的鲜菊芋纯化多糖和去除单糖的黑菊芋纯化多糖的培养基分别用代号G、F、FOS、RJPS、BJPS表示,每个处理设3次重复。然后将配制好的液体培养基分装入瓶中,分装体积为22.5 mL。以CK培养基作为对照,菌种接种量1%,37℃条件下厌氧培养,分别于0、24、48 h测OD值和pH值,计算益生指数PI值[16]。
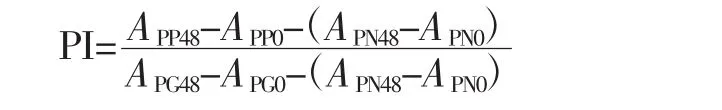
式中:APP0和APP48分别为益生菌培养0、48 h的吸光值(碳源为除葡萄糖外其他糖);APG0和APG48为碳源为葡萄糖时益生菌培养 0、48 h的吸光值;APN0和APN48为益生菌在CK培养基上培养0、48 h的吸光值。
1.4 数据处理
本研究中的每个处理均进行3次平行试验,表格中的数据以平均值±标准差表示,采用DPS V 7.05软件处理数据,组间差异显著性比较以单因素方差分析(One-way ANOVA)进行,并做 Turkey检验,当 P<0.05时表示具有显著性差异。
2 结果与分析
2.1 黑菊芋多糖的提取
2.1.1 单因素试验
不同提取条件对黑菊芋多糖得率的影响见图1~图3。

图1 不同超声时间对多糖得率的影响Fig.1 Effects of ultrasonic time on the yield of polysaccharide
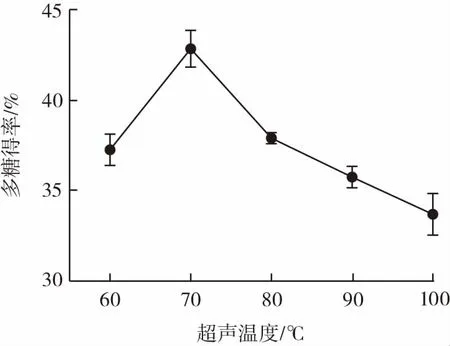
图2 不同超声温度对多糖得率的影响Fig.2 Effects of ultrasonic temperature on the yield of polysaccharide

图3 不同料液比对多糖得率的影响Fig.3 Effects of material liquid ratio on the yield of polysaccharide
由图1可知,40 min~60 min时,随着超声时间的增加,得率逐渐升高,超声时间60 min时,黑菊芋多糖的得率最高。这是由于超声波的空化效应增强了溶剂水进入溶质内部的能力,使多糖更易于从细胞中释放出来,缩短提取时间,提升提取率。超声时间的长短很关键,时间太短,原料中的多糖不能充分溶解,时间过长,多糖会降解,甚至其中的五碳环或六碳环会裂解转变为单糖、寡糖或低聚糖,在醇沉过程中有所损失,导致提取率的下降[17]。由图2可知,采用水提法提取黑菊芋多糖,超声温度在60℃~70℃时,多糖的得率随温度升高逐渐增加,至70℃达到最高值,之后逐渐下降。原因可能是随着温度升高多糖的溶解度逐渐升高,前期多糖得率有所上升,但是随着温度的持续升高,多糖会发生分解,同时美拉德反应加剧,多糖和氨基酸发生反应,有所消耗,造成多糖含量的下降。由图3可知,随着提取剂用量的增加,多糖得率呈现先逐渐增加后减小的趋势,料液比1∶20(g/mL)时多糖得率最高。这是因为提取溶剂用量低时,体系水分含量较少,黑菊芋多糖无法与水充分接触,溶解不够充分,不利于多糖溶出,故得率较低;随着体系含水量增加,多糖充分溶胀,得率增加。但是,提取溶剂用量过多会影响超声处理过程中的空化效应和机械振动效果,反而会使多糖得率下降。
2.1.2 正交试验结果
正交试验、极差和方差分析结果见表1和表2。
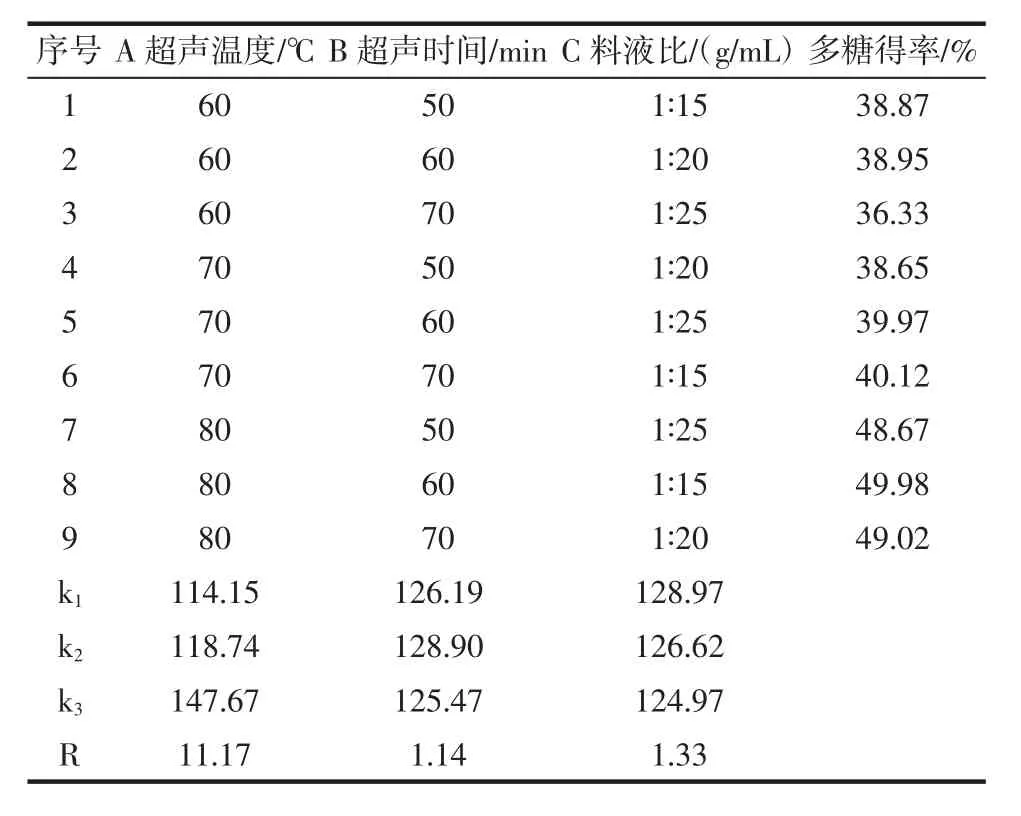
表1 正交试验设计及结果分析Table 1 Orthogonal design and results
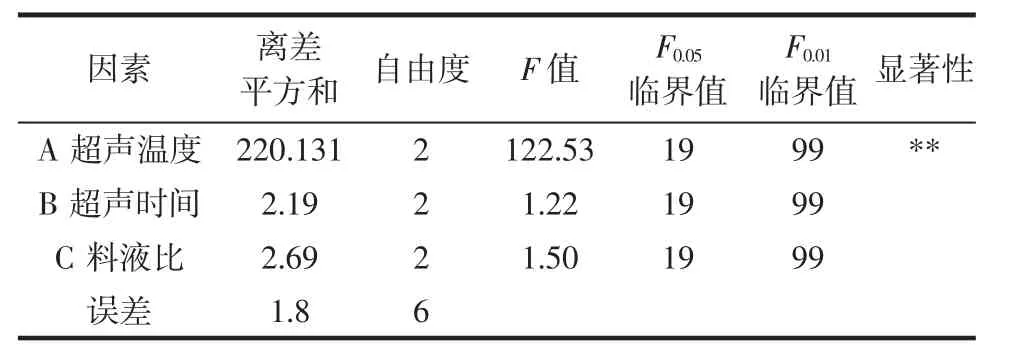
表2 正交试验方差分析结果Table 2 Analysis results of orthogonal experiments
由方差分析F值和F临界值关系可知,超声温度对黑菊芋多糖得率的影响极显著(P<0.01),超声时间和料液比对黑菊芋多糖得率的影响不显著(P>0.05)。通过极差分析可知,影响黑菊芋多糖得率的各因素主次关系依次为超声温度>料液比>超声时间,正交分析得最佳工艺条件为A3B2C1,即超声温度80℃,超声时间 60 min,料液比 1∶15(g/mL)。在最佳工艺条件下进行3次平行试验,得黑菊芋多糖得率平均值为49.98%。
2.2 黑菊芋纯化多糖的红外光谱分析
黑菊芋纯化多糖的红外光谱分析见图4。

图4 黑菊芋纯化多糖的红外光谱图Fig.4 Infrared spectrum of purified polysaccharide from black jerusalem artichoke
FT-IR分析可以作为化合物种类的鉴定依据。单糖、糖苷键和功能团的种类可以通过FT-IR鉴定[18]。从图4可以看出,受试样品在3440cm-1处有较强的振动吸收峰,表明分子间或者分子内有-OH[19];在2 935 cm-1有吸收峰,说明分子内有C-H;1 652 cm-1为-OH的弯曲振动吸收峰[20],1 450 cm-1为-CH(OCH2)弯曲振动吸收峰;1 035 cm-1为-CO 伸缩振动峰;925 cm-1~1 035 cm-1之间主要为C-C和C-O的特征吸收,说明提取物中主要为多糖类物质;925 cm-1和820 cm-1附近为果糖的β-糖苷键[21],研究结果表明,纯化得到的粉末为多糖类物质。
2.3 黑菊芋纯化多糖的紫外扫描结果
黑菊芋纯化多糖的紫外扫描结果见图5。
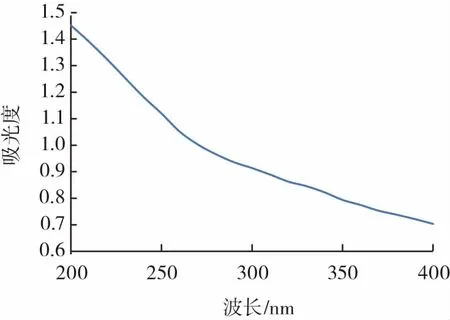
图5 黑菊芋纯化多糖在不同波长条件下的吸光度Fig.5 Absorbance of black jerusalem artichoke purified polysaccharide at different wavelengths
采用紫外分光光度计对多糖溶液进行全波长扫描,可以验证经氯仿-正丁醇法除蛋白和DEAE纤维素柱纯化后的黑菊芋多糖的状态。由图5可知,黑菊芋纯化多糖溶液在260 nm和280 nm处都没有明显的吸收峰,说明获得的黑菊芋样品纯度较高,其中没有或者只有微量的蛋白质和核酸等成分的存在。
2.4 各种糖分含量分析
果糖标准曲线方程:Y=2 221.4X+310.7,R2=0.9993;葡萄糖标准曲线方程:Y=1 944.9X+472.4,R2=0.999 7;蔗糖标准曲线方程:Y=2 597.7X+222.0,R2=0.9993。蔗果三糖标准曲线方程:Y=38.073X+1.066 5,R2=0.999 8;蔗果四糖标准曲线方程:Y=29.624X+1.355 1,R2=0.998 9;蔗果五糖标准曲线方程:Y=32.303X+2.4215,R2=0.9996。
按照1.3.6方法,测得黑菊芋的总糖含量为33.81 g/100 g,还原糖含量为9.71 g/100 g,菊糖含量为24.1 g/100 g。根据蔗果三糖、蔗果四糖和蔗果五糖的标准曲线,计算得出黑菊芋样品中的蔗果三糖、蔗果四糖、蔗果五糖含量分别为1.63、7.92、6.22 g/100 g。这3种糖的含量占总糖含量的46.64%,菊糖含量的65.44%。推测低聚果糖是黑菊芋多糖的主要成分,且占比接近50%,这有利于其发挥益生活性。
2.5 黑菊芋多糖的益生活性
不同种类的糖对发酵液pH值的影响见图6。不同乳杆菌菌株培养基48 h的PI值见表3。
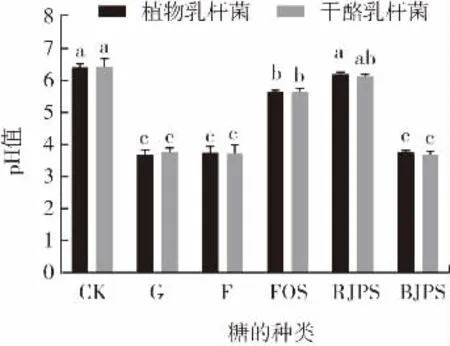
图6 含有不同种类糖的培养基pH值变化情况Fig.6 Changes of pH value of medium containing different kinds of sugars

表3 不同乳杆菌菌株48 h培养基PI值Table 3 PI value of medium of different Lactobacillus strains at 48 h
细菌对碳水化合物的利用情况可通过培养液的pH值变化和PI值的大小来衡量,有文献表明,pH值变化与乳杆菌的生长情况有相关性,乳杆菌生长越快,培养液的pH值下降越明显[16]。由图6可知,以不同糖为碳源的培养液的pH值变化有所不同。2种乳杆菌株在CK培养基虽然能够生长,但其pH值均在6.4以上,说明长势一般[16]。以葡萄糖、果糖和去除单糖的黑菊芋纯化多糖为碳源的培养液pH值均低于4.0,而以低聚果糖和去除单糖的鲜菊芋纯化多糖为碳源的培养液pH值在5.5到6.3之间;由表3可知,2种乳杆菌菌株发酵低聚果糖的PI值均在0.66以上,发酵去除单糖的黑菊芋纯化多糖的PI值均在0.80以上,发酵去除单糖的鲜菊芋纯化多糖的PI值在0.58以上。去除单糖的黑菊芋多糖对植物乳杆菌ZL9的益生活性显著高于低聚果糖(P<0.05),但对干酪乳杆菌菌株GL6的益生活性与低聚果糖差异不显著(P>0.05);去除单糖的黑菊芋纯化多糖对2种乳杆菌菌株的益生活性均显著高于去除单糖的鲜菊芋纯化多糖(P<0.05),这与黑菊芋多糖中低聚果糖比例较高有一定的相关性,李琬聪[22]研究表明除去二聚糖外,菊糖的生物活性与聚合度之间遵循“低聚合度活性高”的规律,三聚菊糖和四聚菊糖表现出最佳活性。
3 结论
本研究以黑菊芋为原料,以水为溶剂,采用超声辅助法提取黑菊芋多糖,确定了黑菊芋多糖超声辅助提取的较优条件为超声温度80℃、超声时间60 min、料液比1∶15(g/mL),在此条件下进行3次平行试验,黑菊芋多糖平均得率为49.98%;黑菊芋多糖组成以果糖、葡萄糖、蔗糖和低聚果糖为主,体外益生活性研究表明,黑菊芋多糖可有效促进植物乳杆菌菌株ZL9和干酪乳杆菌菌株GL6的增殖,具有较好的益生活性。本研究为黑菊芋的推广应用和深度开发提供了理论依据。
